
- •Механика
- •1. Система отсчета. Радиус-вектор материальной точки. Закон движения материальной точки (мт).
- •2. Вектор перемещения (мт). Путь. Скорость. Ускорение.
- •3. Угловая скорость. Угловое ускорение.
- •4. Нормальное и тангенциальное ускорения.
- •5. Пространство и время в движущихся системах отсчета. Закон инерции Галилея. Инерциальные системы отсчета (исо). Преобразования Галилея и следствия из них.
- •Пример преобразования Галилея:
- •15. Уравнение Ньютона-Эйнштейна. 2-й закон Ньютона.
- •16. Момент силы. Момент импульса частицы. Момент инерции.
- •Электромагнетизм и электромагнитные волны
- •Фундаментальные свойства зарядов
- •2. Электрическое поле. Напряженность электрического поля. Принцип суперпозиции.
- •3. Потенциал электрического поля. Эквипотенциали. Связь потенциала и напряженности электрического поля.
- •Где символ частной производной подчеркивает, что дифференцирование производится только по х. Повторив аналогичные рассуждения для осей у и z, можем найти вектор ё:
- •4. Проводник в электрическом поле. Электростатическая индукция.
- •5. Атомы и молекулы в электрическом поле.
- •6. Поляризация диэлектриков. Вектор поляризации. Диэлектрическая проницаемость вещества. Электрическое смещение.
- •7. Сегнетоэлектрики. Пьезоэлектрический эффект. Обратный пьезоэлектрический эффект.
- •8. Электрическое поле заряженного проводника. Электроемкость проводника.
- •9. Конденсаторы. Поле внутри плоского конденсатора.
- •10. Энергия системы зарядов. Энергия электрического поля.
- •11. Классическая теория электропроводности. Закон Ома в дифференциальной (локальной) форме. Закон Ома для однородного проводника.
- •12. Закон Джоуля – Ленца в дифференциальной форме. Закон Джоуля-Ленца для однородного проводника.
- •18. Контур с током в магнитном поле.
- •19. Атомы и молекулы в магнитном поле. Парамагнетики.
- •20. Диамагнетики. Природа диамагнетизма.
- •21. Вектор намагниченности. Магнитная проницаемость вещества. Напряженность магнитного поля.
- •22. Ферромагнетики. Домены. Петля гистерезиса.
- •26. Явление самоиндукции. Индуктивность.
- •27. Энергия магнитного поля. Объемная плотность энергии.
- •28. Гипотеза Максвелла: магнитоэлектрическая индукция.
- •30. Свободные затухающие колебания. Период колебаний.
- •31. Вынужденные электрические колебания. Резонанс.
- •32. Возникновение электромагнитной волны. Волновое уравнение для электромагнитного поля. Плоская электромагнитная волна.
- •38. Методы получения когерентных источников (методы наблюдения интерференции).
- •Квантовая механика
- •1. Фотоэффект. Квантовый характер электромагнитного излучения. Формула Эйнштейна для фотоэффекта.
- •2. Фотоны. Энергия, масса и импульс фотона. Корпускулярно-волновой дуализм света.
- •3. Гипотеза де Бройля. Волна де Бройля. Экспериментальное подтверждение волновых свойств частиц.
- •А)Опыт к. Дэвиссона и л. Джермера (1927 г.)
- •B) Опыт Томсона и Тартаковского.
- •4. Особенности описания движения микрочастиц. Соотношения неопределенностей.
- •5. Уравнение Шрёдингера. Волновая функция.
- •6. Частица в одномерной бесконечно глубокой потенциальной яме.
- •7. Квантовый гармонический осциллятор. Энергия нулевых колебаний.
- •10. Уравнение Шредингера для атома водорода. Квантовые числа.
- •Основные квантовые числа
- •13. Строение многоэлектронного атома. Периодическая система элементов Менделеева.
- •Термодинамика и статистическая физика
- •1. Макросистема и методы ее описания. Контакты систем. Температура.
- •2. Тепловое равновесие. Уравнение состояния. Модель идеального газа.
- •3. Равновесные процессы. Изопроцессы.
- •6. Теплота. 1-е начало термодинамики.
- •7. Теплоемкость идеального газа. Соотношение Майера.
- •8. Зависимость теплоемкости многоатомного газа от температуры.
- •38. Лазеры. Процесс генерации.
- •39. Лазеры. Создание инверсной населенности.
- •40. Фермионы. Распределение Ферми-Дирака. Заполнение электронами разрешенных уровней в кристалле.
- •41. Энергетические уровни в атоме и энергетические зоны в кристалле.
- •42. Распределение электронов по квантовым состояниям в кристалле. Проводники и диэлектрики.
- •51. Деление ядер. Цепная реакция деления. Ядерные реакторы.
- •54. Квантовые числа элементарных частиц. Частицы и античастицы.
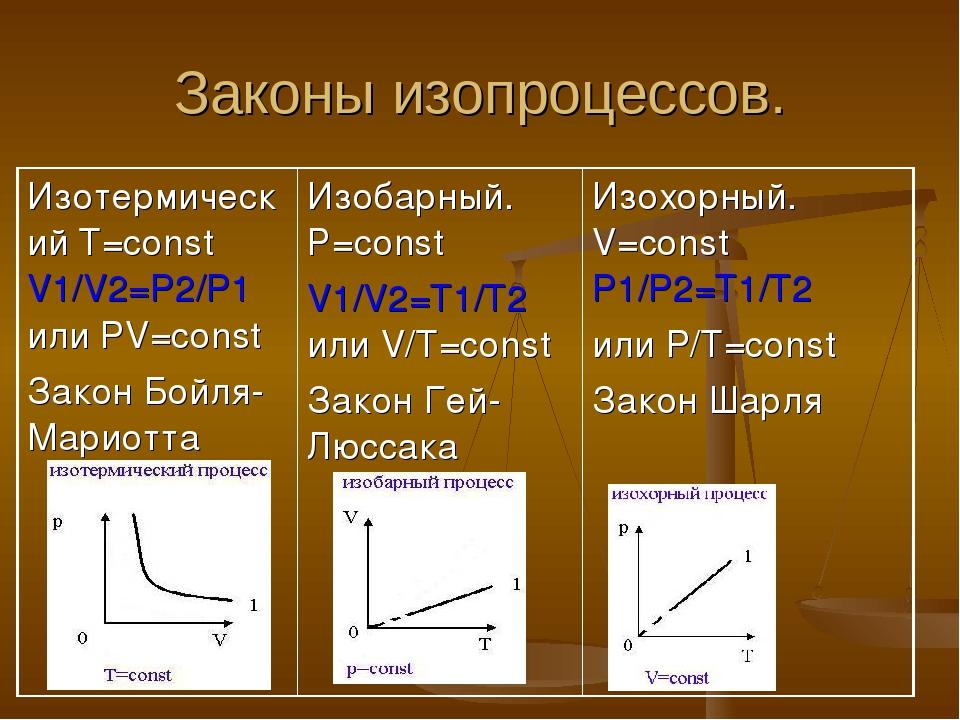
3. Равновесные процессы. Изопроцессы.
Равновесным, или квазистатическим, называется процесс, в котором система под влиянием бесконечно малых воздействий со стороны внешней среды или вследствие наличия внутренней бесконечно малой разности в величинах интенсивных параметров бесконечно медленно проходит непрерывный ряд состояний, как угодно мало отличающихся от равновесных.
Упрощая, можно сказать, что в равновесном процессе силы, действующие на систему, почти точно уравновешиваются другими силами со стороны системы. Отсюда ясно, что если снять движущие воздействия, процесс прекратится. Если же изменить знак воздействий, начнется обратный процесс. Таким образом, равновесному процессу присуща двусторонность.
Другая особенность равновесного процесса — отсутствие потерь энергии на преодоление трения, завихрений потоков в газах и жидкостях. Следовательно, работа, совершаемая системой против внешней среды в равновесном процессе, максимально возможная. Энергия же, рассеянная в виде теплоты, минимальна.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
Адиабатический процесс - это такое изменение состояний газа, при котором он не отдает и не поглощает извне теплоты. Следовательно, адиабатический процесс характеризуется отсутствием теплообмена газа с окружающей средой.
4.
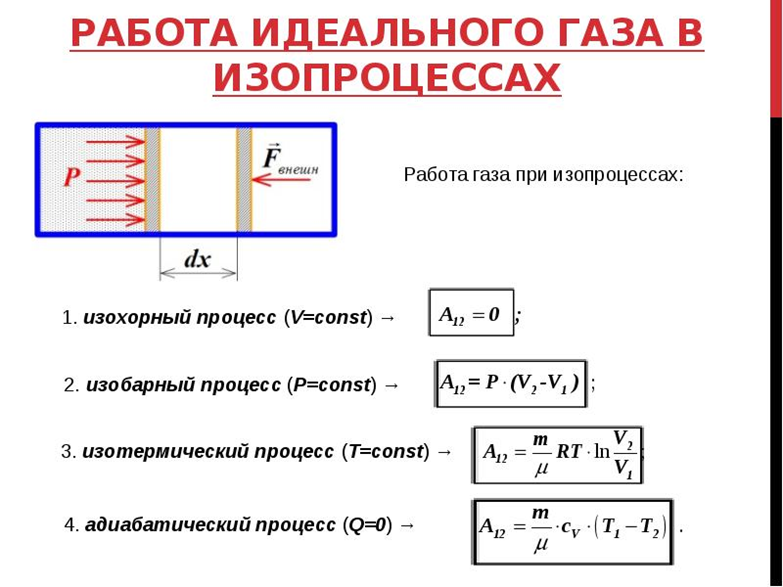
Работа, совершаемая газом. Работа в
изопроцессах.

Работа
газа при произвольном процессе
рассчитывается как площадь криволинейной
трапеции под графиком p(V). На рис. 6.1
показана произвольная зависимость
давления газа p от его объема V (объем
газа в начальном состоянии V 1; объем
газа в конечном состоянии V 2). Площадь
заштрихованной фигуры совпадает с
работой, совершенной газом.
5. Внутренняя энергия газа. Теорема о равнораспределении энергии по степеням свободы.
Внутренняя
энергия —
однозначная функция термодинамического
состояния системы, т.е. в каждом состоянии
система обладает вполне определенной
внутренней энергией (она не зависит от
того, как система пришла в данное
состояние). Это означает, что при переходе
системы из одного состояния в другое
изменение внутренней энергии определяется
только разностью значений внутренней
энергии этих состояний и не зависит от
пути перехода.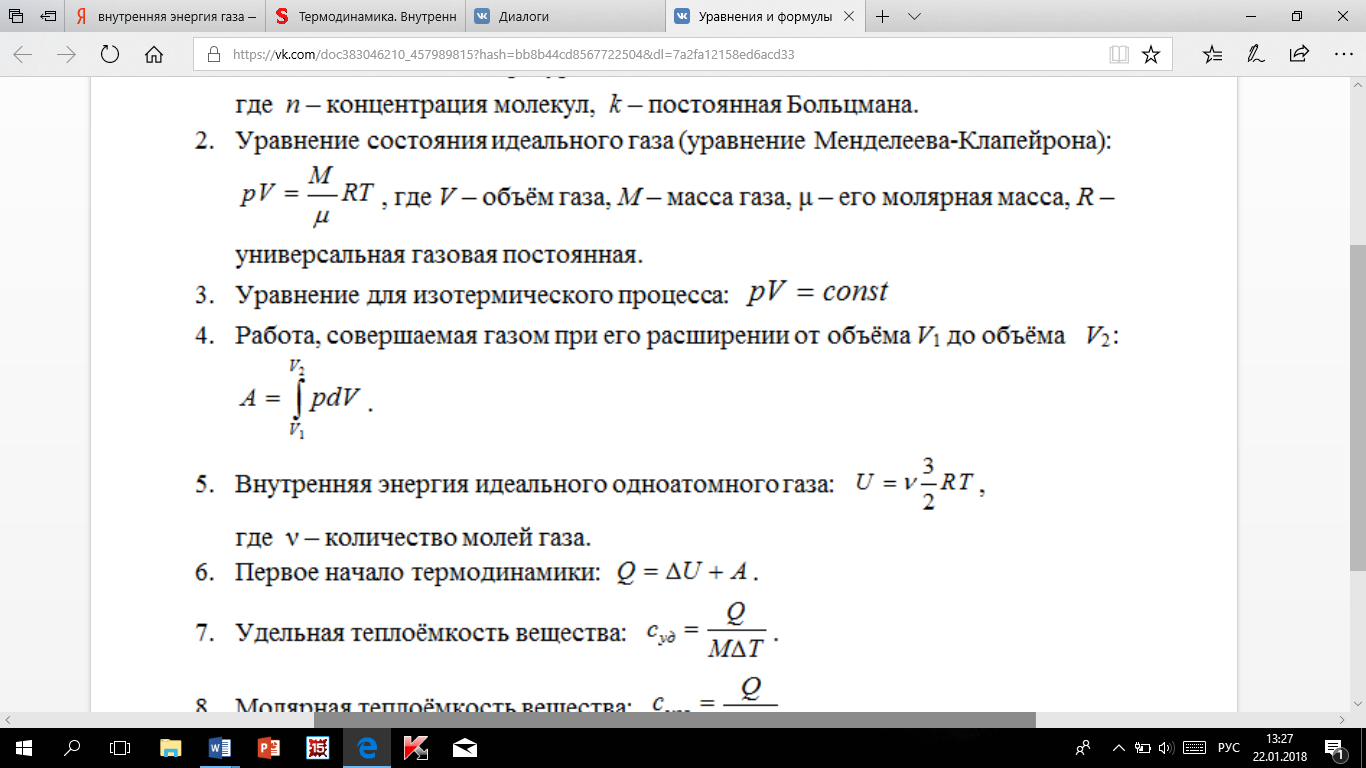
Средняя
энергия такой частицы полностью
определяется средней кинетической
энергией ее поступательного движения: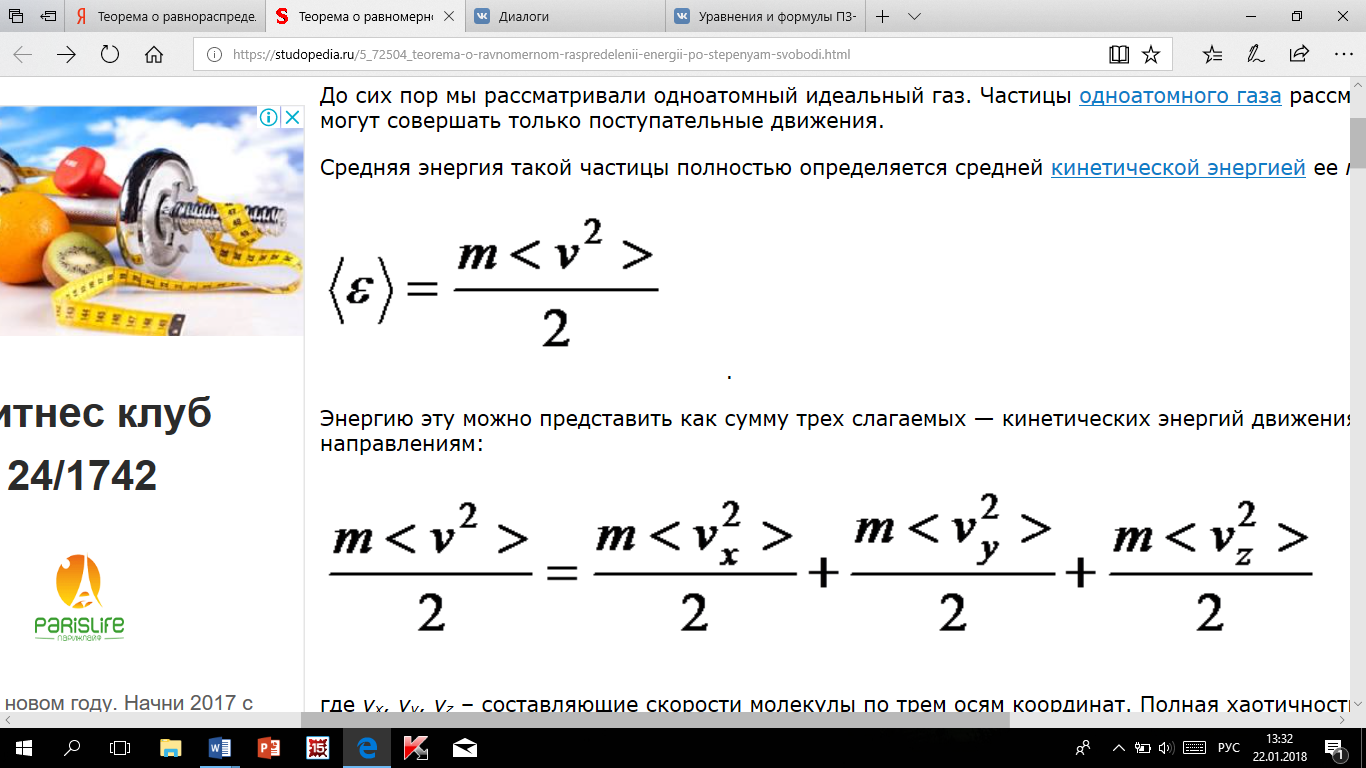
Энергию
эту можно представить как сумму трех
слагаемых — кинетических энергий
движения молекулы по трем взаимно
перпендикулярным направлениям: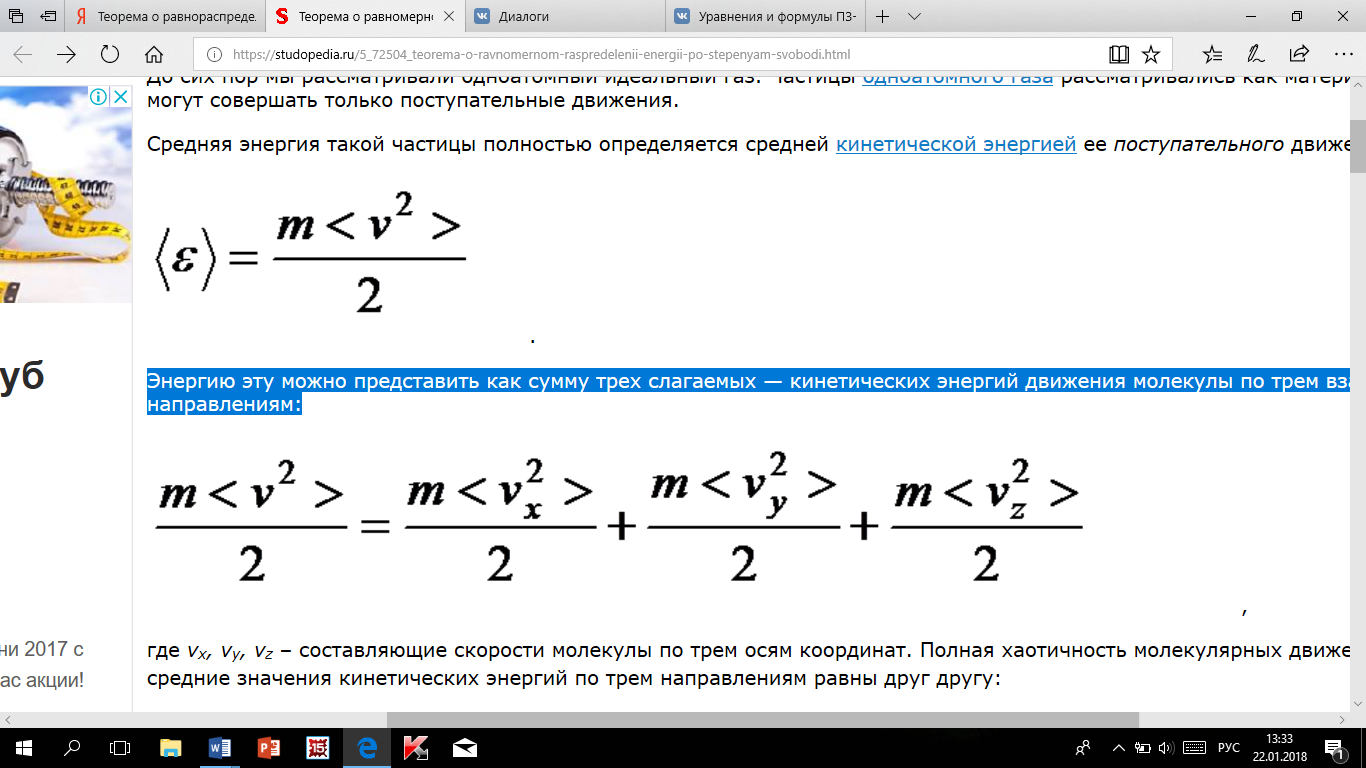
где
vx, vy, vz – составляющие скорости молекулы
по трем осям координат. Полная хаотичность
молекулярных движений позволяет считать,
что средние значения кинетических
энергий по трем направлениям равны друг
другу: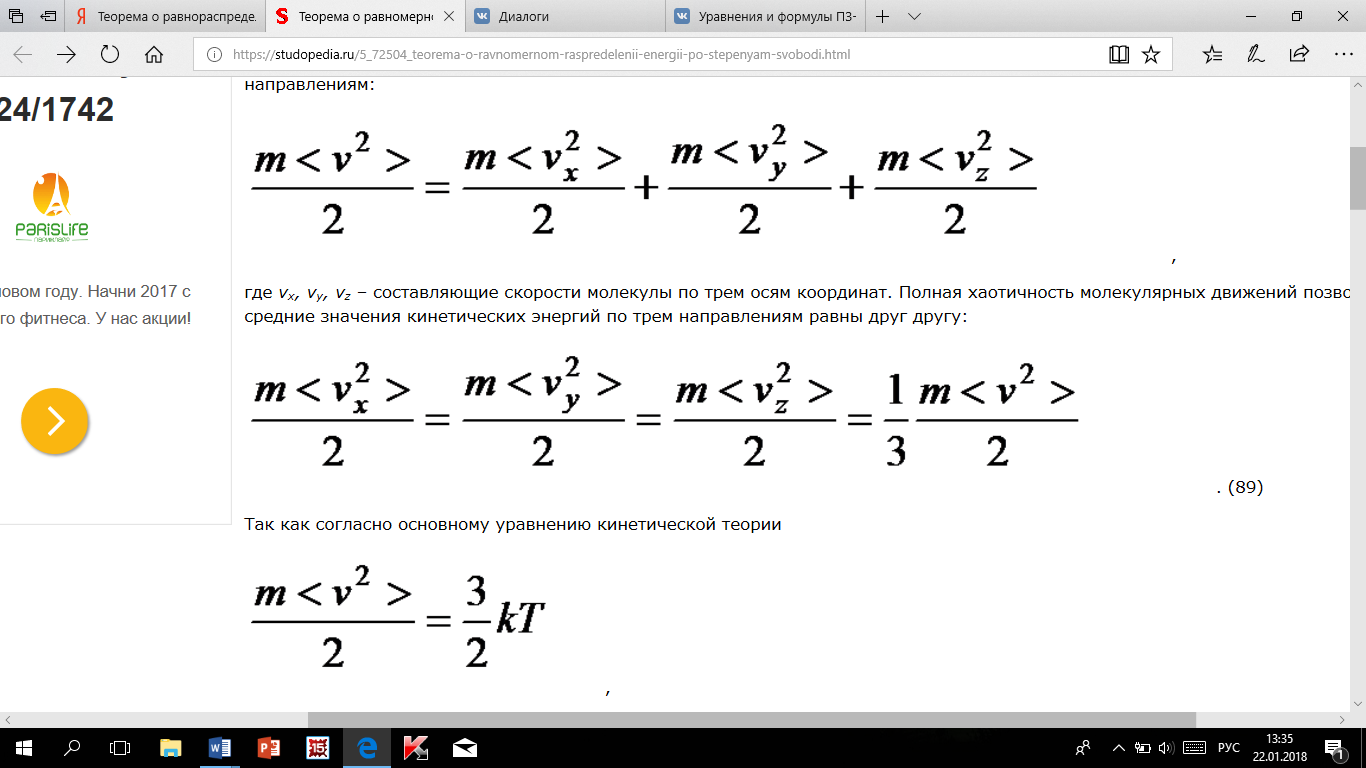
тогда
каждое из слагаемых равенства равно 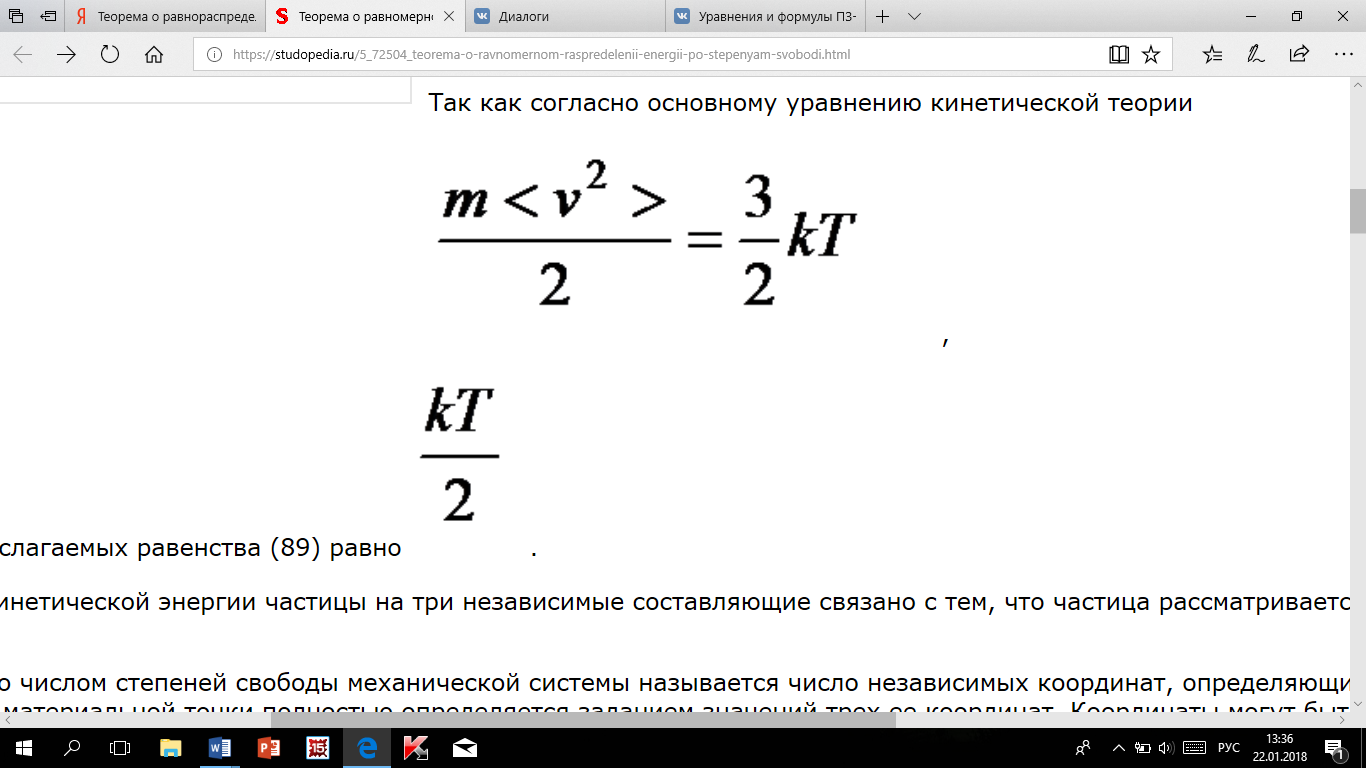
Разделение кинетической энергии частицы на три независимые составляющие связано с тем, что частица рассматривается как свободная материальная точка, обладающая тремя степенями свободы.
теорема (Больцман): если система молекул находится в тепловом равновесии при температуре Т, то средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна kT/2.
