- •Механика
- •1. Система отсчета. Радиус-вектор материальной точки. Закон движения материальной точки (мт).
- •2. Вектор перемещения (мт). Путь. Скорость. Ускорение.
- •3. Угловая скорость. Угловое ускорение.
- •4. Нормальное и тангенциальное ускорения.
- •5. Пространство и время в движущихся системах отсчета. Закон инерции Галилея. Инерциальные системы отсчета (исо). Преобразования Галилея и следствия из них.
- •Пример преобразования Галилея:
- •15. Уравнение Ньютона-Эйнштейна. 2-й закон Ньютона.
- •16. Момент силы. Момент импульса частицы. Момент инерции.
- •Электромагнетизм и электромагнитные волны
- •Фундаментальные свойства зарядов
- •2. Электрическое поле. Напряженность электрического поля. Принцип суперпозиции.
- •3. Потенциал электрического поля. Эквипотенциали. Связь потенциала и напряженности электрического поля.
- •Где символ частной производной подчеркивает, что дифференцирование производится только по х. Повторив аналогичные рассуждения для осей у и z, можем найти вектор ё:
- •4. Проводник в электрическом поле. Электростатическая индукция.
- •5. Атомы и молекулы в электрическом поле.
- •6. Поляризация диэлектриков. Вектор поляризации. Диэлектрическая проницаемость вещества. Электрическое смещение.
- •7. Сегнетоэлектрики. Пьезоэлектрический эффект. Обратный пьезоэлектрический эффект.
- •8. Электрическое поле заряженного проводника. Электроемкость проводника.
- •9. Конденсаторы. Поле внутри плоского конденсатора.
- •10. Энергия системы зарядов. Энергия электрического поля.
- •11. Классическая теория электропроводности. Закон Ома в дифференциальной (локальной) форме. Закон Ома для однородного проводника.
- •12. Закон Джоуля – Ленца в дифференциальной форме. Закон Джоуля-Ленца для однородного проводника.
- •18. Контур с током в магнитном поле.
- •19. Атомы и молекулы в магнитном поле. Парамагнетики.
- •20. Диамагнетики. Природа диамагнетизма.
- •21. Вектор намагниченности. Магнитная проницаемость вещества. Напряженность магнитного поля.
- •22. Ферромагнетики. Домены. Петля гистерезиса.
- •26. Явление самоиндукции. Индуктивность.
- •27. Энергия магнитного поля. Объемная плотность энергии.
- •28. Гипотеза Максвелла: магнитоэлектрическая индукция.
- •30. Свободные затухающие колебания. Период колебаний.
- •31. Вынужденные электрические колебания. Резонанс.
- •32. Возникновение электромагнитной волны. Волновое уравнение для электромагнитного поля. Плоская электромагнитная волна.
- •38. Методы получения когерентных источников (методы наблюдения интерференции).
- •Квантовая механика
- •1. Фотоэффект. Квантовый характер электромагнитного излучения. Формула Эйнштейна для фотоэффекта.
- •2. Фотоны. Энергия, масса и импульс фотона. Корпускулярно-волновой дуализм света.
- •3. Гипотеза де Бройля. Волна де Бройля. Экспериментальное подтверждение волновых свойств частиц.
- •А)Опыт к. Дэвиссона и л. Джермера (1927 г.)
- •B) Опыт Томсона и Тартаковского.
- •4. Особенности описания движения микрочастиц. Соотношения неопределенностей.
- •5. Уравнение Шрёдингера. Волновая функция.
- •6. Частица в одномерной бесконечно глубокой потенциальной яме.
- •7. Квантовый гармонический осциллятор. Энергия нулевых колебаний.
- •10. Уравнение Шредингера для атома водорода. Квантовые числа.
- •Основные квантовые числа
- •13. Строение многоэлектронного атома. Периодическая система элементов Менделеева.
- •Термодинамика и статистическая физика
- •1. Макросистема и методы ее описания. Контакты систем. Температура.
- •2. Тепловое равновесие. Уравнение состояния. Модель идеального газа.
- •3. Равновесные процессы. Изопроцессы.
- •6. Теплота. 1-е начало термодинамики.
- •7. Теплоемкость идеального газа. Соотношение Майера.
- •8. Зависимость теплоемкости многоатомного газа от температуры.
- •38. Лазеры. Процесс генерации.
- •39. Лазеры. Создание инверсной населенности.
- •40. Фермионы. Распределение Ферми-Дирака. Заполнение электронами разрешенных уровней в кристалле.
- •41. Энергетические уровни в атоме и энергетические зоны в кристалле.
- •42. Распределение электронов по квантовым состояниям в кристалле. Проводники и диэлектрики.
- •51. Деление ядер. Цепная реакция деления. Ядерные реакторы.
- •54. Квантовые числа элементарных частиц. Частицы и античастицы.
10. Уравнение Шредингера для атома водорода. Квантовые числа.
Уравнение Шредингера, примененное к атому водорода, позволяет получить результаты боровской теории атома водорода без привлечения постулатов Бора и условия квантования.
Согласно квантовой механике, не существует определенных круговых орбит электронов, как в теории Бора. В силу волновой природы электрон «размазан» в пространстве, подобно «облаку» отрицательного заряда.
Применим уравнение Шредингера к электрону, находящемуся в атоме водорода.
Решение
задачи об энергетических уровнях
электрона для водорода, а также
водородоподобных систем сводится к
задаче о движении электрона в кулоновском
поле ядра. Потенциальная энергия
взаимодействия электрона с ядром,
обладающим зарядом Ze (для
атома водорода Z =
1), определяется выражением 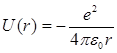 (21.20)
(21.20)
и зависит только от r – расстояния между электроном и протоном, поэтому задачу с таким видом потенциальной энергии обычно решают в сферической системе координат. В общем случае волновая функция является функцией от всех координат и уравнение Шредингера будет иметь вид:
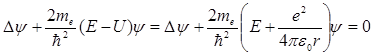 .
(21.21)
.
(21.21)
Квантовые числа – целые или дробные числа, определяющие возможные значения физических величин, характеризующих квантовую систему (молекулу, атом, атомное ядро, элементарную частицу). Квантовые числа отражают дискретность (квантованность) физических величин, характеризующих микросистему.
Основные квантовые числа

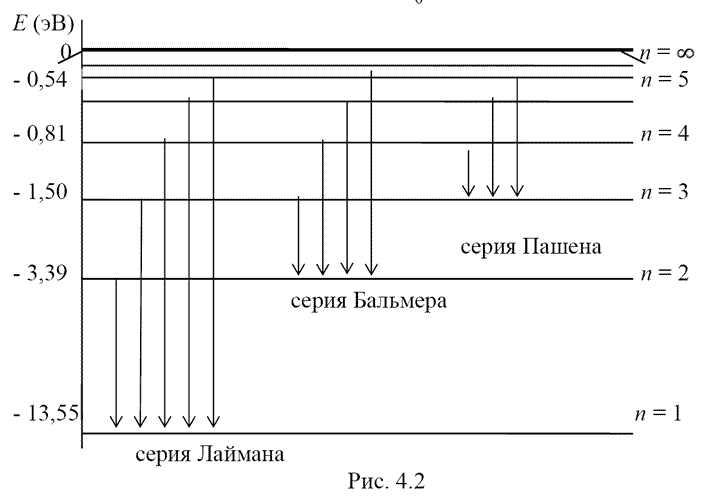
11. Диаграмма состояний электрона в атоме водорода.
Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн
12. Спин элементарных частиц и атомных ядер. Фермионы и бозоны. Принцип Паули.
Спин — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
Спин измеряется в единицах ħ] (приведённой постоянной Планка, или постоянной Дирака) и равен ħJ, где J — характерное для каждого сорта частиц целое (в том числе нулевое) или полуцелое положительное число — так называемое спиновое квантовое число, которое обычно называют просто спином (одно из квантовых чисел).

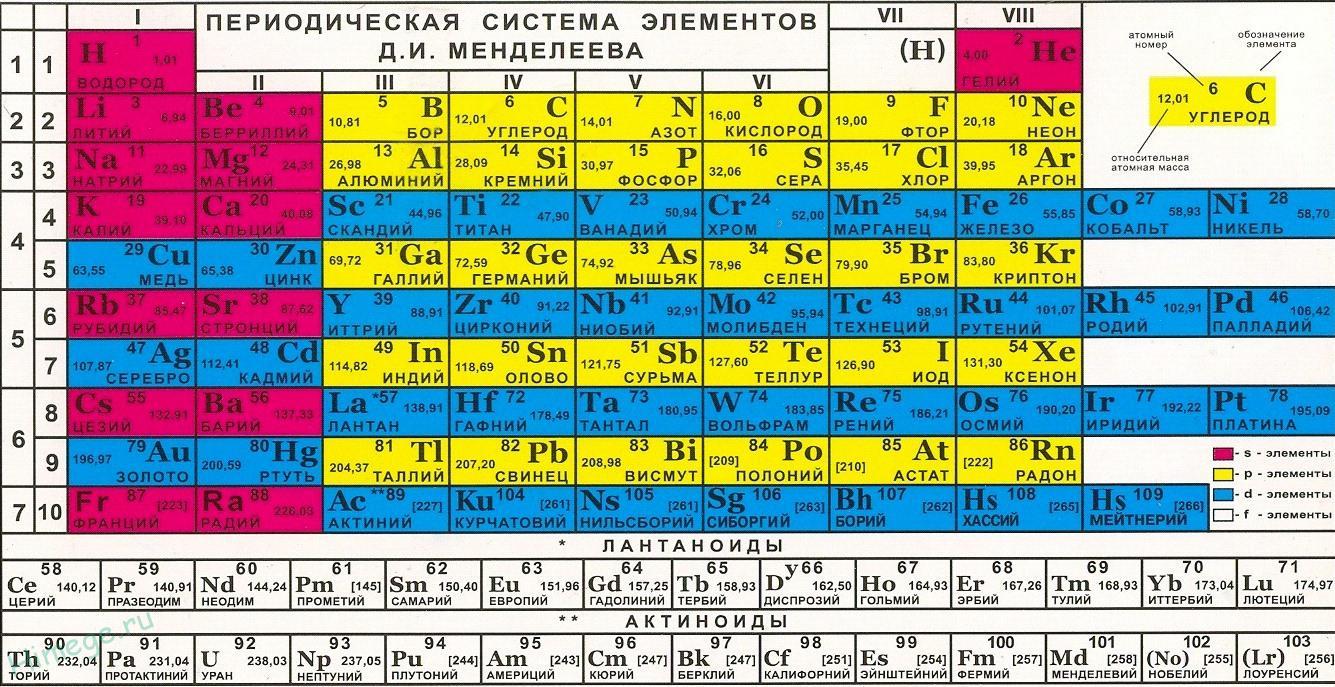
13. Строение многоэлектронного атома. Периодическая система элементов Менделеева.
Электронная конфигурация элемента. Запись распределения электронов в атоме по оболочкам, подоболочкам и орбиталям получила название электронной кофигурации элемента. Обычно электронная конфигурация приводится для основного состояния атома
При записи электронной конфигурации указывают цифрами главное квантовое число (n), буквами – подоболочки (s,p,d или f), а степень буквенных обозначений подуровней обозначает число электронов в данной подоболочке.
Например, электронная конфигурация водорода – 1s1, лития – 1s22s1, бора – 1s22s22p1, магния – 1s22s22p63s2, титана – 1s22s22p63s23p63d24s2.
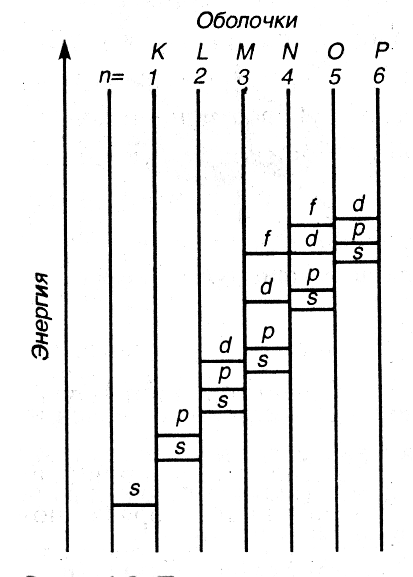
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда и Клечковского.
Принцип минимальной энергии. Согласно этому принципу электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей. Первыми заполняются орбитали с минимальными уровнями энергии.
|
Рис. 1.3. Примерная схема относительного расположения энергетических подуровней в многоэлектронных атомах |
В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание электронов, находящихся ближе к ядру и экранирующих ядро от более далеко расположенных электронов. Поэтому последовательность возрастания энергий орбиталей усложняется. Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n + l, а при равной сумме – в порядке увеличения числа n. Соответственно этому правилу подоболочки выстраиваются в следующий ряд (см. рис. 1.3):
Исключение составляют d- и f-элементы с полностью и наполовину заполненными подоболочками, у которых наблюдается так называемый провал электронов, например Cu, Ag, Cr, Mo, Pd, Pt. |
Принцип запрета Паули. В 1925 г. П. Паули постулировал принцип запрета, согласно которому в атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел n, l, ml и ms. Отсюда следует, что на каждой атомной орбитали может быть не более двух электронов, причем они должны иметь противоположные (антипараллельные) спины, т.е. допускается заполнение ↑↓ и не допускается заполнение ↓↓ и ↑↑.
Правило Гунда. В соответствии с этим правилом заполнение орбиталей одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. После того как одиночные электроны займут все орбитали в данной подоболочке, заполняются орбитали вторыми электронами с противоположными спинами. Например, у атома азота орбитали в основном состоянии заполняют р-подоболочку 2р3 по одному электрону
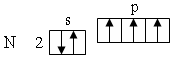
Возбужденное состояние атома. Электронная пара, образующая связь, может образоваться за счет неспаренных электронов, имеющихся в невозбужденных атомах.
Однако число ковалентных связей может быть больше числа неспаренных электронов. Например, в невозбужденном состоянии (которое называется также основным состоянием) атом углерода имеет два неспаренных электрона, однако для него характерны соединения, в которых он образует четыре ковалентные связи. Это оказывается возможным в результате возбуждения атома. При этом один из s-электронов переходит на p-подуровень:

Увеличение числа создаваемых ковалентных связей сопровождается выделением большего количества энергии, чем затрачивается на возбуждение атома. Поскольку валентность атома зависит от числа неспаренных электронов, возбуждение приводит к повышению валентности. У атомов азота, кислорода, фтора количество неспаренных электронов не увеличивается, т.к. в пределах второго уровня нет свободных орбиталей, а перемещение электронов на третий квантовый уровень требует значительно большей энергии, чем та, которая выделилась бы при образовании дополнительных связей. Таким образом, при возбуждении атома переходы электронов на свободные орбитали возможны только в пределах одного энергетического уровня.
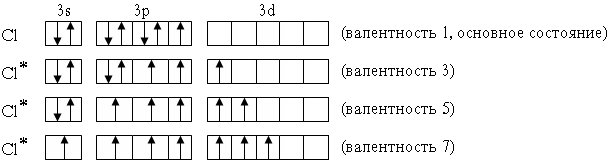
Элементы 3-го периода – фосфор, сера, хлор – могут проявлять валентность, равную номеру группы. Это достигается возбуждением атомов с переходом 3s- и 3p-электронов на вакантные орбитали 3d-подуровня:
P* 1s22s22p63s13p33d1 (валентность 5)
S* 1s22s22p63s13p33d2 (валентность 6)
Cl* 1s22s22p63s13p33d3 (валентность 7)
В приведенных выше электронных формулах возбужденных атомов подчеркнуты подуровни, содержащие только неспаренные электроны. На примере атома хлора легко показать, что валентность может быть переменной:
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869—1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы).(см. лекцию 13.6)