
Журнал неврологии и психиатрии / 2010 / NEV_2010_01_042
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Эффект включения стабилотренинга в реабилитацию больных с посттравматическим корсаковским синдромом
Л.А. ЖАВОРОНКОВА1, О.А. МАКСАКОВА2, А.В. ЖАРИКОВА3, И.С. ФЛЕРОВ2, Г.А. ЩЕКУТЬЕВ2, В.Л. НАЙДИН2
The use of stabilo-training with feedback in the rehabilitation of patients with posttraumatic Korsakov’s syndrome
L.A. ZHAVORONKOVA, O.A. MAKSAKOVA, A.V. ZHARIKOVA, I.S. FLEROV, G.A. SHCHEKUT’EV, V.L. NAIDIN
1Институт высшей нервной деятельности и нейрофизиологии РАН; 2Институт нейрохирургии им. акад. Н.Н. Бурденко РАМН, Москва;
3Московский государственный университет им. М.В. Ломоносова
У 10 больных с посттравматическим корсаковским синдромом (КС) проведено комплексное исследование, включающее клинические шкалы (EIM, Mayo-Portland), результаты стабилографического и электроэнцефалографического (ЭЭГ) исследования до и после курса реабилитации с использованием стабилотренинга (СТ) с обратной связью (7—12 сеансов). В качестве контроля использовали данные 18 здоровых испытуемых. У больных с КС до курса СТ максимальные нарушения наблюдались в когнитивной (мнестической) сфере, чему по данным ЭЭГ соответствовало максимальное снижение когерентности всех диапазонов ритмов в лобных и в теменно-затылочных отделах, а также для длинных диагональных пар — между левой лобной и правой теменно-затылочной областями, наиболее отчетливое для α-диапазона. После курса реабилитации со СТ, сопровождающегося регрессом КС, наблюдалась тенденция к нормализации стабилографических параметров и поэтапное увеличение показателей когерентности ЭЭГ, особенно α-диапазона: первоначально в затылочно-теменно-центральных отделах правого полушария, с последующим нарастанием в его центрально-лобных областях, и затем — в лобных отделах, больше левого полушария, что соответствовало тенденции к нормализации пространственно-временной организации ЭЭГ.
Ключевые слова: черепно-мозговая травма, корсаковский синдром, реабилитация, стабилография, стабилотренинг,
электроэнцефалография.
The complex research, including clinical scales (FIM, Mayo-Portland) and data on stabilography and electroencephalography (EEG) studies, was conducted in 10 patients with posttraumatic Korsakov’s syndrome (KS) before and after the rehabilitation course using stabilo-training (ST) with feedback (7—12 sessions). A control group consisted of 18 healthy people. In patients with KS, more severe cognitive (memory) disorders were noted before ST that was correlated with the maximal reduction of coherence in all frequency bands in frontal and parietal-occipital areas as well as in the long diagonal pairs between the left frontal and the right parietal-occipital areas which was most distinct for the α-band. A trend to the normalization of stabilography parameters and step-by step increasing of EEG coherence parameters, especially the α-band, was found after the rehabilitation ST course, which was accompanied with the KS regress. It increased initially in parietal-occipital-central areas of the right hemisphere with the following increase in central-frontal areas and then in frontal areas, mostly in the left hemisphere, that was in compliance with the tendency to the normalization of spatial-temporary EEG organization.
Key words: brain injury, Korsakov’s syndrome, rehabilitation, stabilography, stabilotherapy, electroencephalography.
Посттравматический корсаковский сидром (КС), развивающийся у перенесших глубокие нарушения сознания после тяжелой черепно-мозговой травмы (ТЧМТ) больных, — расстройства психической деятельности в виде антеро- и ретроградной амнезии, дезориентировки в пространстве и времени, эмоционально-личностных и др. изменений. Использование традиционной фармакотерапии эффективно на самых ранних этапах реабилитационного процесса и недостаточно для наиболее полного восстановления нарушенных функций [11]. Таким больным необходимы специальные реабилитационные подходы, среди которых методы включения резервных возможно-
стей мозга и организма в целом являются важными и перспективными. К ним относятся предложенные А.Р. Лурия и его учениками нейропсихологические приемы, опирающиеся на сохранившиеся при реабилитации больных с нарушением высших психических функций, в том числе памяти, навыки [13].
Известно, что нарушения мнестических и двигательных функций тесно взаимосвязаны и их дефицит проявляется одновременно при разных формах патологии мозга [20, 31, 32]. Отмечено, что у пожилых людей нарушения памяти и другие формы когнитивного дефицита сопровождаются двигательными нарушениями [14, 23]. С другой
© Коллектив авторов, 2010 |
e-mail: lzhavoronkova@hotmail.com |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:1:42
42 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

СТАБИЛОТРЕНИНГ ПРИ ЧМТ
стороны, исследования последних лет показали, что включение стабилотренинга (СТ) с обратной связью в реабилитационную программу перенесших ТЧМТ больных явилось эффективным инструментальным подходом для восстановления не только двигательных, но и других сфер деятельности [8, 14, 16, 18—20, 25, 37]. Нам представлялось перспективным использовать СТ с обратной связью как специальный реабилитационный подход для восстановления не только двигательных, но и мнестических функций, дефицит которых является ведущим при посттравматическом КС. В основе такого подхода была рабочая гипотеза о том, что моторная память является самым древним видом памяти и именно поэтому двигательное обучение может стать фундаментом и пусковым механизмом для восстановления более сложных видов памяти. Доказательство этой гипотезы требует анализа особенностей восстановления больных с посттравматическим КС при включении СТ с обратной связью в их реабилитационную программу. Ранее нами была использована комплексная оценка статуса пациентов с последствиями ТЧМТ, включающая клинические количественные шкалы, стабилографические и ЭЭГ-показатели, выявившая высокую информативность в отслеживании эффекта реабилитации [8, 10, 37].
Из показателей ЭЭГ параметры когерентности продемонстрировали наиболее высокую информативность для оценки динамики функционального состояния мозга нейрохирургических больных, в том числе с посттравматическим КС [1, 2, 4, 5, 15, 21, 22]. Особенности нарушения пространственно-временной организации ЭЭГ у больных с посттравматическим КС выявили максимальное снижение когерентности в лобных областях мозга, а также специфические черты изменения когерентности ЭЭГ при обратимом и хроническом течении посттравматического КС [4, 5, 15, 22, 33]. Установлена наибольшая значимость дисфункции гиппокампа и правого полушария в возникновении и регрессе КС [22, 33]. В то же время следует отметить, что имеющиеся в литературе сведения об особенностях нарушения организации ЭЭГ при посттравматическом КС в основном описаны для больных, у которых психические расстройства сочетались с грубой неврологической симптоматикой, что могло маскировать ЭЭГ-маркеры собственно мнестических нарушений. В связи с этим представлялось важным подобрать группу пациентов, у которых в клинической картине ведущим был посттравматический КС и которые были способны поддерживать вертикальную позу и участвовать в реабилитации с использованием СТ.
Целью настоящего исследования являлось определение эффективности восстановления моторных и когнитивных функций при включении СТ с обратной связью в курс реабилитации больных с посттравматическим КС.
Материал и методы
В исследование участвовали 10 больных (6 мужчин и 4 женщины) с последствиями ТЧМТ, у которых был диагностирован КС, в возрасте от 26 до 30 лет (в среднем 26,14±3,18 года) были 8 из них, старше 50 лет — 2. Локализацию поражения головного мозга верифицировали с помощью КТ и МРТ. Длительность утраты сознания колебалась от 2 до 40 сут при глубине комы от 5 до 8 баллов по шкале Глазго. Курс СТ начинался через 1—3 мес после ТЧМТ, состоял из
7—12 занятий и проводился в течение 3—4 нед. У всех пациентов комплексное ЭЭГ, стабилографическое и клиническое исследование проводилось до, несколько раз в течение и после курса СТ. Данные 18 здоровых испытуемых (средний возраст 24±3,5 года) были использованы в качестве контроля для стабилографического исследования, 10 из них прошли также ЭЭГ-исследование.
Для оценки особенностей поддержания вертикальной позы, а также проведения СТ использовался аппаратнопрограммный комплекс МБН-Биомеханика (МБН, Россия), включающий специальную динамометрическую платформу и компьютерный комплекс. СТ состоял из ряда статических и динамических двигательных задач разной степени сложности в деталях описанных ранее [8]. Он начинался и заканчивался тестом Ромберга — поддержание равновесия с открытыми и закрытыми глазами. Из комплекса стабилографических параметров, полученных в тесте Ромберга, анализировались длина колебаний общего центра давления (ОЦД) — L, площадь — S и скорость — V колебаний ОЦД. Задания — «Столбики одинаковые», «Столбики разные» и «Стрелок» предъявлялись на экране монитора; пациенты и испытуемые должны были, перемещая центр тяжести тела в разных направлениях, управлять изображением на экране. Эффект СТ определяли по комплексу стабилографических параметров и по качеству выполнения заданий (в % успеха), вычисляемого с помощью специального программного обеспечения.
Интегральная количественная оценка клинического статуса больных осуществлялась с помощью международных шкал: FIM — мера функциональной независимости (от 0 до 126 баллов), а также Mayo-Portland Adaptability Inventory 3 (MPAI), в рамках которой осуществлялся дифференцированный анализ дефицита двигательных, когнитивных (в том числе мнестических) функций, а также эмоционального статуса (максимальный дефект — 4 балла, норма — 0) [29].
Регистрация ЭЭГ («Nihon Kohden», Япония) осуществлялась от 18 электродов, расположенных по международной системе «10—20» в состоянии покоя. Каждая запись ЭЭГ длилась не менее 60 с с частотой опроса 100 Гц. Свободные от артефактов отрезки монополярной записи ЭЭГ с ушными электродами в качестве индифферентных, использовали для дальнейшего анализа. Спектры мощности и когерентности вычисляли для 5 с эпох (не менее 10) по 4 диапазонам ритмов с шагом 0,4 Гц (Δ — 0,5—3,5 Гц, θ — 3,9—7,8 Гц, α — 8,2—12,9 Гц, β — 13,3—19,9 Гц).
Для статистической оценки стабилографических и клинических данных использовали непараметрические методы пакета Statistika 6.1. Результаты представлены в виде медианы, нижнего и верхнего квартилей. Критерии Манна—Уитни использовали для сравнения независимых групп — здоровых испытуемых и пациентов, а критерий Уилкоксона — связанных выборок (пациентов до и после СТ). Для статистической обработки данных ЭЭГ использовали авторскую программу [4], позволяющую определить достоверность различий (по критерию Манна— Уитни) комплекса параметров когерентности ЭЭГ методом парных сравнений.
Результаты и обсуждение
На начальных этапах СТ больные испытывали затруднения в понимании сути заданий, поэтому в течение пер-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
43 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 1. Оценка стабилографических параметров в тесте Ромберга при открытых (ОГ) и закрытых глазах (ЗГ)
Параметр |
|
Пациенты с КС |
|
Здоровые испытуемые |
|
|
До СТ |
После СТ |
|
||
|
|
|
|
||
L — ОГ, мм |
1135,50 [1108,18; 1810,61] |
738,97 [544,73; 912,28] |
431,48 [318,33; 647,35] |
||
S — ОГ, мм2 |
1557,12 [896,69; 2038,83] |
428,13 [327,680; 1904,30] |
276,76 [217,13; 309,03] |
||
V — ОГ, мм/сек |
27,42 [16,80; 59,57] |
13,77 [10,68; 18,82] |
7,94 [6,55; 10,79] |
||
L — ЗГ, мм |
1832,49 [1184,54; 2136,67] |
1268,845 [709,40; 1495,78] |
666,64 [421,77; 752,82] |
||
S — ЗГ, мм2 |
2367,17 [854,43; 4401,55] |
1101,12 [404,13; 1678,42] |
187,84 [151,49; 191,31] |
||
V — ЗГ, мм/сек |
33,38 [19,75; 46,73] |
22,60 [10,86; 30,75] |
11,12 [7,54; 12,55] |
||
Таблица 2. Успешность выполнения заданий СТ (в %) |
|
|
|
||
|
|
|
|
|
|
Задание |
|
Пациенты с КС |
|
Здоровые испытуемые |
|
|
в начале СТ |
в конце СТ |
|
||
|
|
|
|
||
«Столбики одинаковые» |
54,56 [46,72; 72,28] |
75,40 [67,94; 81,44] |
81,84 [78,60; 86,04] |
||
«Столбики разные» |
36,88 [32,12; 55,60] |
53,40 [45,84; 59,34] |
61,28 [56,68; 62,08] |
||
«Стрелок» |
6,92 [2,32; 10,96] |
29,80 [22,08; 32,92] |
39,29 [25,76; 49,80] |
||
Таблица 3. Количественная оценка (интегральная и дифференцированная) клинического статуса пациентов с КС по шкалам FIM и MPAI
Шкала |
|
До СТ |
После СТ |
|
FIM |
66,5 |
[62,5; 73,5] |
86,5 |
[79,0; 95,5] |
MPAI |
2,99 |
[2,99; 3,22] |
2,17 [1,75; 2,32] |
|
MPAI когнитивный статус |
3,8 |
[2,95; 4,0] |
2,8 [2,2; 3,0] |
|
MPAI эмоциональный статус |
1,8 [1,3; 2,0] |
1,3 [0,6; 1,3] |
||
MPAI моторный статус |
3,0 |
[2,75; 3,1] |
2,1 |
[1,75; 2,2] |
вых 2—3 сеансов врач-реабилитолог перед началом выполнения каждого задания объяснял пациенту их содержание. После 4—6 сеансов занятия начинали проводить без предварительной инструкции. Хотя на вопрос о содержании задач пациент отвечал, что ничего не помнит, он начинал правильно выполнять задание, увидев его на экране. На следующем этапе СТ перед началом сеанса пациента просили рассказать о содержании каждого задания. Особо следует отметить, что 30% больных с КС во время первых сеансов СТ были не способны понимать и выполнять задание, требующее перемещение тела в трехмерном пространстве при предъявлении задачи в двухмерном пространстве на экране монитора («Стрелок»). Согласно нашему предыдущему опыту таких затруднений не возникало у больных с последствиями ТЧМТ, но без КС [7, 8, 10]. Только после нескольких сеансов СТ это задание были способны выполнять все пациенты. Важно также отметить, что для повышения мотивации выполнения заданий пациентам во время каждого сеанса СТ сообщались результаты успешности их выполнения и постепенно они начинали интересоваться результатами и старались добиться лучших.
Сравнение комплекса стабилографических параметров показало, что у больных с КС до курса CТ все показатели — L, S и V колебаний ОЦД были значительно выше, чем у здоровых испытуемых, что отражало неустойчивость поддержания равновесия пациентов (табл. 1). После курса СТ значения всех анализируемых параметров снижались, демонстрируя положительную динамику. Статистически значимые различия, наблюдаемые у пациентов после СТ, были получены для L (p=0,01 при открытых глазах, p=0,02 при закрытых) и V (p=0,01 при открытых глазах, p=0,02
при закрытых), что свидетельствовало об уменьшении энергетических затрат, необходимых для поддержания равновесия после курса СТ.
Анализ качества выполнения различных заданий пациентами до и после СТ в сопоставлении со здоровыми представлен в табл. 2. На начальном этапе СТ все задания выполнялись пациентами значительно хуже, чем здоровыми. К окончанию курса СТ наблюдалась отчетливая положительная динамика при выполнении всех заданий. Особое внимание обращает на себя то, что качество задания «Стрелок» (самое сложное как по моторной, так и по когнитивной составляющей) после курса СТ улучшалось максимально и приближалось к нормативным значениям.
Результаты интегральной оценки клинического статуса по шкалам MPAI и FIM, а также дифференцированной — по шкале MPAI представлены в табл. 3. Видно, что до курса СТ у больных с КС максимальная степень нарушений проявлялась для когнитивных функций, в меньшей степени для моторных функций и эмоционального статуса. После курса СТ был выявлен регресс всех видов нарушений с максимальным улучшением когнитивных, в том числе мнестических функций.
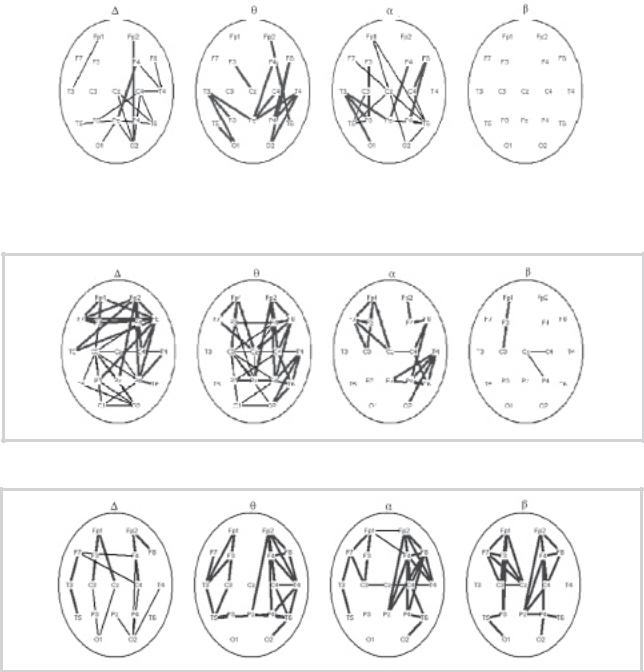
Сопоставление параметров когерентности ЭЭГ до курса СТ у больных с КС по сравнению со здоровыми испытуемыми выявило максимальное их снижение в лобных отделах полушарий (максимальное для межполушарных отведений) для всех диапазонов ритмов, особенно α-диапазона. Сходное снижение когерентности было выявлено в затылочно-теменных отделах полушарий с некоторым преобладанием в правом. Особо следует отметить достоверное (p<0,01) снижение когерентности α-диапазо- на для длинных диагональных пар — между левой лобной
44 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
|
СТАБИЛОТРЕНИНГ ПРИ ЧМТ |
и затылочно-теменными отделами правого полушария. |
справа. К окончанию курса СТ нарастание когерентности |
Наряду с этим для отдельных внутриполушарных отведе- |
выявлено в лобных отделах, больше левого полушария |
ний значения когерентности ЭЭГ были выше норматив- |
(рис. 2). |
ных значений (рис. 1). |
Сопоставление параметров когерентности ЭЭГ у па- |
В процессе курса СТ была выявлена определенная |
циентов после курса СТ по сравнению со здоровыми сви- |
поэтапность изменения пространственно-временной ор- |
детельствовало о том, что максимальное увеличение вну- |
ганизации ЭЭГ. На начальных этапах СТ (после 3—4-х за- |
триполушарных когерентностей происходило в правом |
нятий) максимальное увеличение когерентности, в основ- |
полушарии, где их значения становились более высоки- |
ном α-диапазона, наблюдалось в затылочно-теменно- |
ми, чем в норме, в то время как межполушарные коге- |
центральных областях преимущественно правого полу- |
рентности сохраняли сниженные значения (рис. 3). Уве- |
шария. Следующим этапом (после 6—7 занятий) было |
личение когерентности α-диапазона для длинных диаго- |
нарастание когерентностей в лобно-центральных отделах |
нальных пар было менее значительным. Однако к оконча- |
|
|
|
|
Рис. 1. Регионарные особенности достоверных изменений когерентности выделенных диапазонов ритмов ЭЭГ в группе больных с КС до курса СТ по сравнению с группой здоровых испытуемых.
Здесь и на рис. 2 и 3: жирной линией обозначено увеличение когерентности (р<0,01), тонкой — ее снижение (р<0,01).
Рис. 2. Особенности достоверных изменений когерентности выделенных диапазонов ритмов ЭЭГ в группе больных с КС после курса СТ по сравнению с его началом.
Рис. 3. Регионарные особенности достоверных изменений когерентности выделенных диапазонов ритмов ЭЭГ в группе больных с КС после курса СТ по сравнению с группой здоровых испытуемых.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
45 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
нию курса СТ их показатели достоверно не отличались от нормы, как это наблюдалось до СТ. Значения когерентности ЭЭГ, демонстрирующие тенденцию к нормализации после курса СТ, в целом сохраняли отличия от нормативных значений, чему соответствовало сохранение отдельных дефектов и неполная социальная адаптация больных после курса СТ.
Результаты данного исследования выявили эффективность включения СТ с обратной связью в реабилитационную программу больных с посттравматическим КС в качестве нового инструментального подхода, способствуя восстановлению как моторных, так и когнитивных функций. Выявлена также информативность комплексной оценки статуса пациентов, включающей количественные клинические шкалы, данные стабилографического и ЭЭГ-исследования для определения эффекта включения СТ в курс реабилитации больных при данной форме церебральной патологии. Было показано, что СТ, направленный на восстановление моторного мастерства и моторной памяти, способствует также регрессу когнитивного дефицита и нарушений памяти у больных с посттравматическим КС.
Важно отметить, что во время СТ с обратной связью активизируются не только проприоцептивная и вестибулярная системы, но также зрительная, сенсомоторная и слуховая, т.е. осуществляется мультиафферентная интеграция, что способствует восстановлению высших психических и других функций [10, 18—20]. Необходимо также учитывать важную роль эмоционального фактора, активно используемого во время сеансов СТ, что способствует повышению мотивации и дополнительно ускоряет процесс реабилитации. Важность сочетания моторного обучения и эмоционально-мотивационного фактора ранее была выявлена с помощью функциональной МРТ, показавшей морфофункциональную общность структур, обеспечивающих эмоции и двигательные функции [24]. Можно полагать, что включение СТ с обратной связью перспективно для реабилитации больных как с посттравматическим КС, так и другими сложными формами церебральной патологии, включающими, помимо моторных, нарушения высших психических функций.
Анализ ЭЭГ-исследований выявил некоторые новые аспекты нарушения пространственно-временной организации ЭЭГ у больных с посттравматическим КС. Максимальное снижение когерентности ЭЭГ ранее было выявлено в лобных отделах, что согласуется с результатами данного исследования [4, 5, 15, 22, 33]. Эти данные ЭЭГ и результаты МРТ-исследований могут отражать так называемую гипофронтальность, характерную как для КС, так и других форм психической патологии [5, 27, 30, 34, 35]. В наших исследованиях было выявлено также ослабление функциональных связей в затылочно-теменных отделах преимущественно правого полушария. Такая регионарная специфика нарушения пространственно-временной организации ЭЭГ может быть связана со специфическими для КС нарушениями восприятия пространства и неспособности выполнять задания с пространственным компонентом.
Особый интерес представляют данные о снижении когерентности ЭЭГ для длинных диагональных пар — между левой лобной и правой теменно-затылочной областями у больных с посттравматическим КС. У здоровых испытуемых активация именно этих связей, так называя
«когнитивная ось» (по Н.Е. Свидерской) была описана как определяющая для успешной творческой деятельности [7, 17]. Выявленный паттерн нарушения простран- ственно-временной реорганизации ЭЭГ у больных с посттравматическим КС может отражать, с одной стороны, нарушение первичной обработки зрительной информации в задних ассоциативных областях, с другой — дальнейшую ее обработку в передних ассоциативных отделах, приводя к неспособности адекватно оценивать пространство, переключать внимание с одного вида деятельности на другой, размещать события и действия на временной шкале.
В предыдущих работах, направленных на выявление ЭЭГ-маркеров посттравматического КС, ведущая роль придавалась нарушению корково-подкоркового взаимодействия за счет диcфункции гиппокампа, диэнцефальных и других структур [4, 5, 15, 22, 33], что подтверждается данными морфофункциональных исследований [30, 35], в которых обнаружена атрофия хвостатого ядра правого полушария, мозжечка, а также диэнцефальных и лимбических структур. Наиболее отчетливо это проявляется при алкогольном, а также хроническом посттравматическом КС, особенно на раннем этапе его регресса [22, 30, 35].
Выявленные в данном исследовании максимальные нарушения когерентности α-диапазона у больных посттравматическим КС с учетом сведений о генезе ритмических составляющих ЭЭГ позволяют предполагать важную роль нарушения интракортикального взаимодействия [5, 22, 28, 30]. В поддержку этого положения свидетельствуют данные МРТ-исследований, выявивших кортикальную атрофию, особенно фронтальных отделов полушарий и левой височной области, в сочетании с атрофией белого вещества мозга у больных с посттравматическим КС [30].
При регрессе посттравматического КС была выявлена ведущая роль правого полушария [4, 5, 22, 33], что подтверждается результатами и настоящего исследования. В то же время следует отметить, что важная роль правого полушария в восстановительных процессах больных с последствиями ТЧМТ, с учетом его тесных функциональных связей с жизненно важными диэнцефальными структурами, не является специфической только для КС [3, 6, 9, 21]. Традиционно используемые подходы при реабилитации больных, в том числе после ТЧМТ, очень часто опираются на процедуры, способствующие преимущественной активации правого полушария: эмоционально значимые стимулы, музыкальная терапия, ароматерапия и др. [9, 21].
Представленные в настоящем исследовании данные ЭЭГ отражают специфические особенности динамики восстановительного процесса при включении СТ с обратной связью в реабилитацию больных с посттравматическим КС и демонстрируют поэтапную последовательность активации сначала определенных отделов правого, а затем левого полушария. Важно отметить, что на начальном этапе СТ выявлено увеличение когерентности ЭЭГ в затылочно-теменно-центральных отделах преимущественно правого полушария, что может отражать запускающую роль моторного обучения в сочетании с восстановлением зрительно-пространственного анализа в регрессе посттравматического КС. Ведущая роль этих отделов мозгаворганизациидвигательныхфункцийипростраственнообразного восприятия описана как в клинических, так и экспериментальных работах [12, 20, 26]. На следующих
46 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

СТАБИЛОТРЕНИНГ ПРИ ЧМТ
этапах восстановленного процесса выявлено усиление связей в центрально-лобных отделах правого полушария, что может отражать активацию зон коры и подкорковых структур, обеспечивающих эмоционально-мотивацион- ные процессы. Эти данные совпадают с результатами экспериментальных исследований, направленных на изучение нейрофизиологических механизмов эмоций [36]. На завершающем этапе СТ наблюдалось увеличение когерентности ЭЭГ в лобных отделах, больше левого полушария, а также длинных диагональных связей, что может быть отражением активации фронтальных отделов, а также восстановлением связей между передними и задними ассоциативными областями мозга, играющих важную роль в обеспечении восстановления высших психических функций.
В то же время следует отметить, что включение СТ в курс реабилитации не приводит к полному восстановлению пространственно-временной организации ЭЭГ у больных с посттравматическим КС, что находит отражение в сохранении дефектов в различных сферах деятельности пациентов и неполной их социальной адаптации на данном этапе реабилитации. Результаты данного исследования позволяют полагать, что предложенный реабилитационный подход может быть использован как запускающий механизм для восстановления нарушенных моторных и высших психических функций. В то же время продолжение традиционных реабилитационных мероприя-
тий с учетом индивидуальных показаний для каждого больного крайне необходимо при данной форме церебральной патологии и в конечном счете может способствовать наиболее полному восстановлению физического и психического здоровья пациентов с посттравматическим КС, их социальной адаптации и возвращению к привычной деятельности.
Заключение
Включение СТ с обратной связью в реабилитационную программу больных с посттравматическим КС является эффективным инструментальным подходом на начальном этапе реабилитации. Использование комплексной оценки, включающей клинические шкалы, данные стабилографического и ЭЭГ-исследования позволяют количественно оценить динамику реабилитационного процесса у больных с посттравматическим КС. Выявлена запускающая роль моторного обучения в сочетании с мультиафферентной стимуляцией при включении СТ с обратной связью в реабилитационную программу больных с посттравматическим КС, а также регионарная специфика изменения параметров когерентности ЭЭГ, которая может отражать последовательную активацию определенных структур мозга на каждом из этапов восстановительного процесса.
Работа поддержана грантом РГНФ проект №07-06-00179а
ЛИТЕРАТУРА
1.Болдырева Г.Н. Электрическая активность мозга человека при пора14. Лучихин Л.А., Патрин А.Ф. Состояния функции равновесия у людей
жении диэнцефальных и лимбических структур. М: Наука 2000; 182.
2.Болдырева Г.Н., Жаворонкова Л.А., Шарова Е.В., Добронравова И.С.
Межцентральные отношения ЭЭГ как отражение системной организации мозга человека в норме и патологии. Журн высш нервн деят 2003; 33: 4: 391—401.
различного возраста по данным стабилографии. Журн вестн оториноларингол 1983; 5: 29—34.
15.Образцова Е.Р., Шарова Е.В., Зайцев О.С. и др. Особенности биоэлектрической активности мозга человека при посттравматическом Корсаковском синдроме. Журн неврол и психиат 2003; 8: 59—65.
3.Голдберг Э. Управляющий мозг. Лобные доли, лидерство и цивилиза16. Петрухова И.С., Лузинович В.М., Сологубова Е.Г. Регуляция позы и
|
ция. М: Смысл 2003; 235. |
|
ходьбы при детском церебральном параличе и некоторые способы |
4. |
Гриндель О.М., Воронов В.Г., Романова Н.В. и др. Межцентральные от- |
|
коррекции. М: Книжная палата 1996; 125. |
|
ношения ЭЭГ при регрессирующем и хроническом Корсаковском |
17. |
Свидерская Н.Е., Королькова Т.А. Пространственная организация |
|
синдроме. Журн высш нервн деят 2001; 51: 5: 572—582. |
|
электрических процессов мозга. Журн высш нервн деят 1997; 47: 5: |
5. |
Гриндель О.М., Воронов В.Г., Скорятина И.Г. Структура когерентности |
|
782—911. |
|
альфа-ритма ЭЭГ фронтальных отделов коры у здоровых людей и |
18. |
Синельникова А.Н., Сологубов Е.Г., Яворский А.Б. и др. Взаимодействие |
|
больных с психической патологией. Доклады. Биол Наук 2002; 382: |
|
зрительного и проприоцептивного анализаторов при поддержании |
|
1—4. |
|
вертикальной позы. Физиология человека 2001; 27: 3: 61—65. |
6.Доброхотова Т.А., Брагина Н.Н. Функциональная асимметрия и пси19. Сологубов Е.В., Яворский А.Б., Кобрин В.И. и др. Роль вестибулярного и
хопатология очаговых поражений мозга. М: Медицина 1977; 359.
7.Жаворонкова Л.А., Габова А.В., Кузнецова Г.Д. и др. Пострадиационные нарушения межполушарной асимметрии электроэнцефалографических и термографических характеристик во время когнитивной деятельности. Журн высш нервн деят 2003; 53: 4: 410—419.
8.Жаворонкова Л.А., Лукьянов В.И., Максакова О.А., Щекутьев Г.А. Сопоставление стабилографических, электроэнцефалографических и клинических данных в процессе реабилитации больных с черепномозговой травмой. Физиология человека 2003; 29: 1: 38—47.
9.Жаворонкова Л.А., Максакова О.А., Смирнова Н.Я., Найдин В.Л. Динамика межполушарных соотношений когерентности ЭЭГ как отражение реабилитационного процесса у больных, перенесших тяжелую черепно-мозговую травму. Физиология человека 2001; 27: 2: 5—14.
10.Жаворонкова Л.А., Максакова О.А., Щекутьев Г.А. Роль зрительной афферентации в восстановлении позного контроля в разные сроки после черепно-мозговой травмы. Физиология человека 2005; 31: 4: 5—13.
11.Зайцев О.С. Психопатология тяжелой черепно-мозговой травмы: Дис. ... д-ра мед. наук. М: ИНХ РАМН 2004; 50.
12.Иоффе М.Е. Механизмы моторного обучения. М: Наука 1991; 195.
13.Лурия А.Р. Этапы пройденного пути. М: МГУ 2001; 152.
зрительного анализатора в изменении позной активности у детей с детским церебральным параличом в процессе лечения с использованием космической технологии (Стабилографическое исследование). Журн. Авиационная и космическая медицина 1995; 29: 5: 30—34.
20.Устинова К.И., Черникова Л.А., Иоффе М.Е., Слива С.С. Нарушения обучения произвольному контролю позы при корковом поражении различной локализации: к вопросу о корковых механизмах регуляции позы. Журн высш нервн деят 2000; 50: 3: 421—433.
21.Шарова Е.В. Адаптивно-компенсаторные перестройки биоэлектрической активности мозга человека при повреждении стволовых образований: Автореф. дис. ... д-ра биол. наук. М: ИВНД и НФ РАН 1999; 43.
22.Шарова Е.В., Образцова Е.Р., Зайцев О.С. и др. Особенности ЭЭГ при посттравматическом Корсаковском синдроме. Журн неврол и психиат 2001; 101: 5: 32—38.
23.Balon R.W., Jacobson K.M., Enrietto J.A. et al. Balance disorders in older persons: quantification with posturography. Otolaryngol Head Neck Surg 1998; 119: 1: 89—92.
24.Damassio Н. The somatic markers hypothesis and possible functions of the prefrontal cortex. Phil Trans R Soc Bul 1995; 351: 1413—1420.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
47 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
25.Geurts A., Hendrick H., Van Der Linden S. Van Nes I. Independent influ32. Schreder E.J.A. Basic science of the interaction in gait and mental dysfunc-
ence of visuospatial hemineglect on postural control in the acute phase of stroke. Neurorehabilitation Neural Rep 2008; 22: 5: 566.
26.Ioffe M.E., Ustinova K.L., Chernikova L.A., Koulikov M.A. Supervised learning of postural tasks in patients with poststroke hemiparesis, Parkinson’s disease of cerebbelr ataxia. Exp Brain Res 2006; 168: 3: 384—394.
27.Knyazeva M.G., Jalili M., Meuli R. et al. Alpha rhythm and hypophrontality in schizophrenia. Acte Psychiat Scand 2008; 118: 188—199.
28.Lopez da Silva F.H. Neural mechanisms underlying brain waves: from neural membrane to networks. EEG and Сlin Neurophysiol 1991; 79: 81.
29.Malec J.F., Thompson J.M. Relationship of the Mayo-Portland Adaptability Inventory to functional outcome and cognitive performance measures. J Head Trauma Rehabil 1994; 9: 4: 1—15.
30.Oyama H., Mabuchi T., Niwa M. et al. Traumatic Forsakoff syndrome. J Clin Neurosci 1998; 5: 441—444.
31.Radovanovic S., Dragasevic N., Markovic S. et al. Cognitive and motor dual task effect on posture and balance impairment in Parkinsons disease patients. — “visual deprivation was strong only combined with mental task”. Abstracts of the 2nd Congress on Gait and Mental Functions. Amsterdam 2008; 128.
tion — “gait and cognitive activity is closely related, gait disturbances may occur in various types of dementia”. Abstracts of the 2nd Congress on Gait and Mental Functions. Amsterdam 2008; 15.
33.Sharova E.V., Obraztsova E.R., Zaitsev O.S. et al. Neurophysiological analysis of posttraumatic Korsakov’s syndrome. Abstracts of international symposium “Hippocampus and memory” 2006; 105.
34.Strelets V.B., Garakh Zh.V., Novototskii-Vlasov V.Y., Magamedov R.A. EEG power and rhythm synchronosation in health and cognitive pathology. Neurosci Behav Physiol 2006; 36: 6: 655—662.
35.Sullivan E.V., Prefferbaum A. Neuroimaging of the Wernike-Korsakoff syndrome. Alcohol Alcohol 2008; 118: 238—245.
36.Tucker D.H., Stenslie C.E., Roth R.S., Shearer S.L. Right frontal lobe activation and right hemispheric performance decrement during depressed mood. Arch Gen Psychiat 1981; 38: 169—197.
37.Zhavoronkova L.A., Maksakova O.A., Schekutiev G.A. Effect of stabilotraining on pose control recovery at different stages of rehabilitation after traumatic brain injury. From basic motor control to functional recovery. Ed. N. Gantchev. Sofia (Bulgaria) 2007; 139—143.
48 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
