
Журнал неврологии и психиатрии / 2010 / NEV_2010_01_062
.pdf
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Возможности превентивной терапии болезни Альцгеймера: результаты 3-летнего проспективного открытого сравнительного исследования эффективности и безопасности курсовой терапии церебролизином и кавинтоном у пожилых пациентов с синдромом мягкого когнитивного снижения
Д.м.н., проф. С.И. ГАВРИЛОВА1, в.н.с. И.В. КОЛЫХАЛОВ1, к.м.н. Я.Б. ФЁДОРОВА1, д.м.н. Н.Д. СЕЛЕЗНЕВА1, д.м.н. Я.Б. КАЛЫН1, к.псх.н. И.Ф. РОЩИНА1, д.м.н., проф. М.М. ОДИНАК 2, к.м.н. А.Ю. ЕМЕЛИН2, к.м.н. А.В. КАШИН2, д.м.н. А.В. ГУСТОВ3, к.м.н. Е.А. АНТИПЕНКО3, асп. Ю.А. КОРШУНОВА3, врач Т.А. ДАВЫДОВА3, Г. МЕССЛЕР4
Possibilities of preventive treatment of Alzheimer’s disease: results of the 3-year open prospective comparative study on efficacy and safety of the course therapy with cerebrolysin and cavinton
in elderly patients with the syndrome of mild cognitive impairment
S.I. GAVRILOVA, I.V. KOLYKHALOV, YA.B. FEDOROVA, N.D. SELEZNEVA, YA.B. KALYN, I.F. ROSHCHINA, M.M. ODINAK, A.YU. EMELIN, A.V. KASHIN, A.V. GUSTOV, E.A. ANTIPENKO, YU.A. KORSHUNOVA, T.A. DAVYDOVA, G. MESSLER
1Отдел по изучению болезни Альцгеймера и ассоциированных с ней расстройств Научного центра психического здоровья РАМН, Москва; 2кафедра нервных болезней Военно-медицинской академии, Санкт-Петербург; 3кафедра неврологии, нейрохирургии и
психиатрии ЦПК и ППС Нижегородской государственной медицинской академии; 4Эбеве Нейро Фарма ГмбХ, Австрия
Исследование было проведено в 3 российских центрах (Москва, Санкт-Петербург, Нижний Новгород). Общая выборка состояла из 110 больных, психическое состояние которых соответствовало понятию «мягкое когнитивное снижение» (mild cognitive impairment) — MCI. Состояние больных оценивалось по ряду общепринятых шкал (MMSE, GDS, CDR и др.) и батарее нейропсихологических тестов. Кроме того, у больных определяли генотип ApoE. Пациенты были разделены на 2 сопоставимые группы в соответствии с особенностями лечения: 55 больных лечились церебролизином и 55 — кавинтоном. Получены данные, свидетельствующие о преимуществах терапии церебролизином по сравнению с кавинтоном в отношении замедления прогрессирования когнитивного дефицита и отодвигания срока или перехода больных в диагностическую категорию болезни Альцгеймера. Особенностью действия церебролизина была его более высокая эффективность у больных с MCI, имеющих генотип ApoE4+, т.е. пациентов из группы высокого риска по болезни Альцгеймера. Нежелательные явления в процессе терапии были редкими в обеих группах.
Ключевые слова: мягкое когнитивное снижение, болезнь Альцгеймера, превентивная терапия, церебролизин, кавинтон.
The study was conducted in 3 Russian centers (Moscow, St. Petersburg and Nizhniy Novgorod). The total sample included 110 patients whose mental state met the definition of «mild cognitive impairment» (MCI). Patient’s status was assessed with widely used scales (MMSE, GDS, CDR etc) and a battery of neuropsychological tests. Genotyping for the APOE polymorphism was performed as well. Patients were stratified into 2 comparable groups in compliance with the specifics of therapy: 55 patients were treated with cerebrolysin and 55 — with cavinton. The superiority of cerebrolysin over cavinton in slowing down of the cognitive deficit progression and delaying the time or transition of patients to the diagnostic category of Alzheimer’s disease was demonstrated. Cerebrolysin was particularly effective in MCI patients with the ApoE(+) genotype, i.e. in those with higher risk for Alzheimer’s disease. Adverse effects during the treatment were rare in both groups.
Key words: mild cognitive impairment, Alzheimer’s disease, preventive treatment, cerebrolysin, cavinton.
Одной из главных причин тяжелой инвалидизации |
В 2007 г., по данным Альцгеймеровской ассоциации, |
|
пожилых людей является деменция, обусловленная бо- |
в США насчитывалось 5,1 млн пациентов с БА и ожидает- |
|
лезнью Альцгеймера (БА). Хотя это заболевание известно |
ся, что к 2050 г. этот показатель приблизится к 13 млн [13]. |
|
уже более 100 лет, реальные шаги в изучении его нейро- |
На долю БА и других деменций позднего возраста прихо- |
|
биологических основ и поиске методов терапии стали ак- |
дится 3,2 млн госпитализаций в год. Общие (т.е. прямые и |
|
тивно предприниматься только в последней четверти про- |
непрямые) затраты в США в связи с БА превышают |
|
шлого века. Сегодня в экономически развитых странах |
100 млрд долл. ежегодно [19]. |
|
исследования в области БА стали одним из приоритетных |
Общий размер средств, необходимых для ухода за |
|
направлений в развитии медицинской науки и здравоох- |
больными с деменцией, быстро возрастает в последние |
|
ранения. |
десятилетия, что является следствием увеличения числа |
|
|
|
|
© Коллектив авторов, 2010 |
e-mail: sigavrilova@yandex.ru |
|
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:1:62 |
|
|
62 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
таких пациентов [17]. По данным Delphy Consensus study (2005), 24,3 млн человек во всем мире страдают деменцией, в большинстве случаев обусловленной БА. Ежегодно в мире регистрируется 4,6 млн новых случаев деменции, т.е. каждые 7 с — 1 новый случай приобретенного слабоумия. По прогнозу международной группы экспертов, принимавших участие в этом исследовании, каждые последующие 20 лет число случаев деменции будет удваиваться. Ожидается, что к 2020 г. в мире 42,3 млн человек будут страдать деменцией, а к 2040 г. их численность достигнет уже 81,1 млн [17].
Показатели отечественной официальной статистики, касающиеся распространенности БА, являются значительно более низкими (по сравнению с мировыми данными). Однако популяционное эпидемиологическое исследование, проведенное в Центре по изучению болезни Альцгеймера РАМН, показало, что 4,5% пожилых жителей Москвы (в возрасте 60 лет и старше, т.е. каждый 22-й пожилой человек), страдают БА [8]. Экстраполяция полученных эпидемиологических данных на демографические показатели России на 2004 г.1 позволила смоделировать общую численность больных, страдающих деменцией в Российской Федерации. Методом математического моделирования было определено, что в 2004 г. на территории РФ проживали 1 851 432 человека с деменцией [1].
Из-за продолжающегося постарения населения как развитых, так и развивающихся стран и отсутствия методов лечения БА представляет собой неуклонно возрастающую угрозу существующим национальным системам здравоохранения многих государств [26].
Современные стратегии терапии БА, основанные на применении ингибиторов ацетилхолинэстеразы (АХЭ) и антагонистов NMDA-рецепторов позволяют достигать только временного и умеренного терапевтического эффекта. Отсутствуют данные, подтверждающие скольконибудь длительное и явное стабилизирующее или замедляющее течение болезни воздействие. Вместе с тем все расширяющиеся благодаря достижениям нейронаук знания базисных патогенетических механизмов нейродегенерации альцгеймеровского типа дают основания для определения возможных целей превентивного терапевтического вмешательства на самых ранних (доклинических) стадиях болезни.
Наряду с разработкой антиамилоидных стратегий терапии БА, методов блокирования избыточного фосфорилирования тау-белка в качестве потенциального объекта превентивного и лечебного воздействия все большее внимание уделяется нейропротективным и нейротрофическим подходам, включая применение нейротрофинов, нейротрофических факторов, стволовых клеток. Однако большинство из этих методов пока находится на стадии доклинических или ранних клинических исследований.
Не менее значимым, чем разработка новых стратегий и средств превентивной терапии БА, является определение объекта такой терапии. Хорошо известно, что первые клинические проявления этого заболевания делаются явными не ранее чем через 10—15 лет, а диагноз БА ставится не ранее чем через 20 лет после начала нейродегенеративного процесса. Однако выделить из общей популяции пожилых людей тех, кто уже находится на стадии клинически «немого» течения болезни, представляется сегодня задачей малореалистической (особенно в массовом масштабе) в связи с отсутствием надежных и специфичных
биологических маркеров, за исключением определения носителей генетических аномалий, ответственных за очень редкие «семейные» формы болезни, имеющие преимущественно раннее (до 65 лет) начало.
Как известно, снижение памяти является почти обязательным признаком старости. Для выделения из общей пожилой популяции лиц, у которых возрастное ухудшение памяти будет неуклонно прогрессировать в ближайшие годы до степени деменции, т.е. пожилых людей, с большой вероятностью находящихся на клинически «немой» стадии развития БА (или иной деменции), была разработана концепция мягкого когнитивного снижения (mild cognitive impairment — MCI)2 [15]. К настоящему времени разработана типология синдрома с выделением амнестического (моно- и мультифункционального) и неамнестического его типов [22]. Именно первый из них имеет наибольшую вероятность перехода в БА. До 80% пациентов с синдромом MCI амнестического типа за 6 лет получают диагноз БА, со среднегодовым показателем перехода в БА — 10—12% [21]. По данным тех же авторов, этот показатель для лиц аналогичного возраста без синдрома MCI равен 1—2%.
К настоящему времени не только сформулирована дефиниция синдрома MCI, который определяется наличием легких признаков ухудшения памяти и/или когнитивного снижения при отсутствии данных, подтверждающих диагноз деменции и при исключении церебральных повреждений или системных заболеваний, которые могут быть ответственны за развитие когнитивного снижения, но и разработаны достаточно четкие операциональные критерии для его диагностики [15]. По мнению специалистов, именно когорты пожилых лиц с синдромом MCI амнестического типа должны быть целевой популяцией для проведения клинических исследований по эффективности предлагаемых методов превентивной терапии БА.
Одним из перспективных направлений в разработке превентивных терапевтических подходов для замедления или предотвращения клинической манифестации БА у лиц из группы риска по этому заболеванию является применение нейротрофинов или лекарственных средств с нейротрофическими свойствами.
Церебролизин воспроизводит эффект фактора роста нервов (nervous growth factor — NGF), доказательной базой чего служат многочисленные данные экспериментальных исследований, выполненных в разных странах с применением различных моделей нейронального повреждения и дегенерации, включая модель имплантирования β-амилоида в гиппокамп старых крыс [16, 23] и АроЕнокаутированных мышей [18]. Более подробный анализ исследований, посвященных нейротрофическим и нейропротективным эффектам церебролизина, приведен в работах С.И. Гавриловой и соавт. [4, 6] и M. Windisch и соавт. [27].
Группой американских авторов [14] недавно было доказано, что нейротрофический эффект церебролизина может быть обусловлен присутствием активных пептидов нейротрофических факторов. По их данным, в церебро-
1Данные Российского статистического ежегодника (2004).
2Из-за несовпадений в русскоязычной терминологии мы пользуемся оригинальным наименованием и соответствующей аббревиатурой.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
63 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
лизине обнаружена активность цилиарного (CNTF), глиального (GDNF) и инсулиноподобных факторов-1 и -2 (IGF-1; IGF-2).
В серии выполненных рандомизированных клинических исследований была доказана как клиническая эффективность церебролизина (применяемого в виде курса внутривенных инфузий по 20—30 мл препарата в 100 мл изотонического раствора хлорида натрия (курс 20 инфузий), так и безопасность его применения у пациентов с БА на стадии мягкой и умеренной деменции [2, 8, 25]. Проведенные исследования, кроме того, показали, что терапевтический эффект препарата сохраняется на протяжении от 2 до 6 мес после завершения терапии [12]. Выполненное в России сравнительное клиническое исследование долговременных эффектов церебролизина (4 курса на протяжении 22 мес) доказало, что церебролизин представляет собой не только эффективное средство симптоматической терапии (сопоставимое по эффективности с экселоном), но и обладает отчетливым позитивным модифицирующим воздействием на течение нейродегенеративного процесса альцгеймеровского типа на стадии мягкой и умеренной деменции [5].
На основании имеющихся данных было сделано предположение о том, что применение долговременной курсовой терапии церебролизином могло бы способствовать предотвращению или замедлению клинической манифестации БА у пациентов с амнестическим типом синдрома MCI, которые представляют собой группу риска относительно быстрого развития БА.
Целью настоящей работы являлось изучение в условиях открытого сравнительного исследования эффективности и безопасности применения длительной (3 года) курсовой терапии церебролизином и кавинтоном (по 2 курса в год).
Указанные лечебные средства рассматривались как медикаменты, потенциально способные замедлить или предотвратить переход синдрома MCI амнестического типа в клинически выраженную деменцию.
Материал и методы
Исследование выполнялось по унифицированной методике с применением стандартных инструментов в 3 исследовательских центрах: в отделе по изучению БА и ассоциированных с ней расстройств НЦПЗ РАМН (Москва), на кафедре нервных болезней Военно-медицинской академии (Санкт-Петербург) и на кафедре неврологии, нейрохирургии и психиатрии Нижегородской государственной медицинской академии.
Висследование были включены 110 больных: по 30 —
вСанкт-Петербурге и Нижнем Новгороде, и 50 — в Москве.
Сравниваемые терапевтические группы в каждом из центров составлялись по единой методике из когорты пожилых пациентов, соответствовавших критериям включения и исключения. Отбирались больные по следующим основным признакам: пол, возраст (до 65 и после 65 лет) и АроЕ 4 (+/–) генотип.
Критерии включения пациентов в исследование: женщины (в постменопаузальном периоде) и мужчины в возрасте от 55 до 85 лет; оценка по краткой шкале оценки психического статуса MMSE более 26 баллов; жалобы на снижение памяти, подтверждаемые информантом (обыч-
но членом семьи), и объективно выявляемые признаки легких когнитивных дисфункций (по крайней мере в тестах на исследование памяти и тех когнитивных сфер, которые обычно явно нарушаются при БА); признаки когнитивного дефицита, соответствующие 3-й стадии по шкале Global Deterioration Scale (GDS) [24] и оценке 0,5 по шкале Clinical Dementia Rating (CDR) [20]; невозможность постановки диагноза деменции; сохранность повседневной активности пациентов, хотя могло быть легкое ухудшение в сложных и инструментальных видах повседневной и/или профессиональной деятельности; оценка по модифицированной шкале Хачински <4; получение письменного информированного согласия от пациента.
Критериями исключения являлись: диагноз деменции (по критериям DSM-IV, МКБ-10); неврологические заболевания (врожденные и/или приобретенные метаболические энцефалопатии, токсические и лекарственные энцефалопатии, болезнь Паркинсона, мультиинфарктная деменция, инсульт, эпилепсия, инфекционные заболевания, демиелинизирующие и наследственно-дегенератив- ные заболевания ЦНС); неопластические и/или травматические повреждения головного мозга; системные заболевания; психические болезни; тяжелая органная патология; злокачественные экстрацеребральные опухоли; ВИЧ-инфекция; сахарный диабет в стадии декомпенсации или другие эндокринные заболевания; алкоголизм и/ или лекарственная зависимость; медикаментозная или иная интоксикация; оценка более 18 баллов по шкале депрессии Гамильтона; уровень систолического давления >180 мм рт.ст., диастолического >95 мм рт.ст.; дефицит фолиевой кислоты и/или витамина В12.
Соблюдение перечисленных признаков и критериев позволило составить почти идентичные выборки по центрам.
В соответствии с целью исследования больные были разделены на 2 терапевтические группы.
1-ю группу составили 55 пациентов, получавших 2 раза в год в течение 3 лет курсовую терапию церебролизином: по 20 внутривенных инфузий церебролизина (по 30 мл препарата в 100 мл физиологического раствора) на протяжении 4 нед за курс.
2-ю группу, равную (55) по численности, составили пациенты, получавшие в течение 3 лет (2 раза в год) курсовое лечение кавинтоном (по 5 мг 3 раза в день в течение 4 нед).
Характеристика этих групп представлена в табл. 1. Оценка состояния когнитивных функций пациентов
проводилась по шкалам и тестам (см. табл. 1).
Для оценки достоверности различий между средними суммарными оценками в 1-й и 2-й группах использовались методы непараметрической статистики — вычисление критериев Вилкинсона (для выборок с любым распределением признаков).
Сравниваемые группы к началу исследования статистически достоверно не различались по среднему возрасту пациентов, половому составу, а также по распределению пациентов, имеющих генотипы АроЕ4(+) и АроЕ4(–) (см. табл. 1). Группы оказались практически идентичными по исходной тяжести когнитивных расстройств. Хотя пациенты 1-й группы имели достоверно лучшие оценки по шкале MMSE (с разницей в 0,4 балла), но по всем остальным тестам и шкалам они не только не обнаруживали до-
64 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Таблица 1. Сравнительная характеристика исследованных групп пациентов
Показатель |
1-я группа |
2-я группа |
Число больных |
55 |
55 |
мужчины |
14 |
15 |
женщины |
41 |
40 |
Средний возраст, годы |
66,9±1,1 |
68,4±1,1 |
ApoE генотип: |
|
|
АроЕ4 (+) |
26 |
25 |
АроЕ 4 (–) |
29 |
30 |
Средние суммарные оценки по шкалам и тестам, баллы |
|
|
MMSE |
28,6±0,1* |
28,2±0,1 |
Шкала Хачинского |
1,8±0,1 |
1,8±0,1 |
Шкала депрессии Гамильтона |
5,5±0,5 |
5,5±0,5 |
Шкала тяжести деменции (CDR) |
0,5 |
0,5 |
Шкала глобального ухудшения (GDS) |
3 |
3 |
Тест рисования часов |
9,0±0,2 |
9,0±0,2 |
Батарея лобной дисфункции |
13,3±0,3 |
13,1±0,3 |
Субтесты шкалы Векслера: |
|
|
звуковые ассоциации |
14,0±0,5 |
13,9±0,5 |
категориальные ассоциации |
15,4±0,5 |
15,3±0,5 |
Бостонский тест называния |
47,8±0,8 |
47,9±0,6 |
Называние цифр в прямом порядке |
6,2±0,1 |
6,0±0,1 |
Называние цифр в обратном порядке |
4,4±0,1 |
4,4±0,2 |
Запоминание 10 слов (немедленное) |
7,2±0,2 |
7,3±0,2 |
Отсроченное воспроизведение 10 слов |
7,5±0,3 |
7,7±0,3 |
Субтесты шкалы деменции Маттиса |
|
|
реципрокная координация |
2,7±0,1 |
2,9±0,1 |
графомоторная проба |
9,4±0,2 |
9,5±0,1 |
обнаружение сходства |
7,3±0,2 |
7,1±0,2 |
память |
22,4±0,2 |
22,2±0,3 |
Примечание. *— достоверность различий между группами (р<0,05).
стоверных различий по сравнению со 2-й группой, но и |
функционирования начиная со 2-го года лечения и до |
оказались практически идентичными по большинству |
окончания исследования по следующим тестам: звуковые |
оценивавшихся параметров. |
и категориальные ассоциации из шкалы Векслера, 2 суб- |
Результаты и обсуждение |
теста шкалы деменции Маттиса — «сходство» и «память». |
Показатели Бостонского теста показывания и называния |
|
Полностью завершили 3-летний курс терапии 46 па- |
картинок достоверно улучшались, уже начиная с 1-го года |
исследования, и такая положительная динамика отмеча- |
|
циентов 1-й группы и 42 пациента 2-й группы; соответ- |
лась вплоть до его завершения. К окончанию исследова- |
ственно 9 и 13 пациентов досрочно выбыли из исследова- |
ния также достоверно улучшились показатели тестов «ба- |
ния в связи с причинами немедицинского характера. |
тарея лобной дисфункции» и «рисование часов». Лишь в |
Помимо анализа динамики тестовых оценок, у паци- |
тесте отсроченного воспроизведения 10 слов у пациентов |
ентов обеих групп были проанализированы показатели |
1-й группы установлено достоверное ухудшение исходно- |
перехода пациентов из одной клинической стадии когни- |
го показателя. Исходные показатели остальных 7 когни- |
тивной недостаточности в другую за весь период проведе- |
тивных тестов не изменились либо недостоверно улучша- |
ния исследования (оценка велась по шкале CDR [20]. В |
лись или ухудшались (только тест «реципрокная коорди- |
1-й группе к окончанию исследования (т.е. через 3 года от |
нация») к окончанию исследования (табл. 2). |
его начала) только 2 (3,6%) пациента перешли на стадию |
Во 2-й группе пациентов к окончанию исследования |
мягкой деменции, обусловленной БА. Во 2-й группе к |
достоверная положительная динамика установлена лишь |
окончанию исследования 7 (12,7%) из 55 больных переш- |
для субтеста «сходства» из шкалы деменции Маттиса. К |
ли на стадию мягкой деменции и получили диагноз БА. |
окончанию 2-го года исследования достоверная позитив- |
Таким образом, частота постановки диагноза БА в те- |
ная динамика отмечалась и в тесте рисования часов. До- |
чение 3 лет с начала исследования в группе, леченной це- |
стоверное ухудшение показателей к окончанию исследо- |
ребролизином, оказалась в 3,5 раза ниже соответствующе- |
вания было установлено по 2 когнитивным тестам: «запо- |
го показателя в группе больных, получавших терапию ка- |
минание 10 слов» и «называние цифр в обратном поряд- |
винтоном. |
ке». Недостоверное ухудшение оценок к окончанию ис- |
Анализ динамики среднегрупповых суммарных те- |
следования имело место по 4 тестам: MMSE, «называние |
стовых оценок у больных 1-й группы (церебролизин) по- |
цифр в прямом порядке», «отсроченное воспроизведение |
казал достоверное улучшение показателей когнитивного |
10 слов», субтест «память» из шкалы деменции Маттиса. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
65 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Таблица 2. Динамика среднегрупповых суммарных оценок (баллы) по когнитивным тестам в 1-й группе (церебролизин)
Когнитивные тесты и шкалы |
|
|
Годы |
|
|
до лечения |
1-й |
2-й |
3-й |
||
|
|||||
MMSE |
28,6±0,1 |
28,3±0,3 |
28,9±0,2 |
28,6±0,2 |
|
Тест рисования часов |
9,0±0,2 |
9,1±0,2 |
9,5±0,1 |
9,6±0,1* |
|
Батарея лобной дисфункции |
13,3±0,3 |
13,5±0,3 |
13,7±0,2 |
13,7±0,2* |
|
Субтесты шкалы Векслера |
|
|
|
|
|
звуковые ассоциации |
14,0±0,5 |
14,4±0,5 |
15,5±0,6* |
15,9±0,5* |
|
категориальные ассоциации |
15,4±0,5 |
15,7±0,6 |
16,3±0,5* |
16,8±0,4* |
|
Бостонский тест называния |
47,8±0,8 |
48,8±0,8* |
50,3±0,7* |
50,5±0,6* |
|
Называние цифр в прямом порядке |
6,3±0,1 |
6,3±0,1 |
6,3±0,1 |
6,3±0,1 |
|
Называние цифр в обратном порядке |
4,4±0,1 |
4,4±0,1 |
4,6±0,1 |
4,6±0,1 |
|
Запоминание 10 слов (немедленное) |
7,2±0,2 |
7,4±0,2 |
7,5±0,2 |
7,5±0,2 |
|
Отсроченное воспроизведение 10 слов |
7,5±0,3 |
7,3±0,4 |
8,1±0,9 |
6,8±0,3* |
|
Субтесты шкалы деменции Маттиса |
|
|
|
|
|
реципрокная координация |
2,7±0,1 |
2,7±0,1 |
2,8±0,1 |
2,8±0,1 |
|
графомоторная проба |
9,4±0,2 |
9,6±0,1 |
9,8±0,1 |
9,7±0,1* |
|
обнаружение сходства |
7,3±0,2 |
7,5±0,2 |
7,8±0,1* |
7,8±0,1* |
|
память |
22,4±0,2 |
22,2±0,4 |
22,9±0,3* |
22,8±0,3* |
Примечание. Здесь и в табл. 3: * — достоверные различия по сравнению с оценкой до начала терапии при р<0,05.
Таблица 3. Динамика среднегрупповых суммарных оценок (баллы) по когнитивным тестам во 2-й группе (кавинтон)
Когнитивные тесты и шкалы |
|
|
Годы |
|
|
до лечения |
1-й |
2-й |
3-й |
||
|
|||||
MMSE |
28,2 ±0,1 |
28,1±0,2 |
28,2±0,3 |
27,9±0,3 |
|
Тест рисования часов |
9,0±0,2 |
9,1±0,2 |
9,4±0,2* |
9,2±0,2 |
|
Батарея лобной дисфункции |
13,1±0,3 |
13,3±0,3 |
13,4±0,2 |
13,2±0,2 |
|
Субтесты шкалы Векслера: |
|
|
|
|
|
звуковые ассоциации |
13,9±0,5 |
14,6±0,5 |
14,8±0,5 |
14,6±0,5 |
|
категориальные ассоциации |
15,7±0,5 |
15,5±0,5 |
16,0±0,6 |
16,3±0,6 |
|
Бостонский тест называния |
47,9±0,6 |
48,0±0,6 |
48,8±0,7 |
48,2±0,8 |
|
Называние цифр в прямом порядке |
6,0±0,1 |
5,9±0,1 |
5,9±0,2 |
5,7±0,2 |
|
Называние цифр в обратном порядке |
4,4±0,2 |
4,2±0,1 |
4,0±0,1* |
3,9±0,1* |
|
Запоминание 10 слов (немедленное) |
7,3±0,2 |
7,2±0,2 |
7,1±0,2 |
6,8±0,2* |
|
Отсроченное воспроизведение 10 слов |
7,7±0,3 |
7,1±0,3 |
7,8±0,3 |
7,3±0,4 |
|
Субтесты шкалы деменции Маттиса: |
|
|
|
|
|
реципрокная координация |
2,9±0,1 |
2,9±0,1 |
2,8±0,1 |
2,8±0,1 |
|
графомоторная проба |
9,5±0,1 |
9,7±0,1 |
9,5±0,1 |
9,6±0,1 |
|
обнаружение сходства |
7,1±0,2 |
7,3±0,2 |
7,5±0,2 |
7,5±0,2* |
|
память |
22,2±0,3 |
22,0±0,4 |
22,1±0,4 |
21,8±0,4 |
В то же время улучшение оценок (недостоверное) к окон- |
сравнению с исходными оценками, а еще по 2 тестам — об |
чанию исследования отмечено по 6 другим когнитивным |
отсутствии негативной динамики. В то же время у пациен- |
тестам (табл. 3). |
тов 2-й группы (леченных кавинтоном) за тот же период |
При сравнении величины терапевтического эффекта, |
установлено прогрессирующее ухудшение когнитивного |
т.е. разности между исходными и посттерапевтическими |
функционирования по половине из оценивающихся пара- |
показателями когнитивного функционирования между |
метров (по 7 из 14 тестов). Улучшение финальных оценок |
группами, лечившимися церебролизином и кавинтоном, |
по 7 оставшимся тестам оказалось меньшим по сравнению |
обнаружено, что соответствующие показатели эффектив- |
с терапевтическим эффектом у больных 1-й группы. |
ности терапии в 1-й группе оказались достоверно лучши- |
Терапевтическая эффективность превентивной тера- |
ми по сравнению со 2-й группой по 3 из 14 применявших- |
пии церебролизином и кавинтоном в зависимости от гено- |
ся когнитивных тестов и шкал (Бостонский тест называ- |
типа АроЕ 4(+/–). У пациентов с генотипом АроЕ 4(+), |
ния, «запоминание 10 слов» и «называние цифр в обрат- |
леченных церебролизином, показатель перехода синдрома |
ном порядке») (рис. 1). |
MCI в БА оказался в 2,5 раза меньшим по сравнению с тем |
Следует отметить, что у пациентов, получавших цере- |
же показателем для больных с аналогичным генотипом, |
бролизин, динамика большинства (9 из 14) показателей |
получавших кавинтон. Из пациентов, имевших генотип |
свидетельствовала о положительном эффекте терапии, о |
АроЕ 4(–), только лица, лечившиеся кавинтоном, пере- |
чем говорит улучшение этих когнитивных показателей по |
шли на стадию деменции и получили диагноз БА (табл. 4). |
66 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
Таблица 4. Число больных 1-й и 2-й групп, перешедших в диагностическую категорию БА в зависимости от генотипа АроЕ 4
Генотип |
|
1-я группа (n=26) |
|
|
|
2-я группа (n=25) |
|
абс. |
% |
|
абс. |
% |
|
|
|
|
||||
АроЕ 4(+) |
2 |
7,7 |
|
5 |
20,0 |
|
АроЕ 4(–) |
0 |
0 |
|
2 |
6,7 |
|
Таблица 5. Частота нежелательных эффектов терапии в 1-й и 2-й группах больных |
|
|
||||
|
|
|
|
|
|
|
Нежелательное явление |
|
|
Число пациентов, абс. |
|||
|
|
1-я группа |
2-я группа |
|||
|
|
|
|
|
||
Острое респираторное вирусное заболевание (ОРВИ) |
|
|
1 |
0 |
||
Острое респираторное заболевание (ОРЗ) |
|
|
1 |
2 |
||
Головная боль |
|
|
|
1 |
0 |
|
Диарея |
|
|
|
0 |
1 |
|
Обострение хронического панкреатита |
|
|
|
1 |
0 |
|
Перелом шейки бедра |
|
|
|
1 |
0 |
|
Артроз правого тазобедренного сустава |
|
|
0 |
1 |
||
Рак яичника, экстирпация матки |
|
|
|
1 |
0 |
|
Рак предстательной железы |
|
|
|
0 |
1 |
|
Рак молочной железы |
|
|
|
0 |
1 |
|
Стенокардия |
|
|
|
0 |
1 |
|
Тромбофлебит вен правой ноги |
|
|
|
1 |
0 |
|
Язвенная болезнь желудка, обострение |
|
|
|
1 |
0 |
|
Всего |
|
|
|
8 |
7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
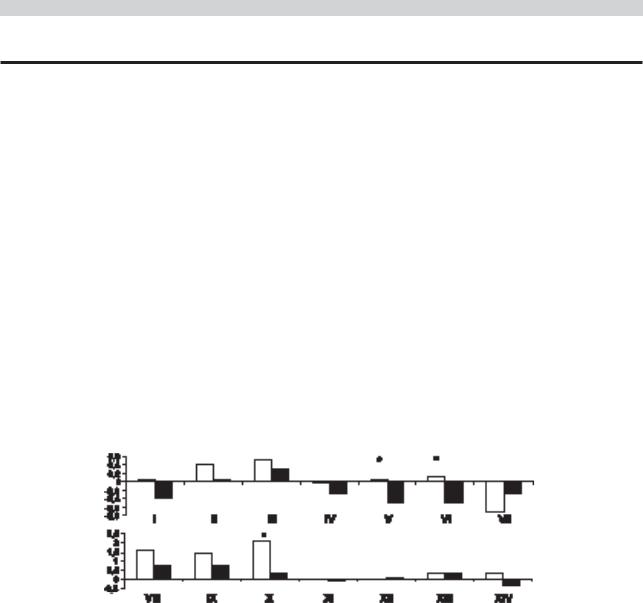
Рис. 1. Сравнение терапевтического эффекта у больных с синдромом MCI, леченных церебролизином (1-я группа) и кавинтоном (2-я группа).
Здесь и на рис. 2 и 3 сравнение терапевтического ответа дается по разности между финальной и начальной оценками среднегрупповых суммарных показателей когнитивных тестов.
Первый столбец к каждой паре — 1-я группа, второй — 2-я. По оси ординат баллы.
Римскими цифрами обозначены изучавшиеся функции и тесты: I — MMSE, II — батарея лобной дисфункции, III — тест рисования часов, IV — называние цифр в прямом порядке, V — называние цифр в обратном порядке, VI — запоминание 10 слов, VII — отсроченное воспроизведение 10 слов, VIII — звуковые ассоциации, IX — категориальные ассоциации, X — Бостонский тест, XI — реципрокная координация, XII — графомоторная проба, XIII — сходства, XIV — память.
* — различия между группами достоверны (р<0,05).
По результатам тестовой оценки когнитивных функ- |
Пациенты с генотипом АроЕ 4(+), лечившиеся ка- |
ций у пациентов с генотипом АроЕ 4(+) (рис. 2) выявлено |
винтоном, достоверных позитивных различий в эффек- |
достоверное различие в терапевтическом эффекте в поль- |
те терапии (по тестовым оценкам) по сравнению с цере- |
зу церебролизина между группами по 2 тестам: «запоми- |
бролизином не имели, хотя по 4 когнитивным тестам у |
нание 10 слов» и «Бостонский тест называния», а в целом |
них к окончанию лечения отмечалась положительная |
положительный эффект в виде улучшения показателей по |
динамика. |
сравнению с исходными, не достигавший уровня досто- |
Таким образом, пациенты с синдромом MCI, имею- |
верных межгрупповых различий, обнаружен еще по 9 ког- |
щие генотип АроЕ 4(+), дают существенно более выра- |
нитивным тестам. |
женный терапевтический ответ на терапию церебролизи- |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
67 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
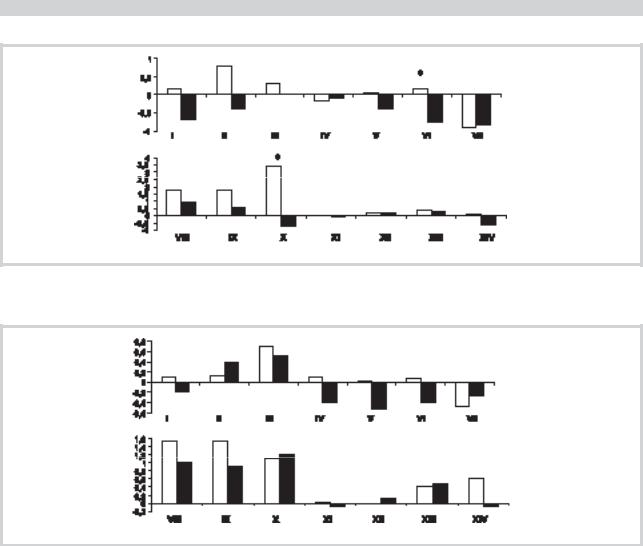
Рис. 2. Сравнение терапевтического эффекта у больных с генотипом АроЕ 4(+), получавших церебролизин (1-я группа) и кавинтон (2-я группа).
Рис. 3. Сравнение терапевтического эффекта у больных с генотипом АроЕ 4(–), получавших церебролизин (1-я группа) и кавинтон (2-я группа).
ном по сравнению с кавинтоном, причем последний у этой категории пациентов не дает позитивного эффекта по большинству когнитивных показателей.
Пациенты из 1-й группы (рис. 3) с генотипом АроЕ 4(–) обнаружили достоверное различие в эффекте терапии в пользу церебролизина по сравнению со 2-й группой только по динамике среднего показателя теста «называние цифр в прямом порядке» и, наоборот, имели достоверное различие в пользу кавинтона по тесту «отсроченное воспроизведение 10 слов». В целом у больных с генотипом АроЕ 4(-) позитивный эффект на лечение церебролизином отмечался по 12, а на кавинтон — лишь по 7 когнитивным тестам.
Таким образом, межгрупповые различия в тестовых оценках когнитивного функционирования у больных с генотипом АроЕ 4(–) оказались менее отчетливыми, нежели у пациентов с генотипом АроЕ 4(+). В целом же позитивная динамика показателей когнитивного функционирования у пациентов с генотипом АроЕ 4(–) отмечалась чаще по сравнению с больными с генотипом АроЕ 4(+) как на лечение церебролизином, так и кавинтоном. Однако для получения более достоверных данных о зависимости терапевтического эффекта от генотипа АроЕ 4 требу-
ется увеличение числа наблюдений над пролеченными церебролизином и кавинтоном пациентами. Тем не менее высокий показатель перехода синдрома MCI в синдром деменции у больных с генотипом АроЕ 4(+), леченных кавинтоном, и в 2,5 раза меньший показатель негативной трансформации этого синдрома у пациентов с аналогичным генотипом, лечившихся церебролизином, свидетельствуют о возможности церебролизина замедлить (или, возможно, остановить) прогрессирование когнитивного дефицита и развитие БА.
Существенных различий в частоте и выраженности нежелательных эффектов терапии кавинтоном и церебролизином не обнаружено (табл. 5). Большинство нежелательных явлений были легкими или умеренно выраженными. Серьезные нежелательные явления, потребовавшие госпитализации и прекращения исследования, отмечались у 3 пациентов 1-й группы и у 2 — во 2-й группе.
Заключение
Результаты сравнительного исследования эффективности 3-летней курсовой терапии церебролизином и ка-
68 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ЛЕЧЕНИЕ БОЛЕЗНИ АЛЬЦГЕЙМЕРА
винтоном, проводившейся 2 раза в год в группах пожилых пациентов с синдромом MCI, которые исходно не различались достоверно по численности, полу, возрасту и распределению пациентов в зависимости от ApoE4(+) или Apo E4(–) генотипа, свидетельствуют о несомненных преимуществах терапии церебролизином по сравнению с кавинтоном в замедлении прогрессирования когнитивного дефицита и отодвигании срока или предотвращении его перехода в диагностическую категорию БА.
Особенностью действия церебролизина является его более высокая эффективность по сравнению с кавинтоном у пациентов с синдромом MCI, имеющих генетический фактор риска по БА — генотип Apo E4(+), т.е. у пожилых людей из категории высокого риска по БА.
Применявшиеся виды лекарственной терапии не различались достоверно по частоте и выраженности нежелательных явлений. Редкость нежелательных явлений терапии, в том числе тяжелых, за 3-летний период наблюдения свидетельствует о безопасности сравниваемых видов курсовой терапии.
Полученные результаты исследования, свидетельствующие о способности церебролизина замедлять или, возможно, приостанавливать прогрессирование когнитивного дефицита и переход синдрома MCI в БА, позволяют рекомендовать длительную курсовую терапию этим лекарственным препаратом в качестве средства превентивной терапии у пожилых людей, имеющих повышенный риск развития БА.
ЛИТЕРАТУРА
1.Белоусов Ю.Б., Медников О.Н., Чикина Е.С. Фармакоэкономические аспекты лечения деменции в РФ. Рус мед журн 2005;13:20:1354.
2.Гаврилова С.И., Колыхалов И.В., Селезнева Н.Д. и др. Двойное слепое плацебо-контролируемое исследование влияния церебролизина на эффективность и переносимость последующей холинергической терапии у больных с болезнью Альцгеймера. Соц и клин психиат 2000;2:41—46.
3.Гаврилова С.И., Калын Я.Б. Суицидально-средовые факторы и состояние психического здоровья пожилого населения. Вестн РАМН 2002;9:15—20.
docs//resourses/alzheimers/ National Report Facts and Figures.pdf.Accessed May 7, 2007.
14.Chen Y., Tung Yu., Li B. et al. Trophic factor counteract elevated FGF-2 unduced inhibition of adult neurogenesis . Neurobiol Aging 2007;28:1148— 1162.
15.Golomb J., Kluger A., Garrard P., Ferris S. Clinician’s Manuel on Mild Cognitive Impairment. Science. London: Press Ltd 2001;56.
16.Gschanes A., Windish M. The influence of Cerebrolysin and E021 on spatial navigation of 24-month-old rats. J Neurol Trasmis 1998;53:Suppl: 313—321.
4.Гаврилова С.И. Нейротрофическая и нейропротективная терапия. В 17. Low L.F., Anstey K.J. Dementia literacy: Recognition and Reliegs on De-
кн.: Фармакотерапия болезни Альцгеймера. М: Пульс 2003;185—224. |
mentia of the Australian public. J Alzheimer’s Dementia 2009;5:43—49. |
5.Гаврилова С.И., Колыхалов И.В., Коровайцева Г.И. и др. АроЕ генотип и 18. Masliah E., Armasolo F., Veinberg I. et al. Cerebrolysin ameliorates perfor-
эффективность нейротрофической и холинергической терапии при болезни Альцгеймера. Журн неврол и психиат 2005;105:4:27—33.
6.Гаврилова С.И., Фёдорова Я.Б., Колыхалов И.В. и др. Терапевтический потенциал церебролизина в превентивной терапии болезни Альцгеймера. Журн неврол и психиат 2008;108:8:24—28.
7.Гаврилова С.И. Возможности доклинической диагностики и превентивного терапевтического вмешательства при болезни Альцгеймера. В кн.: Болезнь Альцгеймера и когнитивные нарушения в пожилом возрасте: достижения в нейробиологии и терапии. М: Пульс 2008;6— 32.
8.Герасимов Н.П. Двойное слепое плацебо-контролируемое исследование эффективности церебролизина при болезни Альцгеймера. Соц и клин психиат 2000;2:35—40.
9.Калын Я.Б., Гаврилова С.И. Эпидемиологические и фармакоэкономические аспекты болезни Альцгеймера. В кн.: Болезнь Альцгеймера и когнитивные нарушения в пожилом возрасте: достижения в нейробиологии и терапии. М: Пульс 2008;275—285.
10.Alvares X.A., de Olano M., Sampedro C. et al. Cerebrolysin protect against neurodegeneration induced by β-amyloid implants in rats. Int J Neuropsychopharmac 2000;3:359.
mance deficits, and neuronal damage in apolipoprotein E-deficient mice. Pharmacol Biochem Behavior 1999;62:239—245.
19.Maslow K. How many people with dementia are hospitalized? In: Improving hospital care for persons with dementia. Eds. N.M. Silvertein, K. Maslow. New York: Springer 2006;3—21.
20.Morris J.C. The Clinical Dementia Rating (CDR): current version and scoring rules. Neurology 1993;43:2412—2414.
21.Petersen R.C., Smith G.E., Waring S.C. et al. Mild cognitive impairment: clinical characterization and outcome. Arch Neurol 1999;56:303—308.
22.Petersen R.C. Mild cognitive impairment as a diagnostic entity. J Int Med 2004;256:183—194.
23.Reinprecht I., Gschanes A., Windish M., Fachbach G. Two peptidergic drugs increase the synaptophysin immunoreactivity in brains of 24-month-old rats. Histochemical J 1999;31:395—401.
24.Reisberg B., Ferris S.H., de Leon M.J. et al. The global deterioration scale (GDS). An instrument for the assessment of primary degenerative dementia. Am J Psychiat 1982;139:1136—1139.
25.Ruther E., Ritter R., Apecechea M. et al. Efficacy of the Peptidergic Nootropic Drug Cerebrolysin in Patients with senile dementia of the Alzheimer Type. Pharmacopsychiatry 1994;27:1:32—40.
11.Alvarez X.A., Lombardi V.R., Fernandez–Novoa L. et al. Cerebrolysin re26. Sallaw A., Mintzez J., Weiner M., Cummings J. Disease-modifying therapies
duces microglial activation in-vivo and in-vitro: a potencial mechanism of neuroprotection. J Neurol Transm 2000;59:Suppl:281—292.
12.Alvares X.A., Cacabelos R., Laredo M. et al. A 24-week, double-blind, place- bo-controlled study of dosages of Cerebrolysin in patients with mild to moderate Alzheimer’s disease. Eur J Neurol 2006;13:43—54.
13.Alzheimer’s Association/ Every 72 seconds someone in America develops Alzheimer’s Chicago: Alzheimer’s Association 2007, http://www.alzwa.or/
in Alzheimer’s disease. J Alzheimer’s Dementia 2008;4:65—79.
27.Windisch M., Gschanes A., Hutter-Paier B. Neurotrophic activities and therapeutic experience with a brain derived peptide preparation. J Neurol Transm 1998;Suppl 53:289—298.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
69 |
