
Журнал неврологии и психиатрии / 2010 / NEV_2010_01_084
.pdf
КРАТКИЕ СООБЩЕНИЯ
Анализ ассоциаций между наследственными факторами риска развития рассеянного склероза и изменениями показателей МРТ головного мозга
Д.м.н., проф. А.Н. БОЙКО2, к.м.н. С.А. СИВЕРЦЕВА1
Association analysis between candidate genes for multiple sclerosis and brain MRI parameters
A.N. BOIKO, S.A. SIVERTSEVA
1Тюменский областной центр рассеянного склероза; 2кафедра неврологии и нейрохирургии Российского государственного медицинского университета; Московский городской центр рассеянного склероза
Ключевые слова: рассеянный склероз, HLA-DR, МРТ, межъядерный показатель.
Key words: multiple sclerosis, HLA-DR, MRI, internuclear index.
Рассеянный склероз (РС) — заболевание с выраженной клинической вариабельностью, непредсказуемостью прогноза, неизвестной этиологией и недостаточно изученным патогенезом [10, 14]. До сих пор не найдено единственного фактора, являющегося непосредственной причиной заболевания. Поэтому наиболее распространенной является гипотеза о мультифакториальной природе РС [4]. Участие генетических факторов в формировании предрасположенности к развитию РС не вызывает сомнения [12].
Среди наследственных факторов, повышающих риск развития РС, следует отметить в первую очередь гены главного комплекса гистосовместимости (HLA), гены цитокинов, иммуноглобулинов, белков миелина и ряд других, белковые продукты которых принимают участие в белковой регуляции [1, 3, 7]. Во многих исследованиях показано, что единственным локусом, устойчиво связанным с PC, является участок на хромосоме 6. Он содержит гаплотип DRB1*1501-DQAl*0102-DQB1*0602 HLA класса II, который получил название DR2 или Dw2 гаплотип, и в том числе гены фактора некроза опухолей и лимфотоксина [8, 19, 24]. Ряд авторов объясняют более высокую заболеваемость PC среди женщин именно большей частотой экспрессии локуса DR2 гена HLA класса II [20]. M. Niino и соавт. подчеркивают, что HLA — единственная достоверно подтвержденная область, в которой присутствуют гены, определяющие восприимчивость к PC [26]. О. Fernandez и соавт. [21] выявили ассоциацию DR2 гаплотипа с PC, особенно аллель DQB1*0602 у жителей южной Испании. Гаплотип DR2 не связан с клиническими и демографическими особенностями PC в данной популяции. Н. Schmidt и соавт. провели анализ многочисленных исследований, посвященных взаимосвязи между риском
развития PC и наличием гаплотипа HLA DR15. Большинство исследователей сообщают о более высокой частоте гаплотипа DR15 или составляющих его аллелей среди случаев PC, чем в контрольных группах, однако это требует дальнейшего изучения [28].
Самым большим достижением в диагностике PC стала магнитно-резонансная томография (МРТ). Характерными изменениями, выявляемыми на МРТ у больных PC, являются, во-первых, атрофические изменения головного мозга, выявляемые уже на ранних стадиях заболевания, а во-вторых — очаговые изменения в головном и спинном мозге [9, 17]. Наличие атрофии головного мозга, выявляемое на МРТ даже с помощью простых линейных методов измерения, является важным маркером прогрессирования PC и, вероятно, отражает деструктивные и необратимые патологические процессы, происходящие в головном мозге, обусловленные заболеванием [30]. Высокая информативность и чувствительность МРТ для выявления атрофии головного мозга и очагов демиелинизации при PC была доказана в многочисленных исследованиях [2, 11, 13, 15, 23, 27].
Расширение желудочковой системы головного мозга коcвенно отражает степень атрофии мозга при PC. В исследовании H. Butzkueven и соавт. [17] использовались три параметра для выявления степени атрофии мозга: межъядерный показатель (МП), ширина третьего желудочка и ширина передних рогов боковых желудочков. Доказано, что МП коррелирует со степенью атрофии головного мозга и данная методика может использоваться для контроля прогрессирования PC и степени выраженности атрофии мозга при данном заболевании.
С. Саоn и соавт. [18] предлагают использовать МП как простой линейный метод, не требующий применения
© А.Н. Бойко, С.А. Сиверцева, 2010 |
e-mail: boykoa13@gmail.com |
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:1:84
84 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ГЕНЕТИКА РС
сложного программного обеспечения и не зависящий от способа получения томографического изображения, для определения степени атрофии головного мозга у больных с PC. Показано, что МП коррелирует со степенью инвалидизации и продолжительностью заболевания. L. Fisniku
исоавт. [22] в ходе 20-летних исследований установлено, что на МРТ в Т2-режиме у больных PC уже в начальной стадии заболевания появляются признаки поражения головного мозга, которые являются прогностическими для определенного типа течения PC. Объем поражения головного мозга в первые годы заболевания коррелирует со степенью инвалидизации по шкале EDSS в дальнейшем. Однако данные МРТ слабо коррелируют с клиникой: распространенность очагов не отражает степени инвалидизации, а частота появления новых очагов при МРТ не совпадает с частотой обострений — новые очаги в мозге возникают значительно чаще, чем клинические обострения [9].
Висследованиях R. Zivadinov и соавт. [32] проанализированы связи между изменениями, выявленными на МРТ головного мозга у больных с РС при наличии у них аллелей HLA2DRB1*1501, DQB1*0301, DQB1*0302, DQB1*0602, и DQB1*0603. Показано, что при наличии этих аллелей изменения на МРТ головного мозга были более выраженными. В своей работе К. Schreiber и соавт. [29] исследовали возможность корреляции между наличием трех аллелей — DRB1 *1501, CCR5 и аполипопротеина Е (АРОЕ) и клиническими проявлениями PC и изменениями, выявляемыми на МРТ. Не выявлено корреляции клинических проявлений у носителей DRB1*1501
иАРОЕ-е4 и общей площадью поражения мозга на MPT. Однако у пациентов с наличием аллели CСR5D32 отмечена незначительная тенденция к меньшему объему поражения мозга на Т2-взвешенных изображениях. По данным T. Matsuoka и соавт. [25], выявлена связь изменений на МРТ у больных с PC азиатского происхождения при наличии у них аллеля HLA DRB1. J. Zwemmer и соавт. [33] не выявили корреляции между наличием гена АРОЕ и изменениями на МРТ у больных PC и в контрольной группе. В исследованиях R. Zivadinov и соавт. [31] анализировалась связь между наличием аллелей А, В, DRB1 и DQB1 у больных PC и изменениями на МРТ. Выявлено, что более высокий объем Т2-очагов был связан с наличием DRB1*04 и аллели В7; объем Т1-очагов был связан с В7 и DRB1*12, тогда как атрофические изменения мозга были связаны с наличием аллели DRB1*12. В исследованиях, проведенных в Италии по методу «случай—контроль», было доказано, что у лиц с наличием этих аллелей определена более высокая восприимчивость к PC. Выявлены отчетливые связи между наличием DRB1*1501, атрофией мозга и увеличением объема Т1-очагов; между наличием DQB1*0301, увеличением объема Т2-очагов и продолжительностью заболевания; между DQB1*0302, атрофией головного мозга и увеличением объема Т1- и Т2-очагов; между DQB1*0602
иатрофией мозга; между DQB1*0603, увеличением объема T1-очагов и степенью инвалидизации по шкале EDSS [32].
Цель исследования, проведенного в Тюменском регионе, — выявление взаимосвязи между наследственными факторами риска развития PC, клиническими особенностями заболевания и данными МРТ у больных с PC, проживающих на данной территории.
Материал и методы
МРТ головного мозга выполнена 200 больным с достоверным диагнозом PC, которые принимали участие в аналитическом эпидемиологическом исследовании по методу «случай—контроль» в Тюменском регионе. Группа больных с PC представлена 119 (59,5%) женщинами и 81 (40,5%) мужчиной. Средний возраст больных составил 36,49±9,86 года (от 18 до 61 года). Стаж заболевания колебался от 1 года до 37 лет. В анализируемой группе больных PC в 73% случаев течение заболевания носит ремиттирующий характер, 26% больных находятся в стадии вторичного прогрессирования и лишь у 1% больных имеется первично прогрессирующее течение PC. Возраст дебюта больных PC в среднем составил 27,4±9 лет. Ранний PC (дебют заболевания до 16 лет включительно) наблюдался в 19 случаях, поздний (дебют в возрасте 40 лет и старше)
— в 23. У 44 больных с PC с длительностью заболевания 10 лет и более, шкалой EDSS, не превышающей 3 баллов, наблюдался мягкий PC. У 6 пациентов наблюдалось злокачественное или быстропрогрессирующее течение PC.
МРТ головного мозга проводилась на аппарате Signa Contours «General Electric» (США) с напряженностью магнитного поля 0,5 Тл. Томограммы получали в аксиальной, сагиттальной и фронтальной проекциях с помощью импульсных последовательностей Т2 FSE с параметрами TR/TE 4300/90, Tl SE с параметрами TR/TE 500/11, fast FLAIR с параметрами TR/TE/TI 10 000/110/2000. Толщина среза 5 мм. Показатели MPT изучались в зависимости от вариантов течения PC (ремиттирующее, вторично прогрессирующее, первично прогрессирующее, мягкий PC, быстро прогрессирующий PC, типичный PC, ранний PC, поздний PC), возраста дебюта заболевания, индекса прогрессирования (ИП), длительности 1-й ремиссии, времени достижения 3 и 6 баллов по шкале EDSS.
Для оценки степени выраженности атрофии головного мозга применялся метод расчета МП, являющийся одним из наиболее простых и в то же время достоверных, линейных методов, применяемых для оценки атрофии головного мозга, в том числе при РС [16, 17]. Для анализа томограмм использовались данные в DICOM 3.0 формате. Для измерения прямолинейных дистанций применялись штатные программные средства графической станции «Adwantage Windows».
Для определения МП выбиралась томограмма, на которой наиболее четко были видны оба рога боковых желудочков мозга и оба хвостатых ядра, причем расстояние между краями ядер минимально (см. рисунок). Межъядерная дистанция определялась как расстояние между внутренними (медиальными) границами хвостатых ядер [17]. Следующим этапом на этом же изображении измерялась дистанция между наиболее удаленными границами мозга вдоль той же самой линии, по которой проводилось измерение межъядерной дистанции. МП рассчитывался как отношение межъядерной дистанции к дистанции между наиболее удаленными границами мозга, выраженное в процентах. Значение МП округлялось до одного знака после запятой.
Кроме атрофических изменений головного мозга, типичным МРТ признаком PC является наличие на Т2взвешенных изображениях гиперинтенсивных очагов, расположенных в белом веществе больших полушарий, мозжечка и ствола. На Т1-взвешенных изображениях оча-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
85 |
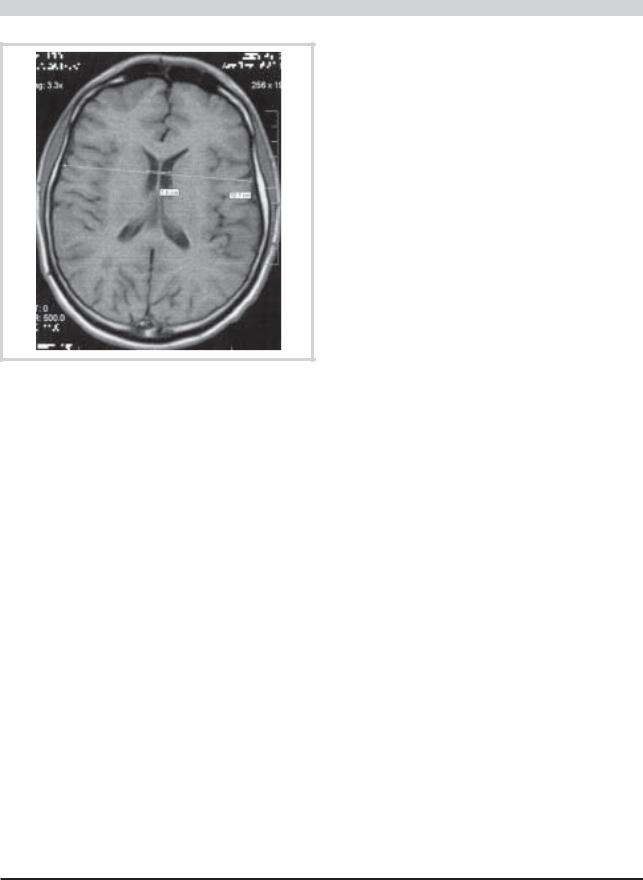
КРАТКИЕ СООБЩЕНИЯ
Определение межъядерного показателя.
ги гипоили изоинтенсивные. По мере увеличения давности заболевания количество очагов, как правило, нарастает, одновременно выявляются как свежие, так и старые очаги. Для определения степени выраженности демиелинизации используются различные варианты математического подсчета количества, объема, общей площади очагов с использованием постоянно развивающегося специализированного программного обеспечения.
Учитывая ограниченные технические возможности для анализа томограмм, а именно — отсутствие специализированного программного обеспечения для подсчета объема или площади очагов демиелинизации, в исследовании применялся простой метод подсчета количества очагов. Подсчет очагов проводился на аксиальных Т2взвешенных изображениях. Учитывая, что размер очагов демиелинизации в среднем составляет 5—8 мм, подсчет проводился на всех срезах последовательно и количество очагов суммировалось. Результаты подсчета количества очагов позволили разделить всех пациентов на 3 группы: больные, у которых количество очагов, выявленных на МРТ головного мозга, было 1) менее 9; от 9 до 15; 3) более 15.
Для уточнения роли наследственной предрасположенности применялось генотипирование генов HLA II класса — DR, DQA1, DQB1 — методом полимеразной цепной реакции у 166 больных с PC. Все больные, образцы ДНК которых использовали для генотипирования, в своих эпидемиологических анкетах сообщили, что оба родителя у них были русскими.
Статистический анализ полученных результатов проводился с использованием статистической программы SPSS for Windows 11.5. Для сравнения связанных групп по количественным и качественным признакам использовался непараметрический метод — тест Вилкоксона. Для сравнения независимых групп по количественным признакам применялся тест Манна—Уитни. Результаты представлены как М±SD.
Соответствие распределения генотипов равновесию Харди—Вайнберга и сравнения частот аллелей в исследуемых группах анализировали с помощью критерия χ2 с поправкой Йетса на непрерывность. Использовали двусторонний точный тест Фишера в случае, если ожидаемое значение хотя бы в одной ячейке таблицы сопряженности было меньше 5. Для множественного сравнения межпопуляционных различий применяли поправку Бонферрони. Для всех видов статистического анализа различия считались достоверными при достигнутом уровне значимости р<0,05.
Результаты
Проводилось сравнение различных вариантов течения PC и значений МП у больных, принимавших участие в аналитическом эпидемиологическом исследовании. Выявлены различия в значениях МП у больных PC с мягким (44 человек, МП 13,1±2,6) и быстропрогрессирующим вариантами течения PC (6 человек, МП 15,5±2,1). Большее значение МП у больных PC с быстро прогрессирующим вариантом течения (р=0,03) свидетельствует о более выраженной степени атрофии головного мозга в сравнении с мягким вариантом течения PC. Также определены различия в значениях МП у больных PC с ремиттирующим (146 человек, МП 12,5±2,9) и вторично рогрессирующим (52 человека, МП 14,5±2,9) типами течения PC (р=0,0001). У больных с вторично прогрессирующим типом течения значение МП выше, чем с ремиттирующим, что свидетельствует о более выраженной степени атрофии головного мозга.
Проводился анализ зависимости варианта течения PC от степени выраженности демиелинизации (количество очагов демиелинизации) в головном мозге (табл. 1).
Выявлены различия в исследуемых группах при типичном и позднем вариантах течения PC (р=0,04). В группе больных PC с количеством очагов демиелинизации более 15 и типичным течением PC доля пациентов существенно выше в сравнении с поздним и ранним началом PC (p=0,01).
Проводился анализ клинических характеристик PC в зависимости от степени выраженности демиелинизации (количество очагов демиелинизации) в головном мозге (табл. 2).
В группе больных c PC с количеством очагов демиелинизации в головном мозге до 9 возраст начала заболева-
Таблица 1. Распределение больных с различными вариантами течения PC в зависимости от количества очагов демиелинизации, выявленных при МРТ головного мозга
Количество очагов |
Типичный РС |
Поздний РС |
Ранний РС |
р |
||||
демиелинизации |
абс. |
% |
абс. |
% |
абс. |
% |
||
|
||||||||
До 9 |
14 |
63,6 |
8 |
36,4 |
— |
— |
0,04 |
|
9—15 |
39 |
92,9 |
3 |
7,1 |
— |
— |
0,04 |
|
Более 15 |
105 |
77,2 |
12 |
8,8 |
19 |
14,0 |
0,04 |
|
86 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ГЕНЕТИКА РС
Таблица 2. Некоторые клинические характеристики больных c PC в зависимости от количества очагов демиелинизации, выявленных при МРТ головного мозга
Количество очагов |
Возраст |
ИП |
Длительность |
Достижение 3 баллов |
Достижение |
|
демиелинизации |
дебюта, годы |
1-й ремиссии, мес |
по EDSS, мес |
6 баллов по EDSS, мес |
||
|
||||||
До 9 |
35,1±9,7* |
0,4±0,4 |
15,5±20,3** |
70±50 |
120±18,8 |
|
9—15 |
28,8±7,8 |
0,3±0,2 |
31,8±42,3 |
86,8±81,2 |
85,5±70,7 |
|
Более 15 |
25,7±8,5 |
0,4±0,3 |
30,9±33,5** |
95,7±79,2 |
106,4±64,4 |
Примечание. Достоверность различий между группами: * — р=0,0001; ** — p=0,02.
Таблица 3. Сравнение групп больных с наследственными факторами риска PC в зависимости от количества очагов демиелинизации на МРТ головного мозга
|
|
|
Наличие признака |
|
|
|
|
Отсутствие признака |
|
|
||
Показатели |
<9 очагов |
9—15 очагов |
>15 очагов |
<9 очагов |
9—15 очагов |
>15 очагов |
||||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
DR2(15) |
9 |
40,9 |
9 |
21,4 |
36 |
26,5 |
45 |
25,3 |
45 |
28,5 |
18 |
28,1 |
DR3 |
3 |
13,6* |
4 |
9,5 |
19 |
14 |
23 |
12,9* |
22 |
13,9 |
7 |
10,9 |
DR4 |
2 |
9,1* |
11 |
26,2 |
40 |
29,4 |
51 |
28,7* |
42 |
26,6 |
13 |
20,3 |
DR8 |
1 |
4,5 |
4 |
9,5 |
12 |
8,8 |
16 |
9 |
13 |
8,2 |
5 |
7,8 |
DQA1*0102 |
11 |
50 |
12 |
28,6 |
53 |
39 |
65 |
36,5 |
64 |
40,5 |
23 |
35,9 |
DQA1*0103 |
2 |
9,1 |
4 |
9,5 |
9 |
6,6 |
13 |
7,3 |
11 |
7 |
6 |
9,4 |
DQD1*0301 |
2 |
9,1 |
5 |
11,9 |
23 |
16,9 |
28 |
15,7 |
25 |
15,8 |
7 |
10,9 |
DQB1*0303 |
33 |
18,5 |
8 |
19 |
25 |
18,4 |
2 |
9,1 |
27 |
17,1 |
10 |
15,6 |
Примечание. * — р=0,05.
ния старше (р=0,0001) в сравнении с группой пациентов с |
ним PC находятся в группе с количеством Т2-очагов в го- |
количеством очагов демиелинизации более 15. |
ловном мозге более 15 (р=0,002). В группе больных PC с |
Длительность 1-й ремиссии была более продолжи- |
количеством Т2-очагов более 15, возраст начала заболева- |
тельной у больных с PC в группе с количеством очагов де- |
ния в сравнении с группами пациентов с количеством Т2- |
миелинизации в головном мозге более 15 (р=0,02), а более |
очагов в головном мозге до 9 и от 9 до 15 моложе (р=0,0001). |
короткая 1-я ремиссия наблюдалась у больных в группе с |
В группе больных PC с количеством Т2-очагов в головном |
количеством очагов демиелинизации до 9. Других стати- |
мозге более 15 наблюдалась более продолжительная дли- |
стически значимых различий не выявлено. |
тельность 1-й ремиссии в сравнении с группами пациен- |
Проводилось сравнение вариантов течения PC в за- |
тов PC с количеством Т2-очагов до 9 и от 9 до 15 (р=0,04). |
висимости от количества очагов демиелинизации в голов- |
Проведен анализ значения МП у больных PC с на- |
ном мозге. При сравнении группы больных с PC с количе- |
следственными факторами риска PC в тюменской попу- |
ством очагов до 9 c группой пациентов с количеством оча- |
ляции. Не выявлено статистически значимых различий |
гов от 9 до 15 и более 15 выявлено, что доля больных с |
между значением МП у больных с наследственными фак- |
мягким вариантом течения PC меньше в группах с коли- |
торами риска PC. |
чеством очагов от 9 до 15 и более 15 (р=0,04). |
Проводилось сравнение групп больных с наслед- |
Доля больных с поздним PC в группе до 9 очагов боль- |
ственными факторами риска PC в зависимости от количе- |
ше, чем доля пациентов с таким же вариантом течения PC |
ства очагов демиелинизации на МРТ головного мозга |
в сопоставляемой группе (р=0,0001). В то же время доля |
(табл. 3). |
больных с типичным PC в группе до 9 очагов меньше, чем |
Согласно полученным результатам, в группе больных |
в сопоставляемой группе пациентов с типичным PC с ко- |
с PC с наличием локуса DR4 преобладает доля пациентов |
личеством очагов демиелинизации от 9 до 15 более 15 |
с количеством очагов демиелинизации от 9 до 15 и более |
(р=0,02). |
15 (p=0,05). |
Возраст дебюта PC у пациентов в группе до 9 очагов |
Таким образом, в результате проведенного исследова- |
старше, чем в группах больных PC с количеством очагов |
ния выявлены различия в степени выраженности атрофии |
демиелинизации от 9 до 15 и более 15 (р=0,0001). |
головного мозга по значению МП на МРТ у больных с мяг- |
Длительность 1-й ремиссии у больных PC значитель- |
ким и быстро прогрессирующим вариантами течения РС, а |
но короче в группе до 9 очагов в сравнении с группой па- |
также с ремиттирующим и вторично прогрессирующим ти- |
циентов PC с количеством очагов от 9 до 15 и более 15 |
пами течения PC. Установлена взаимосвязь количества |
(р=0,04). |
очагов демиелинизации с возрастом дебюта PC и продол- |
При сравнении группы больных PC с количеством |
жительностью 1-й ремиссии. Установлена взаимосвязь |
Т2-очагов более 15 с группой пациентов с количеством |
между количеством очагов демиелинизации на МРТ голов- |
очагов до 9 и от 9 до 15 выявлено, что все больные с ран- |
ного мозга и наличием локуса DR4 у больных PC. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
87 |

КРАТКИЕ СООБЩЕНИЯ
ЛИТЕРАТУРА
1.Алексеенков А.Д., Судомоина М.А., Бойко А.Н. др. Анализ двух участков биаллельного полиморфизма в локусе фактора некроза опухолей у больных рассеянным склерозом из русской популяции: связь с ПДРФ Ncol в первом интронегена лимфотоксина. Молекуляр. биология 1999; 33: 190—196.
2.Ахадов Т.А., Панов В.О., Кравцов А.К. Магнитно-резонансная томография при спинальной форме рассеянного склероза. Всероссийский съезд неврологов, 7-й: Материалы. Н. Новгород 1995; 89—90.
3.Бойко А.Н., Гуерини Ф., Ферранте П. и др. Связь риска развития рассеянного склероза с сочетанием аллелей генов основного белка миелина и генов главного комплекса гистосовместимости. В кн.: Вопросы диагностики и лечения демиелинизирующих заболеваний нервной системы. Ступино 1999; 104—106.
4.Бойко А.Н., Смирнова Н.Ф. и др. Эпидемиология и этиология рассеянного склероза. Журн консилиум медикум 2008; 10: 7: 5.
5.Бойко А.Н., Фаворова О.О., Судомоина М.А. и др. Иммуногенетика рассеянного склероза. В кн.: Вопросы диагностики и лечения демиелинизирующих заболеваний нервной системы. Ступино 1999; 4—10.
6.Гусев Е.И., Бойко А.Н. Рассеянный склероз: от изучения иммунопатогенеза к новым методам лечения. М: Губернская медицина 2001; 5.
7.Гусев Е.И., Бойко А.Н., Судомоина М.А., Фаворова О.О. Комплексное исследование клинической генетики рассеянного склероза. Всероссийский съезд неврологов, 8-й: Материалы. Казань 2001; 65.
8.Гусев Е.И., Демина ТЛ., Бойко А.Н. М: Нефть и газ 1997; 463.
9.Корниенко В.Н., Пронин И.Н. Диагностическая нейрорадиология. М: 2006; 1087—1124.
10.Малкова Н.А., Иерусалимский А.П. Рассеянный склероз (современные тенденции эпидемиологии и клиники, проблемы жизни с ним и лечение). Новосибирск 2006; 197.
11.Пронин И.Н., Беляева И.А., Бойко А.Н. и др. Диагностические и прогностические возможности магнитно-резонансной томографии при рассеянном склерозе. Журн неврол и психиат 2003; Спец выпуск: 18—24.
12.Рассеянный склероз. Диагностика, лечение, специалисты. Под ред. И.Д. Столярова, А.Н. Бойко. Ст-Петербург: Элби 2008; 21.
13.Тодуа Ф.И., Окуджава М.В., Лачкепиани А.Н. Основные различия МР-картины при первично и вторично хронически прогрессирующих формах рассеянного склероза. Неврол журн 1999; 2: 26—29.
14.Томпсон А.Д., Полман К., Холфельд Р. Рассеянный склероз: клинические аспекты и спорные вопросы. Ст-Петербург 2001; 421.
15.Тотолян Н.А., Трофимова Т.Н., Скоромец А.А. и др. Возможности методов магнитно-резонансной визуализации в диагностике рассеянного склероза. Журн неврол и психиат 2002; Спец выпуск: 32—41.
16.Bermel R.A., Bakshi R., Tjoa C. et al. Bicaudate Ratio as a Magnetic Resonance Imaging Marker of Brain Atrophy in Multiple Sclerosis. Arch Neurol 2002; 59: 275—280.
17.Butzkueven H., Kolbe S.C., Jolley D.J. et al. Validation of linear cerebral atrophy markers in multiple sclerosis. J Clin Neurosci 2008; 15: 130—137.
18.Caon С., Zvartau-Hind M., Ching W. et al. Intercaudate nucleus ratio as a linear measure of brain atrophy in multiple sclerosis. Neurolgy 2003; 60: 323—325.
19.Compston D.A.S., Kellar Wood H., Robertson N. Genes and susceptibility to multiple sclerosis. Acta Neurologica Scandinavica 1995; 161: 43—51.
20.Duquette P., Pleines I., Girard M. The increased susceptibility of women to multiple sclerosis. Neurology 1992;19: 466—471.
21.Fernández O., Fernández V., Alonso A. et al. DQB1*0602 allele shows a strong association with multiple sclerosis in patients in Malaga, Spain. J Neurol 2004; 251: 440—444.
22.Fisniku L.K., Brex P.A., Altmann D.R. et al. Disability and T2 MRI lesions: a 20-year follow-up of patients with relapse onset of multiple sclerosis. Brain 2008; 131: 808—817.
23.Hein J., Castelijns J., Barkhof F. Magnetization transfer imaging in MS. Int MS J 1996; 3: 47—57.
24.Hillert J. Human leukocyte antigen studies in multiple sclerosis. Annual Neurol 1994; 36: 15—17.
25.Matsuoka T., Matsushita T., Osoegawa M. et al. Association of the HLADRB1 alleles with characteristic MRI features of Asian multiple sclerosis. Mult Scler 2008; 14: 1181—1190.
26.Niino M., Fukazawa T., Kikuchi S., Sasaki H. Recent advances in genetic analysis of multiple sclerosis: genetic associations and therapeutic implications. Expert Rev Neurother 2007; 7: 1175—1188.
27.Paty D.W., Moore G.R.Magnetic resonance imaging changes as living patology in multiple sclerosis. Multiple Sclerosis. Eds. D. Paty, G. Ebers. F.A. Davis Company, Philadelphia 1998; 328—369.
28.Schmidt H., Williamson D., Ashley-Koch A. HLA-DR15 Haplotype and Multiple Sclerosis: a HuGE Review. Am J Epidemiol 2007; 165: 1097— 1109.
29.Schreiber K., Otura A.B., Ryder L.P. et al. Disease severity in Danish multiple sclerosis patients evaluated by MRI and three genetic markers (HLADRB1*1501, CCR5 deletion mutation, apolipoprotein E). Mult Scler 2002; 8: 295—298.
30.Simon J.H., Jacobs L.D., Campion M.K. et al. A longitudinal study of brain atrophy in relapsing multiple sclerosis. The Multiple Sclerosis Collaborative Research Group (MSCRG). Neurology 1999; 53: 139—148.
31.Zivadinov R., Uxa L., Zacchi T. et al. HLA genotypes and disease severity assessed by magnetic resonance imaging findings in patients with multiple sclerosis. J Neurol 2003; 250:1099—1096.
32.Zivadinov R., Uxa L., Bratina A. et al. HLA-DRB1*1501, -DQB1*0301, -DQB1*0302, -DQB1*0602, and -DQB1*0603 alleles are associated with more severe disease outcome on MRI in patients with multiple sclerosis. Int Rev Neurobiol 2007; 79: 521—535.
33.Zwemmer J.N., van Veen T., van Winsen L. et al. No major association of ApoE genotype with disease characteristics and MRI findings in multiple sclerosis. Mult Scler 2004;10: 272—277.
88 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
