
Журнал неврологии и психиатрии / 2010 / NEV_2010_01_049
.pdf
Дулоксетин в лечении хронической мигрени
К.м.н., с.н.с. А.Р. АРТЕМЕНКО1, д.м.н., в.н.с. А.Л. КУРЕНКОВ2, д.м.н., в.н.с. С.С. НИКИТИН3, д.м.н., проф. Е.Г. ФИЛАТОВА1
Duloxetine in the treatment of chronic migraine
A.R. ARTEMENKO, A.L. KURENKOV, S.S. NIKITIN, E.G. FILATOVA
1Московская медицинская академия им. И.М. Сеченова; 2Научный центр здоровья детей РАМН; 3НИИ общей патологии и
патофизиологии РАМН, Москва
В исследование вошли 46 пациентов с хронической мигренью. Клиническое исследование было дополнено нейрофизиологическим, которое включало исследование мигательного рефлекса с оценкой RIII-компонента и ноцицептивного флекcорного рефлекса. Дулоксетин назначался в дозе 60 мг в сутки 3-месячным курсом. Достоверная (р<0,001) положительная динамика клинических показателей на фоне лечения дулоксетином отмечена к 3 месяцу лечения: среднее количество дней с головной болью (ГБ) в месяц уменьшилось с 25,8±5,3 до 10,5±3,9; частота приступов мигрени снизилась с 11,3±3,8 до 6,8±2,5 в месяц; количество дней приема препаратов для купирования ГБ уменьшилось с 25,1±4,9 до 7,5±3,9 в месяц; снизилось количество таблеток, принимаемых для купирования ГБ — с 46,6±14,7 до 8,5±10,6 в месяц. Количество респондеров (снижение количества дней с ГБ в месяц на 50% и более) составило 50%. Прием дулоксетина приводил к достоверному (р<0,01) повышению и субъективного порога боли, и порога ноцицептивного флексорного рефлекса, а также к нормализации порога и восстановлению габитуации RIII-компонента мигательного рефлекса, что являлось подтверждением повышения активности норадренергической и серотонинергической антиноцицептивных систем мозга.
Ключевые слова: хроническая мигрень, хроническая ежедневная головная боль, дулоксетин, мигательный рефлекс, ноцицептивный флексорный рефлекс, антиноцицептивные системы, центральная сенситизация.
The aim of the study was to investigate the influence of duloxetine on clinical parameters and antinociceptive mechanisms in 46 patients with chronic migraine (CM). In addition to a clinical examination, we performed a neurophysiological investigation which included blink reflex (BR) and nociceptive flexion reflex (NFR) tests. From the beginning of the treatment with duloxetine (60 mg/d) to the third month of treatment, the number of days with headache decreased from 25,8±5,3 to 10,5±3,9 (p<0,001); the frequency of migraine attacks/month decreased from 11,3±3,8 to 6,8±2,5 (p<0,001); the amount of analgesic tablets used per month decreased from 46,6±14,7 to 8,5±10,6 (p<0,001). The reduction of the number of days with headache by more than
50% and more than 30% was noted in 50% and 57,5% of patients, respectively. The treatment with duloxetine resulted in the significant increase of the pain and NFR thresholds as well as in the normalization of the RIII threshold and its habituation in BR. These results confirmed the role of duloxetine in increasing of the noradrenergic and serotonergic activity of brain antinociceptive systems in patients with CM. The clinical effectiveness of duloxetine can be explained by its multilevel modulatory influence on the pathogenetic mechanisms of CM including the activity of antinociceptive systems of the brainstem and of brain nociceptive systems through the decrease of central sensitization.
Key words: chronic migraine, chronic daily headache, duloxetine, blink reflex, nociceptive flexion reflex, antinoceptive systems, central sensitization.
Понятие хронической головной боли (ГБ) по- |
ляются ГБ, частота которых составляет 15 и более дней в |
|
прежнему остается одним из самых дискуссионных раз- |
месяц на протяжении не менее 3 мес [26]. Таким образом, |
|
делов в Международной классификации головных болей |
ХЕГБ является объединяющим признаком, а не диагно- |
|
(МКГБ). Термин «хроническая мигрень» (ХМ) впервые |
стической категорией [7]. Это объясняет, почему ХЕГБ не |
|
предложен в МКГБ II в 2004 г. [13], первоначальные кри- |
представлена в МКГБ II отдельной позицией, но при этом |
|
терии ХМ были пересмотрены в 2006 г. [14]. Сегодня ни |
удобное и ставшее незаменимым понятие продолжает |
|
одно исследование, посвященное XM, сделанное без уче- |
широко использоваться в литературе. Выделяют первич- |
|
та пересмотренных в 2006 г. критериев, не принимается к |
ные и вторичные формы ХЕГБ [27]. |
|
рассмотрению. |
Первичные ХЕГБ не связаны со структурными изме- |
|
Понимание того, чем является ХМ невозможно без |
нениями в головном мозге или системными заболевания- |
|
краткого обсуждения хронических ежедневных головных |
ми. В зависимости от длительности приступа ГБ первич- |
|
болей (ХЕГБ). Этот термин объединяет гетерогенную |
ные ХЕГБ подразделяются на короткие (эпизод ГБ длится |
|
группу заболеваний, основным проявлением которых яв- |
менее 4 ч) и длительные (ГБ длится более 4 ч). В соответ- |
|
|
|
|
© Коллектив авторов, 2010 |
1e-mail: aartemenko@gmail.com; eg-filatova@mail.ru |
|
Zh Nevrol Psikhiatr Im SS Korsakova 2010;110:1:49 |
2e-mail: alkurenkov@gmail.com |
|
3e-mail: nikitin-s@bk.ru |
||
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
49 |

ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
ствии с этой классификацией ХМ относится к первичным длительным ХЕГБ. В соответствии с МКГБ II, ХМ относится к осложнениям мигрени.
По данным исследований, проведенных в США и Европе, ежедневные или почти ежедневные ГБ отмечаются у 4—5% людей в популяции [20, 23]. В республиках бывшего
СССР процент пациентов оказался выше и составил 16,9% для России [4], а в Грузии и Молдове — по 8% [16, 21].
Среди всех форм ХЕГБ ХМ является не самой часто встречающейся и составляет 25—55%, в то время как хроническая ГБ напряжения (ГБН) представлена в 47—70% случаев [18, 20, 23].
Вспециализированных клиниках пациенты с ХЕГБ составляют до 80% от всех обратившихся [7]. При этом ХМ составляет до 78% всех обращений с ХЕГБ, и только 15% — хроническая ГБН, около 7% — другие типы ХЕГБ.
Пациенты с ХМ характеризуются выраженной дезадаптацией, поскольку в 10% случаев имеют крайне тяжелые приступы ГБ, часто не реагируют на лечение и профилактическую терапию, имеют высокий риск злоупотребления (избыточного употребления) лекарственными препаратами для купирования приступов. Кроме ГБ для пациентов этой группы характерны коморбидные тревожные и депрессивные расстройства, часто также рефрактерные к лечению. Все перечисленные особенности ХМ значительно снижают качество жизни больных и представляют собой сложную медицинскую и социоэкономическую проблему.
В75% случаев у людей, страдающих мигренью, развивается центральная сенситизация (второго тригеминального нейрона), которая проявляется кожной аллодинией во время приступа [10]. Центральная сенситизация не только объясняет нарастание частоты приступов мигрени, но также может играть роль в прогрессировании самого заболевания. Предполагается, что повторные эпизоды центральной сенситизации могут быть связаны с нейрональным повреждением, развитием рефрактерности к профилактическому лечению и прогрессированием мигрени.
Основой лечения ХЕГБ являются отмена анальгетиков и других препаратов в случае злоупотребления, курсовое медикаментозное профилактическое лечение, а также использование нелекарственных методов [28].
Профилактическое лечение направлено на уменьшение частоты приступов, улучшение ответа на препараты, купирующие приступ, уменьшение вызванной приступом ГБ дезадаптации, улучшение качества жизни пациентов при минимальных побочных эффектах терапии [5].
Препаратами выбора при назначении профилактического лечения считаются антидепрессанты. Золотым стандартом для лечения ХЕГБ остается амитриптилин — представитель группы трициклических антидепрессантов.
Вдвойных слепых исследованиях доказана его высокая клиническая эффективность [6, 17, 25]. Однако применение амитриптилина часто ограничивается выраженными побочными эффектами, которые возникают при использовании рекомендуемых доз, таких как седация, повышение массы тела, кардиотоксичность и др. Исследования последних лет показали, что антидепрессанты из группы селективных ингибиторов обратного захвата серотонина (СИОЗС) также могут быть эффективны в лечении ХЕГБ. Их преимуществом являются минимальные побочные эффекты, но при этом они уступают амитриптилину по
обезболивающему действию [19, 24]. Бóльшая эффективность амитриптилина в сравнении с СИОЗС при ХЕГБ возможно связана с его влиянием на обратный захват как серотониа, так и норадреналинина.
Препараты из новой группы лекарств двойного действия имеют сходный с трициклическими антидепрессантами механизм действия (ингибиторы обратного захвата серотонина и норадреналина), отличаются от амитриптилина химической структурой и, что особенно важно, имеют значительно меньше побочных эффектов [9, 15]. Несмотря на относительно небольшое число исследований, посвященных препаратам этой группы, уже доказана их эффективность в лечении различных хронических болевых синдромов, в том числе ХЕГБ [1, 2, 11, 22].
Дулоксетин (симбалта) является новым представителем группы антидепрессантов, способных оказывать двойное действие, подобно трициклическим антидерессантам, влияя на ферментный насос обратного захвата серотонина и норадреналина из межсинаптической щели. Особенность механизма действия дулоксетина в том, что препарат имеет приблизительно одинаковый аффинитет (сродство) к связыванию транспортных субъединиц, осуществляющих обратный захват серотонина и норадреналина, обладая тем самым сбалансированным действием в отношении обоих моноаминов. Считается, что серотонин и норадреналин играют значительную роль как в модуляции настроения, так и в ощущении боли. Эффект в отношении блокады обратного захвата дофамина у дулоксетина незначительный [3]. Обезболивающий эффект дулоксетина связан с его влиянием на центральную сенситизацию, что было показано на модели ХМ и фибромиалгии [12, 29].
Целью настоящей работы было определение влияния дулоксетина на основные клинические характеристики ХМ и оценка его влияния на антиноцицептивные механизмы.
В соответствии с целью были сформулированы задачи исследования: оценить влияние дулоксетина на основные клинические проявления ХМ и выраженность основных коморбидных нарушений; оценить влияние дулоксетина на возбудимость тригеминальной системы у пациентов с ХМ по порогам регистрации отдельных компонентов мигательного рефлекса (МР); оценить влияние дулоксетина на активность антиноцицептивных систем у больных с ХМ при исследовании ноцицептивного флексорного рефлекса (НФР); определить влияние лечения дулоксетином на качество жизни больных с ХМ.
Материал и методы
Обследованы 46 амбулаторных пациентов с ХМ в возрасте от 26 до 60 лет (средний возраст 43,6±12,5 года). Диагноз ХМ соответствовал критериям хронической мигрени по МКГБ II [14]. Все пациенты были ранее обследованы с использованием инструментальных методов для исключения симптоматических форм ГБ. За 2 нед до начала исследования все пациенты прекратили прием любых психотропных препаратов.
Критериями исключения из исследования явились наличие других типов ГБ, текущего органического неврологического заболевания, эндогенного психического заболевания; дебют мигрени старше 50 лет; алкоголизм, наркомания и злоупотребление бензодиазепинами; при-
50 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ЛЕЧЕНИЕ МИГРЕНИ
ем бета-блокаторов, трициклических антидепрессантов, противоэпилептических препаратов, ингибиторов МАО, блокаторов кальциевых каналов, препаратов с большой дозой магния (600 мг в сутки) или рибофлавина (100 мг в сутки), кортикостероидов, местных анестетиков, препаратов ботулинического токсина типа А.
Применялись следующие методы исследования. Клинический метод включал сбор жалоб и анамне-
стических данных, общесоматическое и неврологическое исследование; ведение пациентами дневников самоконтроля ГБ с указанием длительности, интенсивности ГБ (оценка по 10-балльной визуальной аналоговой шкале — ВАШ), регистрацию приема купирующих приступ препаратов и наличия побочных эффектов дулоксетина. Также применялась субъективная оценка пациентами эффективности терапии: очень хорошо, хорошо, удовлетворительно, неудовлетворительно.
Также были использованы психометрические методы. Анкетное тестирование включало стандартный набор из анкет и опросников. По шкале Бека определялся уровень депрессии; по тесту Спилбергера, адаптированному Ю.Л. Ханиным, — личностная и реактивная тревожность. Также использовались шкала балльной оценки проявлений синдрома вегетативной дистонии (СВД) для выявления частоты и выраженности вегетативных нарушений, анкета субъективной оценки нарушений сна, комплексный болевой опросник (КБО). Для оценки выраженности степени дезадаптации пациентов применялся опросник оценки дезадаптации при мигрени (MIDAS).
Нейрофизиологические методы включали исследование НФР для количественной оценки порога боли и его динамики на фоне лечения и МР по порогам регистрации отдельных его компонентов.
Для исследования НФР проводилась электрическая стимуляция икроножного нерва в области латеральной лодыжки трендами длительностью 20 мс и частотой 300 Гц с произвольными интервалами не менее 10 с. Для регистрации ответов использовали стандартные накожные электроды, которые располагали на задней поверхности бедра в области проекции короткой головки двуглавой мышцы бедра. Стимуляцию начинали минимальными стимулами в 0,5—1,0 мА. Силу стимула постепенно увеличивали с шагом 0,5 мА. Пациента просили сообщить, когда стимул будет восприниматься как болевое воздействие. Эту величину стимула определяли как порог боли. Одновременно с подачей стимула регистрировали ответы с короткой головки двуглавой мышцы бедра. Величину стимула, при которой регистрировался четкий RIIIкомпонент НФР, считали порогом рефлекса. Затем рассчитывали коэффициент порог боли/порог рефлекса, который в норме имеет значения в пределах от 0,9 до 1,0.
Возбудимость тригеминальной системы у пациентов с ХМ оценивалась по порогу регистрации отдельных компонентов МР. Регистрацию RI-компонента связывают с активацией А-β-волокон n. supraorbitalis — ветви тройничного нерва. Регистрация RII-компонента обусловлена активацией нейронов ретикулярной формации ствола мозга. Появление RIII-компонента при регистрации МР связывают с активацией ноцицептивных (А-Δ) волокон n. supraorbitalis.
Активность тормозных антиноцицептивных систем ствола мозга оценивалась по наличию и степени габитуации амплитуды RIII-компонента МР.
Исследование МР проводили в положении пациента сидя в кресле с открытыми глазами. Регистрирующие электроды располагались: активный — на круговой мышце глаза в нижнелатеральной ее части, референтный — на спинке носа. Стимулирующие электроды располагались в области точки выхода n. supraorbitalis ипсилатерально регистрирующим электродам. Электрическая стимуляция производилась одиночными прямоугольными редкими стимулами (не чаще 1 в 30 с). Длительность стимула составляла 0,2 мс. Компоненты МР регистрировались на электромиографе с полосой пропускания 10—5000 Гц. Стимуляция начиналась с минимальных, подпороговых значений и постепенно увеличивалась до появления всех компонентов мигательного рефлекса. Порогом регистрации каждого компонента считали ту величину интенсивности стимула в мА, при которой регистрировался минимальный ответ.
Анализировались порог перцепции электрического стимула, пороги возникновения RI-, RII- и RIIIкомпонентов МР, а также наличие и степень габитуации амплитуды RIII-компонента.
Для исследования НФР и МР использовали стандартный электронейромиограф Keypoint Portable («Medtronic», Дания).
Статистический анализ полученных результатов проводился с помощью параметрических (парный t-критерий Стьюдента)инепараметрических(критерийУилкоксона— Манна—Уитни) методов.
Проведенное открытое исследование длилось 3 мес. Лечение дулоксетином (симбалтой) проводилось в виде монотерапии. Пациенты принимали препарат однократно в дозе 60 мг в сутки (1 капсула). Весь комплекс клиниконеврологических, анкетных исследований и нейрофизиологического тестирования проводился до применения препарата и после окончания курса дулоксетина. На 14-й, 30-й и 60-й дни лечения планировали дополнительные визиты пациента для клинической оценки переносимости препарата и контроля дневника головной боли.
Результаты
До лечения среднее число дней с ГБ составляло 25,8±5,3 в месяц; частота приступов мигрени в среднем 11,3±3,8 в месяц. У 76% пациентов исследованной группы применение препаратов для купирования ГБ достигало степени злоупотребления. В среднем за 25,1±4,9 дня в месяц пациенты принимали 46,6±14,7 таблеток.
Для пациентов с ХМ были характерны: наличие кожной аллодинии в приступе в зоне ГБ и кожной аллодинии в области головы и лица в межприступном периоде и при «фоновой» ГБ; «фоновая» ГБ, совпадающая по локализации с ГБ в приступе; неэффективность или низкая эффективность анальгетиков и триптанов, даже при условии адекватной дозы и своевременности приема (в первые 2 ч); появление тяжелых длительных приступов мигрени, малочувствительных к лечению препаратами для купирования приступа. Описанные клинические проявления связаны с развитием центральной сенситизации болевых нейронов 2-го порядка.
Также у пациентов с ХМ можно говорить о развитии центральной сенситизации болевых нейронов 3-го порядка (таламус). На это указывают следующие клинические симптомы: хронические боли экстракраниальной локали-
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
51 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
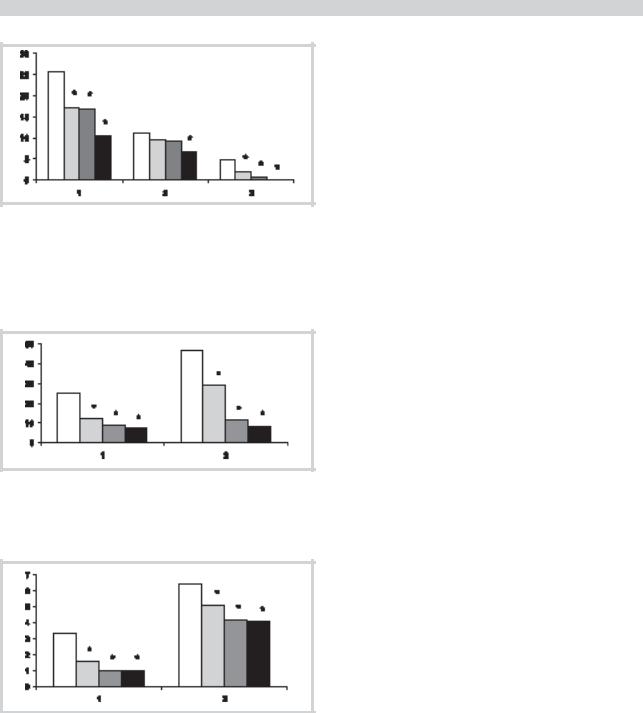
Рис. 1. Динамика основных клинических показателей на фоне лечения дулоксетином.
1 — динамика количества дней с ГБ в месяц; 2 — днамика частоты приступов мигрени в месяц; 3 — днамика частоты тяжелых приступов мигрени в месяц.
Здесь и на рис. 2 и 3 в каждой группе столбцов: первый — показатель до лечения; второй, третий, четвертый соответственно показатели в 1-й, 2-й, 3-й месяц лечения. * — p<0,01 — различия с показателями до лечения.
Рис. 2. Динамика приема препаратов для купирования ГБ на фоне лечения дулоксетином.
1 — динамика количества дней приема препаратов для купирования ГБ в месяц; 2 — динамика количества таблеток препаратов для купирования ГБ в месяц.
Рис. 3. Динамика интенсивности ГБ на фоне лечения дулоксетином.
1 — «фоновая» ГБ; 2 — интенсивность ГБ в приступе мигрени.
зации, высоко коморбидные ХМ (91,7% случая); кожная аллодиния за пределами головы и лица в приступе мигрени и длительно после него; кожная аллодиния за пределами головы/лица в межприступный период; «фоновая» головная боль, не совпадающая с ГБ в приступе по локализации, качественным характеристикам, интенсивности, сопутствующим симптомам, эффекту анальгетиков и триптанов.
Анкетное тестирование выявило умеренные и выраженные тревожные нарушения в 93,8% случаев (реактивная тревожность 41,2±8,8 балла и личностная тревожность 48,9±9,6 балла по тесту Спилбергера); вегетативные нару-
шения умеренной степени (58,5±7,4 балла по опроснику СВД), умеренные нарушения ночного сна (17,8±4,9 балла по анкете нарушений сна). Уровень депрессии по шкале Бека соответствовал легкой ее степени (10,8±3,7 балла).
Несмотря на тяжелые клинические проявления, пациенты имели умеренное снижение качества жизни (3,5±1,0 балла). Это подтвердилось данными КБО: сохранялся жизненный контроль при высокой поддержке значимого человека (4,3±1,6 и 4,8±1,1 балла соответственно) на фоне умеренного влияния боли на различные сферы жизни (2,4±1,1 балла) и степень эмоционального страдания (3,4±1,0 балла).
Анализ коморбидных расстройств и сопутствующих заболеваний показал, что тревога и хронические болевые синдромы встречаются более чем у 90% пациентов и, вероятно, могут считаться облигатными для ХМ.
На фоне лечения дулоксетином среднее количество дней с ГБ в месяц достоверно уменьшилось с 25,8±5,3 до лечения до 10,5±3,9 дня — в 3-й месяц лечения (p<0,001) (рис. 1). Снизилась частота приступов мигрени с 11,3±3,8 до лечения до 6,8±2,5 — в 3-й месяц лечения (p<0,001). Уменьшилось количество дней приема препаратов для купирования ГБ с 25,1±4,9 до лечения до 7,5±3,9 дня — в 3-й месяц лечения (p<0,001). Соответственно снижалось количество таблеток, принимаемых для купирования ГБ: с 46,6±14,7 до лечения до 8,5±10,6 таблетки — в 3-й месяц лечения (p<0,001) (рис. 2). Также снизилась интенсивность как «фоновой» ГБ (с 3,3±1,9 до 1,0±1,3 балла; p<0,001), так и ГБ в приступе (с 6,4±2,5 до 4,1±1,9 балла; p<0,01) (рис. 3).
Количество респондеров по критерию снижения количества дней с ГБ в месяц на 50% и более составило 50%; по менее жесткому критерию уменьшения количества дней с ГБ в месяц на 30% и более — 57,5%. Следует отметить, что достоверная динамика основных клинических показателей при лечении дулоксетином наблюдалась уже к концу 1-го месяца терапии.
Одновременно с регрессом «фоновой» ГБ на фоне лечения дулоксетином отмечалось исчезновение аллодинии в области головы, лица, шеи и рук, а также хронических болевых синдромов другой локализации. Отмеченные клинические проявления могут быть связаны со снижением центральной сенситизации болевых нейронов 2-го и, вероятно, 3-го порядка.
Положительная динамика основных болевых проявлений сочеталась с регрессом тревоги, депрессии, проявлений вегетативной дистонии, нарушений сна и улучшением показателей КБО (табл. 1). Как суммарное отражение положительных клинических показателей и выраженности коморбидных расстройств, отмечено достоверное улучшение показателя качества жизни в группе больных с ХМ.
По данным НФР, в группе больных исходно был достоверно снижен субъективный порог боли и, в меньшей степени, порог рефлекса по сравнению с показателями группы контроля (табл. 2). При этом соотношение порог боли/порог рефлекса также было снижено 0,83±0,15 (при норме 0,99±0,17). К концу курса лечения дулоксетином достоверно повышались как субъективный порог боли, так и порог НФР (см. табл. 2). Однако соотношение порог боли/порог рефлекса по-прежнему оставалось сниженным и достоверно не отличалось от исходного — 0,84±0,12. Увеличение порогов субъективной болевой чувствительности и НФР косвенно подтверждают повышение актив-
52 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |

ЛЕЧЕНИЕ МИГРЕНИ
Таблица 1. Динамика показателей анкетного |
тестирования |
|||
(в баллах) при лечении дулоксетином (n=46) |
|
|
||
|
|
|
||
Показатель, баллы |
До |
После |
|
|
лечения |
лечения |
|||
|
||||
Опросник Бека |
10,8±3,7 |
3,8±1,9** |
|
|
Опросник Спилбергера: |
|
|
|
|
реактивная тревожность |
41,2±8,8 |
35,4±8,0** |
|
|
личностная тревожность |
48,9±9,6 |
38,7±8,8* |
|
|
Опросник СВД |
58,5±7,4 |
26,5±6,7* |
|
|
Анкета нарушений сна |
17,8±4,9 |
21,1±6,3*** |
|
|
Анкета качества жизни |
3,5±1,0 |
2,4±0,8* |
|
|
КБО: |
|
|
|
|
интенсивность боли |
2,8±1,0 |
2,2±0,9*** |
|
|
интерференция боли |
2,4±1,1 |
2,0±1,0 |
|
|
поддержка близкого |
4,8±1,1 |
4,7±1,0 |
|
|
человека |
|
|
|
|
жизненный контроль |
4,3±1,6 |
4,6±1,5 |
|
|
степень эмоцион. страда- |
3,4±1,0 |
2,7±0,8** |
|
|
ния |
|
|
|
|
Примечание. * — p<0,001; ** — р<0,01; *** — p<0,05 — различия с показателями до лечения.
ности норадренергической и серотонинергической антиноцицептивных систем мозга.
Что касается МР, то различия между пациентами с ХМ и здоровыми испытуемыми касались только показателей RIII-компонента. Так, в группе с ХМ отмечался более низкий показатель величины порога RIII-компонента и была грубо нарушена габитуация RIII-компонента, у 31,2% пациентов с ХМ габитуация была выражена минимально или отсутствовала (табл. 3). На фоне лечения дулоксетином наряду с клиническим улучшением отмечалась нормализация порога RIII-компонента МР и восстановление габитуации RIII-компонента, что позволило предположить влияние дулоксетина на активность антиноцицептивных систем ствола головного мозга (см. табл. 3).
Дискриминационный анализ позволил выделить следующие предикторы эффективности дулоксетина у больных с ХМ: обязательное наличие выраженных коморбид-
ных расстройств — тревоги, депрессии, астении, нарушений сна, панических атак, хронических болевых синдромов другой локализации.
Также была проанализирована субъективная оценка пациентами эффективности 3-месячного лечения дулоксетином. У 57,9% пациентов отмечен хороший и у 40% пациентов удовлетворительный эффект терапии. Только 1 (2,1%) пациент оценил результат лечения как неудовлетворительный.
Побочные эффекты встречались у 70% пациентов, но были легкими и преходящими, не требовали дополнительной коррекции. Чаще всего встречались тошнота (35% пациентов), тревога (32,5%), повышение АД (25%) и дневная сонливость (12,5%), которые отмечались в течение первых 2 нед приема препарата.
Проведенное исследование эффективности и безопасности лечения дулоксетином показало его высокую эффективность в случаях ХМ. Отмечено достоверное улучшение по всем тестируемым клиническим параметрам, число респондеров составило 50%. Терапевтический эффект развивался медленно, только со 2-го месяца лечения. Наиболее дискомфортными для пациентов побочными эффектами были тошнота, тревога, повышение АД и дневная сонливость. Однако ни один из пациентов не прервал лечения из-за описанных нежелательных явлений. Все побочные явления приема дулоксетина были преходящими и быстро регрессировали после отмены препарата.
Прием дулоксетина приводил к достоверному повышению и субъективного порога боли, и порога НФР, а также к нормализации порога и восстановлению габитуации RIII-компонента МР, что явилось косвенным подтверждением повышения активности норадренергической и серотонинергической антиноцицептивных систем мозга — основного механизма антиболевого действия антидепрессанта двойного действия. Хотя дулоксетин не обладает непосредственным анальгетическим действием, курсовой прием препарата приводил не только к снижению количества дней с ГБ в месяц, но и к достоверному уменьшению ее интенсивности.
Таблица 2. Динамика НФР при лечении дулоксетином (n=46)
Показатель |
Контроль (n=30) |
До лечения |
После лечения |
Порог рефлекса (ПР), мА |
10,3±1,7^ |
8,2±1,7 |
9,7±1,5* |
Порог боли (ПБ), мА |
9,8±1,8^ |
6,8±2,8 |
8,2±2,6* |
Коэффициент (ПБ/ПР) |
0,99±0,17^ |
0,83±0,15 |
0,84±0,12 |
Примечание. ^ — р≤0,01 — различия между группами с ХМ и здоровых; * — p<0,01 — различия с показателями до лечения.
Таблица 3. Динамика показателей МР при лечении дулоксетином (n=46)
Показатель |
До лечения |
После лечения |
Порог перцепции, мА |
1,6 |
1,3 |
Порог RI-компонента, мА |
4,8 |
5,3 |
Порог RII-компонента, мА |
3,0 |
3,4 |
Порог RIII-компонента, мА |
8,8 |
9,9* |
Габитуация RIII-компонента, % пациентов: |
|
|
отсутствует |
3,1 |
0* |
<50% |
57,0 |
19,0* |
>50% |
28,7 |
25,0* |
полная |
11,2 |
56,0* |
Примечание. * — p<0,01 — различия с показателями до лечения.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
53 |
ЛЕЧЕНИЕ НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ |
|
Таким образом, применение дулоксетина в дозе 60 мг |
ла мозга, что выявлено при нейрофизиологическом тести- |
в сутки в течение 3 мес оказывает положительное влияние |
ровании; на активность ноцицептивных систем головного |
на основные клинические проявления ХМ и выражен- |
мозга (снижение центральной сенситизации болевых ней- |
ность коморбидных нарушений. Клиническая эффектив- |
ронов 2-го и, вероятно, 3-го порядка, что доказывается |
ность дулоксетина, вероятно, связана с многоуровневым |
регрессом «фоновой» ГБ и аллодинии в области головы, |
влиянием препарата на патогенетические механизмы ХМ: |
лица, шеи, рук, купированием хронических болевых син- |
на активность антиноцицептивных систем на уровне ство- |
дромов другой локализации). |
ЛИТЕРАТУРА
1.Амелин А.В., Тарасова С.В., Игнатов Ю.Д. и др. Применение антиде15. Horst W.D., Preskorn S.H. Mechanisms of action and clinical characteristics
прессантов с различным механизмом действия при хронической еже- |
of three atypical antidepressants: venlafaxine, nefazodone, bupropion. J Af- |
дневной головной боли. Журн неврол и психиат 2007; 107: 9: 38—44. |
fect Dis 1998; 51: 237—254. |
2.Артеменко А.Р., Куренков А.Л., Филатова Е.Г. Эффективность дулок16. Katsarava Z., Kukava M., Mirvelashvili E. et al. Prevalence of headache dis-
сетина при лечении хронической ежедневной головной боли. Журн |
orders in the Republic of Georgia: a population-based study. Cephalalgia |
неврол и психиат 2007; 107: 8: 24—28. |
2007; 27: 6: 699. |
3.Воробьева О.В. Симбалта — ключевой представитель класса антиде17. Krymchantowski A.V., Silva M.T., Barbosa J.S., Alves L.A. Amitriptyline ver-
прессантов двойного действия. Лечение нервных болезней 2005; 6: 2: |
sus amitriptyline combined with fluoxetine in the preventive treatment of |
33—37. |
transformed migraine: a double-blind study. Headache 2002; 42: 510—514. |
4.Куцемелов И.Б. Клинико-эпидемиологический анализ первичных го18. Lantéri-Minet M., Auray J.P., El Hasnaoui A. et al. Prevalence and descrip-
ловных болей взрослого городского населения: Автореф. дисс. ... |
tion of chronic daily headache in the general population in France. Pain |
канд. мед. наук. М 2005; 25. |
2003; 102: 1—2: 143—149. |
5.Осипова В.В., Табеева Г.Р. Хроническая мигрень: клиническая харак19. Lynch M.E. Antidepressants as analgesics: a review of randomized con-
теристика, принципы диагностики и терапии. Врач 2007; 5: 24—26. |
trolled trials. J Psychiat Neurosci 2001; 26: 1: 30—36. |
6.Ashiva S., Bendtsen L., Jensen R. Analgesic effect of amitriptyline in chron20. Midgette L.A., Scher A.I. The epidemiology of chronic daily headache. Curr
ic tension-type headache is not directly related to serotonin reuptake inhibition. Pain 2004; 108: 108—114.
7.Bigal M.E., Lipton R.B., Tepper S.J. et al. Primary chronic daily headache and its subtypes in adolescents and adults. Neurology 2004; 63: 5: 843— 847.
8.Bigal M.E., Lipton R.B. The differential diagnosis of chronic daily headaches: an algorithm-based approach. J Headache Pain 2007; 8: 5: 263— 272.
9.Briley M. Specific serotonin and noradrenalin reuptake inhibitors (SNRIs). A review of their pharmacology, clinical efficacy and tolerability. Human Psychopharmacol 1998; 13: 99—111.
10.Burstein R., Yarnitsky D., Goor-Aryeh I. et al. An association between migraine and cutaneous allodynia. Ann Neurol 2000; 47: 5: 614—624.
11.Colombo B., Annovazzi P.O.L., Comi G. Therapy of primary headache: the role of antiderassants. Neurol Sci 2004; 25: S171—S175.
12.de Tommaso M., Sardaro M., Vecchio E. et al. Central sensitisation phenomena in primary headaches: overview of a preventive therapeutic approach. CNS Neurol Dis Drug Targets 2008; 7: 6: 524—535.
13.Headache Classification Subcommittee, International Headache Society. The international classification of headache disorders, 2nd ed. Cephalalgia 2004; 24: Suppl 1: 1—160.
14.Olesen J., Bousser M.G., Diener H.C. et al. Headache Classification Committee. New appendix criteria open for a broader concept of chronic migraine. Cephalalgia 2006; 26: 6: 742—746.
Pain Headache Rep 2009; 13: 1: 59—63.
21.Moldovanu I., Pavlic G., Odobescu S. et al. The prevalence of headache disorders in the Republic of Moldova: a population-based study. Cephalalgia 2007; 27: 6: 673.
22.Ozyalcin S.N., Talu G.K., Kiziltan E. et al. The efficacy and safety of venlafaxine in the prophylaxis of migraine. Headache 2005; 45: 144—152.
23.Pascual J., Colás R., Castillo J. Epidemiology of chronic daily headache. Curr Pain Headache Rep 2001; 5: 6: 529—536.
24.Punay N.C., Couch J.R. Antidepressants in the treatment of migraine headache. Curr Pain Headache Rep 2003; 7: 51—54.
25.Redillas C., Solomon S. Prophylactic pharmacological treatment of chronic daily headache. Headache 2000; 40: 83—102.
26.Silberstein S.D., Lipton R.B., Solomon S., Mathew N.T. Classification of daily and near daily headaches: proposed revisions to the HIS classification. Headache 1994; 34: 1—7.
27.Silberstein S.D., Lipton R.B. Chronic daily headache including transformed migraine, chronic tension-type headache and medication overuse. In: Wolff’s headache and Other Head Pain. New York: Oxford University Press 2001; 247—282.
28.Silberstein S.D. Chronic daily headache. JAOA 2005; 105: Suppl 2: 23—29.
29.Volpe F.M. An 8-week, open-label trial of duloxetine for comorbid major depressive disorder and chronic headache. J Clin Psychiat 2008; 69: 9: 1449—1454.
54 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2010 |
