
Журнал неврологии и психиатрии / 2005 / NEV_2005_10_05
.pdf
МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
Сыворотка крови больных вторично-прогредиентным рассеянным склерозом изменяет электрическую активность нейрона
C.С. СЕРГЕЕВА, Э. ЗАПРЯНОВА, О.С. СОТНИКОВ, Д. ДЕЛЕВА, А.ФИЛЬЧЕВ, Б. СУЛТАНОВ, Т.В. КРАСНОВА
Blood serum of patients with secondary progressive multiple sclerosis changes neuron electric activity
S.S. SERGEEVA, E. ZAPRYANOVA, O.S. SOTNIKOV, D. DELEVA, A. FILCHEV, B. SULTANOV, T.V. KRASNOVA
Институт физиологии им. И.П. Павлова РАН, Санкт-Петербург; Институт экспериментальной морфологии и антропологии Болгарской АН; Ветеринарный институт ЛУ, София (Болгария)
Изучали действие 20% сыворотки крови больных двух групп — с наличием в ней антител к ганглиозидам GM1 и без таких антител. Показателем действия сыворотки было изменение фоновой и вызванной спайковой активности нейрона Ретциуса медицинской пиявки, не содержащего миелин. Установлено, что 40-минутная инкубация нейронов с сывороткой, содержащей антитела, вызывает изменение формы спайка, увеличение порога возбуждения клетки в среднем на 20%, уменьшение частоты спонтанной импульсной активности нейрона в среднем на 28%, уменьшение числа спайков в ответ на низкочастотное (0,5 Гц) синаптическое раздражение и торможение развития привыкания к высокочастотной (10 Гц) стимуляции. При использовании сыворотки без антител имели место иное изменение формы спайка, повышение порога возбуждения в среднем на 8% и урежение частоты фоновой импульсной активности нейрона в среднем на 40%. При синаптической активации нейрона с низкой частотой (0,5 Гц) происходило нарушение сенситизации и развивалось торможение электрического ответа на высокочастотное (10 Гц) раздражение. Полученные данные позволяют предположить, что повреждение нейронов при рассеянном склерозе может развиваться еще до морфологических проявлений поражения миелина.
Ключевые слова: антитела к ганглиозидам GM1, рассеянный склероз, сыворотка больных вторичнопрогредиентным рассеянным склерозом, импульсная активность нейрона.
An effect of 20% blood serum estimated by the changes of background and excited spike activity of Retzius’ neuron by Hirudo medicinalis, which does not contain myelin, has been studied in 2 groups of patients. The first group comprised patients with serum, containing antibodies to gangliosides, and the second one – patients without such antibodies. Incubation of Reitzius neurons in the serum with GM1-antibodies within 40 min resulted in the change of spike form, increase of cell stimulation threshold by average 20%, reduction of the frequency of spontaneous impulse activity by average 28%, decrease of the spikes number in response to the lower frequency (0.5 Hz) synaptic stimulation and inhibition of adaptation to the high frequency (10 Hz) stimulation. The use of the serum without GM1antibodies caused a different change of the spike form and increased the stimulation threshold by 8% and sparser background impulse activity of the neuron by 40%. During low frequency synaptic activation of the neuron (0.5%), there was sensitivity disturbance and inhibition of the electric response to the high frequency stimulation. The results suggest that neuron injuries in multiple sclerosis may develop before morphological appearances of myelin lesions.
Key words: antibodies to GM1-ganglioside, multiple sclerosis, blood serum, secondary progressive multiple sclerosis, neuron, impulse activity, Reizius’ neuron, Hirundo medicinalis, sensitization, adaptation.
Zh Nevrol Psikhiatr Im SS Korsakova 2005;105: 10: 30—34
При рассеянном склерозе в сыворотке крови боль- |
клеточные и субклеточные фракции мозга содержат |
|
ных увеличивается содержание ганглиозидов GM1 [27] |
ганглиозиды, однако бульшая их часть локализована |
|
и антител к ним [18, 25, 26]. Некоторые авторы рас- |
в нейронах. GM1 являются основными ганглиозида- |
|
сматривают эти антитела в качестве маркеров пато- |
ми нейронов мозга человека [23]. |
|
логического процесса при рассеянном склерозе [16]. |
В модельных экспериментах на отдельном нейро- |
|
Доля ганглиозидов (гликосфинголипидов) превышает |
не ранее нами было показано [5, 6], что антитела к |
|
10% от общего количества нервной ткани [13, 22]. Все |
общим ганглиозидам мозга, содержащиеся в сыво- |
|
|
|
ротке крови иммунизированных кроликов, вызыва- |
|
|
ют изменение формы спонтанного спайка, повыше- |
© Коллектив авторов, 2005 |
|
ние порога возбуждения нейрона, урежение фоно- |
30 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2005 |
РАССЕЯННЫЙ СКЛЕРОЗ
вой импульсной активности и увеличение латентного периода ответа на раздражающий стимул. Выявлено нарушение реакции нейрона на синаптическую активацию с низкой и высокой частотой. Под действием антител к ганглиозидам сыворотки крови кроликов изменяются функциональные характеристики натриевых каналов входящего тока [6]. Таким образом, было доказано, что антитела к ганглиозидам являются альтерирующими агентами нервных клеток.
Целью данной работы было исследование раннего влияния сыворотки крови больных вторично-про- гредиентным рассеянным склерозом, содержащей антитела к GM1 и не содержащей их, на фоновую и вызванную импульсную активность нейрона.
Материал и методы
Проведено три серии экспериментов. В первой серии изучали действие сыворотки крови практически здоровых доноров на частоту фоновой импульсной активности, форму и амплитуду спонтанного спайка, порог раздражения, латентный период ответа нейрона и влияние сыворотки на формирование электрической реакции нейрона на синаптическую активацию с частотами 0,5; 1; 3; 5; 7 и 10 Гц. Во второй серии оценивали действие на те же показатели электрической активности нейрона сыворотки больных рассеянным склерозом, содержащей антитела к GM1. В третьей серии исследовали влияние на те же показатели сыворотки больных рассеянным склерозом, не содержащей антител к GM1.
Антитела к ганглиозидам GM1 в сыворотке крови больных вторично-прогредиентным рассеянным склерозом определяли модифицированным методом энзимосвязанного иммуносорбентного способа ELISA [29]. Тестовым антигеном для определения титра служила гомогенная фракция ганглиозида GM1 (Sigma). Титр антител в сыворотке был равен 1:1200. Сыворотку получали у пациентов Специализированной больницы активного лечения неврологии и психиатрии (г. София) с достоверным диагнозом рассеянного склероза (по шкале Poser [15]). У всех пациентов установлен вторично-прогредиентный тип течения заболевания. Возраст больных составлял от 28 до 52 лет, длительность болезни — от 8 до 27 лет. В опытах использовали 20% сыворотку.
Изменение электрических свойств нейрональной мембраны под действием сыворотки больных изуча- ли на нейроне Ретциуса медицинской пиявки. Препарат представлял собой выделенную из тела пиявки брюшную нервную цепочку, второй ганглий которой закрепляли на дне камеры, заполненной физиологи- ческим раствором. Каудальную часть брюшной нервной цепочки приподнимали из раствора и помещали на раздражающие электроды. Нервную коннективу между четвертым и пятым ганглием раздражали толч- ками тока длительностью 0,3 мс, силой, превышающей два порога. Как было показано ранее [4], схема эксперимента позволяет апплицировать исследуемые агенты только на сому нейрона Ретциуса, оставляя интактными его синапсы.
Импульсную активность одного из нейронов Ретциуса регистрировали при помощи золотого экстра-
клеточного микроэлектрода в стеклянной изоляции. Вначале регистрировали электрические характеристики нейрона в растворе Рингера, затем в течение 40 мин инкубировали ганглий в растворе Рингера, содержащем 20% сыворотку. Далее раствор сыворотки путем перфузии замещали нормальным раствором Рингера и вновь регистрировали электрические характеристики нейрона и ответную реакцию нейрона на синаптическую активацию с частотой 0,5; 1; 3; 5; 7 и 10 Гц.
Результаты
До инкубации в сыворотке крови здоровых доноров нейрон генерирует одиночные спонтанные импульсы амплитудой 50±10 мВ, длительностью 6,0±1 мс (рис. 1, а). Латентный период ответа на тестирующий стимул равен 19±3 мс. После 40-минутной инкубации в сыворотке здоровых доноров амплитуда и длительность спайка, латентный период ответа на тестирующий стимул и порог возбуждения нейрона не изменяются. На низкие частоты раздражения нейрон отвечает реакцией сенситизации — на каждый раздражающий стимул он отвечает 5—6 спайками разной амплитуды и длительностью 6—7 мс (рис. 2, а). В ответ на средние частоты раздражения (3—5 Гц) нейрон генерирует один высокоамплитудный спайк амплитудой 62±4 мВ и длительностью 6,1±0,1 мс на каждый раздражающий стимул (рис. 2, б). Синаптическое раздражение нейронов с частотой 7—10 Гц приводит к развитию тормозной нейрофизиологической реакции — привыканию. Нейрон трансформирует частоту вызванной импульсной активности, генерируя низкоамплитудный (32±4 мВ) потенциал действия большой длительности (12±0,12 мс) не на каждый толчок раздражающего тока (рис. 2, в). Электрические показатели спонтанной активности нейронов и их ответы на частотное синаптическое раздражение после действия 20% сыворотки здоровых доноров не отлича- ются от показателей в растворе Рингера [3].
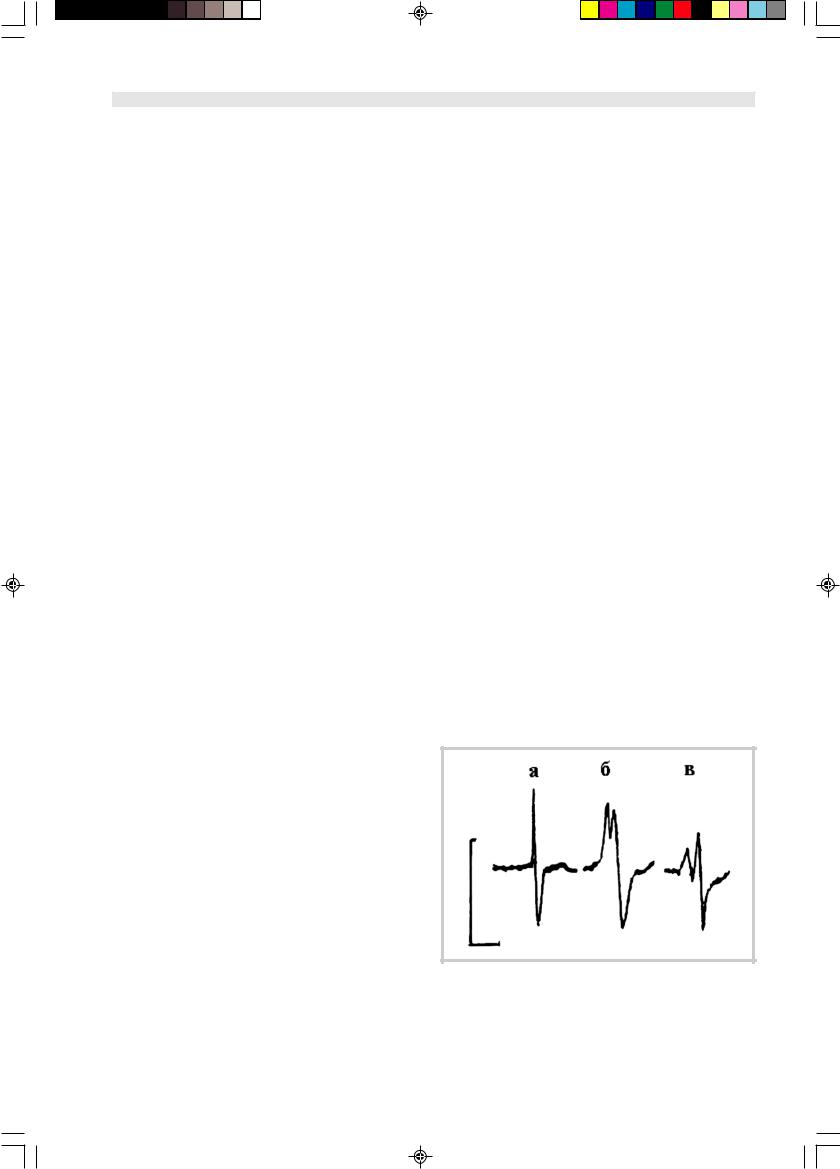
Рис. 1. Форма спонтанного спайка нейрона Ретциуса, инкубированного в сыворотке крови здорового донора (а), в сыворотке больного, содержащей антитела к GM1 (б), и в сыворотке больного без антител к GM1 (в).
Здесь и на рис. 2—5: калибровка — 50 мкВ, 10 мс.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2005 |
31 |
МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
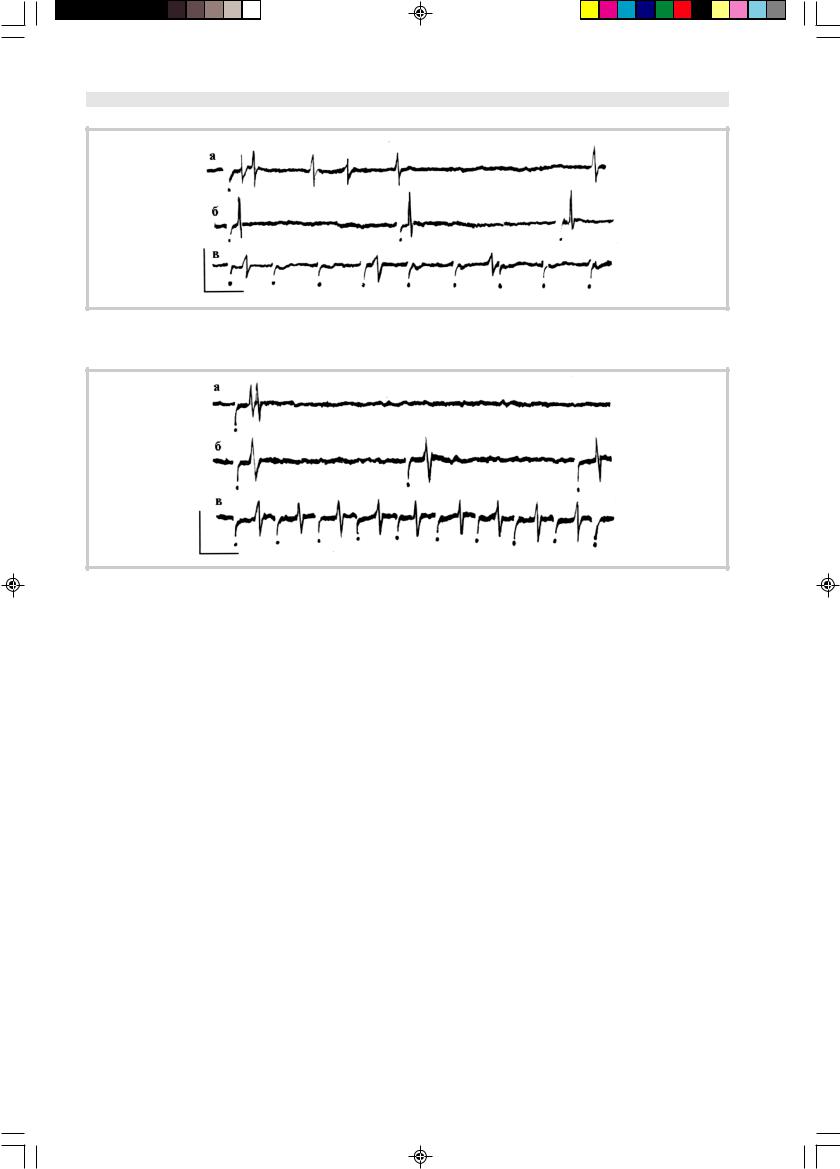
Рис. 2. Вызванная импульсная активность нейрона, инкубированного в сыворотке крови здорового донора.
Здесь и на рис. 3 и 4: а — при синаптической активации с частотой 0,5 Гц, б — с частотой 3 Гц, в — с частотой 10 Гц; точками обозначены артефакты.
Рис. 3. Вызванная импульсная активность нейрона, инкубированного в сыворотке крови, содержащей антитела к GM1.
После воздействия сыворотки крови больных, со- |
При инкубации нейронов Ретциуса в растворе |
держащей антитела к GM1 (вторая серия опытов), на- |
сыворотки крови больных без антител к GM1 порог |
блюдается увеличение порога возбуждения клетки на |
повышается на 8±3%, частота фоновой импульсной |
тестирующий стимул на 20±8% и уменьшение часто- |
активности клетки снижается на 40±6%. Наблюдает- |
ты спонтанной импульсной активности на 28±4%. Ла- |
ся изменение формы спонтанного спайка. Перед ос- |
тентный период ответа на раздражающий стимул уве- |
новным спайком появляется «предпотенциал» с ам- |
личивается с 20,3±1,4 до 31,4±4,1 мс. Изменяется форма |
плитудой 10,0±0,4 мВ и длительностью 8,0±0,1 мс (рис. |
спонтанного спайка. Вершина спайка раздваивается, его |
1, в). Амплитуда основного спайка уменьшается до |
длительность увеличивается с 6,2±0,4 до 11,4±0,2 мс |
36,3±2,1 мВ, его длительность увеличивается до |
(рис. 1, б), амплитуда первого компонента потенциала |
8,4±0,6 мс, латентный период ответа на раздражаю- |
действия снижается с 52,8±0,8 до 42,2±1,1 мВ. На си- |
щий стимул возрастает с 19,3±0,4 до 26,0±0,1 мс. |
наптическую активацию с частотой 0,5—1 Гц нейрон |
Нейрон при раздражении с частотой 0,5—1 Гц на |
Ретциуса отвечает только двумя одиночными спайка- |
каждый стимул генерирует четыре потенциала дейст- |
ми на каждый раздражающий стимул. Амплитуда спайка |
вия (рис. 4, а). При активации нейрона с частотой |
51±3 мВ, длительность 6,2±0,4 мс (рис. 3, а). Следова- |
3 Гц наблюдается реакция усвоения ритма (рис. 4, б). |
тельно, происходит торможение реакции сенситиза- |
При более высокой частоте активации (5—10 Гц) |
ции, наблюдаемой в контроле. При активации со сред- |
нейрон трансформирует частоту импульсной актив- |
ней частотой (3—5 Гц), как и в контроле, нейрон ге- |
ности, генерируя потенциалы действия с частотой |
нерирует один спайк на каждый толчок раздражаю- |
3—4 имп/с (рис. 4, в). Анализ формы спайка показыва- |
щего тока (рис. 3, б). При синаптической активации с |
ет, что вызванный ответ нейрона при всех частотах раз- |
частотой 7—10 Гц происходит нарушение процесса |
дражения всегда двойной (с «предпотенциалом»), |
привыкания. Нейрон генерирует высокоамплитудный |
т.е. его форма такая же, как до частотного раздражения. |
(42±8 мВ) спайк малой длительности (6±0,4 мс) на |
Соотношение частоты ответа нейрона и частоты |
каждый раздражающий стимул при частоте как 7 Гц, |
синаптического раздражения в контроле демонстри- |
так и 10 Гц (рис. 3, в). Кроме того, как видно на рис. 3, |
рует трансформацию ритма, соответствующую реак- |
вызванный ответ нейрона состоит всегда из одного |
ции привыкания (рис. 5, 1) [19]. Это соотношение во |
спайка независимо от частоты раздражения, тогда как |
второй серии опытов (действие сыворотки, содержа- |
фоновый спайк всегда двойной. |
щей антитела к GM1) свидетельствует об отсутствии |
32 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2005 |
РАССЕЯННЫЙ СКЛЕРОЗ
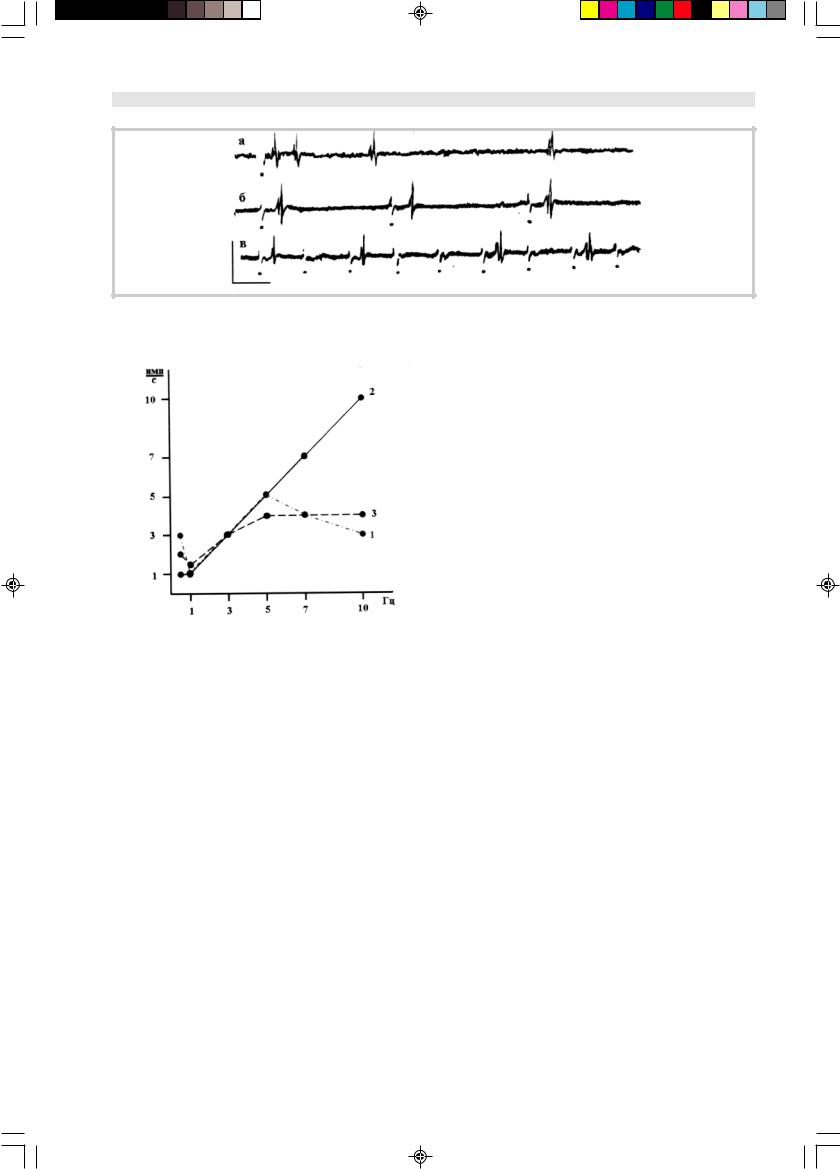
Рис. 4. Вызванная импульсная активность нейрона, инкубированного в сыворотке крови больного, не содержащей антител к
GM1.
|
|
рушениям развития процессов сенситизации и при- |
|
|
|
выкания. Это позволяет утверждать, что именно ан- |
|
|
|
титела к ганглиозидам, содержащиеся в крови боль- |
|
|
|
ных вторично-прогредиентным рассеянным склеро- |
|
|
|
зом, изменяют электрогенез нейрона и его реакцию |
|
|
|
на синаптическую активацию, вызывая модификацию |
|
|
|
электрических свойств мембраны нервной клетки. Как |
|
|
|
и в случае с сывороткой кроликов [5], этот процесс |
|
|
|
развивается быстро — в течение 40 мин. |
|
|
|
Сыворотка больных вторично-прогредиентным |
|
|
|
рассеянным склерозом обеих групп оказывает тормоз- |
|
|
|
ное влияние на фоновую электрическую активность |
|
|
|
нейрона. Следовательно, этот эффект не зависит от |
|
|
|
того, содержатся или нет в сыворотке антитела к GM1. |
|
|
|
Однако сыворотка с антителами к GM1 приводит к |
|
|
|
раздвоению спайка, а сыворотка без этих антител |
|
|
|
вызывает появление первичного потенциала с малой |
|
|
|
амплитудой. Различия между действием сыворотки, |
|
|
|
содержащей и не содержащей антитела к GM1, наи- |
|
Рис. 5. Влияние на отношение между частотой синаптиче- |
более ярко проявляются при частотном синаптиче- |
||
ском раздражении (см. рис. 5). |
|||
ской активации и частотой вызванной импульсной активно- |
|||
Таким образом, проведенные нами эксперимен- |
|||
сти нейрона сыворотки крови здоровых доноров (1), сыво- |
|||
ты на отдельной нервной клетке позволили выявить |
|||
ротки больных, содержащей антитела к GM1 (2) и сыворотки |
|||
как сходство, так и различие в действии сыворотки |
|||
больных без антител к GM1 (3). |
|||
|
|
больных двух групп с вторично-прогредиентным рас- |
|
|
|
сеянным склерозом. Это указывает на то, что в крови |
|
привыкания (рис. 5, 2). А такое же соотношение час- |
больных рассеянным склерозом присутствуют различ- |
||
тот в третьей серии (сыворотка без антител к GM1) |
ные факторы, оказывающие непосредственное влия- |
||
хотя и отражает трансформацию ритма, но не демон- |
ние на электрогенез нейрона. Одним из них, несо- |
||
стрирует привыкания, так как не соответствует основ- |
мненно, являются антитела к GM1, при действии |
||
ному признаку этого процесса (рис. 5, 3) [3, 6, 19]. |
которых не происходит трансформации ритма им- |
||
Обсуждение |
|
пульсной активности. Другой фактор, вызывающий |
|
|
трансформацию ритма, требует дальнейшего изуче- |
||
|
|
ния. В сыворотке крови больных рассеянным склеро- |
|
Наши предыдущие опыты с сывороткой крови |
|
зом мы определяли только антитела к GM1. Однако |
|
кроликов [5, 6], содержащей антитела к общим ган- |
известно, что в сыворотке больных и животных, ко- |
||
глиозидам мозга, среди которых главными были GM1, |
торые являются экспериментальными моделями рас- |
||
GD1a, GD1b и GТ1b, и результаты второй серии экс- |
сеянного склероза, находятся антитела к другим ос- |
||
периментов с сывороткой больных, содержащей ан- |
новным ганглиозидам мозга, а также к другим сфинго- |
||
титела к GM1, показывают, что действие антител к |
гликолипидам мозга [17, 18]. |
||
ганглиозидам на электрические свойства мембраны |
Так как GM1 являются основными ганглиозидами |
||
нейрона схожи. Происходит увеличение порога воз- |
нейронов, в наших экспериментах эффект воздейст- |
||
буждения, уменьшается частота спонтанной импульс- |
вия антител к этим ганглиозидам может служить по- |
||
ной активности. В обоих случаях мы наблюдаем ана- |
казателем повреждения именно нейронов. Отмеченные |
||
логичную форму раздвоения спонтанного спайка. Дей- |
нами электрофизиологические реакции, развивающие- |
||
ствие обеих сывороток (кроликов и больных), содер- |
ся в течение 40 мин, должны рассматриваться как ран- |
||
жащих антитела к GM1, приводит к одинаковым на- |
ние изменения нейромембран, полученные на объек- |
||
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2005 |
33 |

МЕТОДЫ ИССЛЕДОВАНИЯ И ДИАГНОСТИКИ
те, не содержащем миелина. Все это свидетельствует о возможности первичного повреждения нейронов и аксонов — еще до развития демиелинизирующего процесса при рассеянном склерозе.
Это заключение подтверждают наши данные о быстрых перестройках физиологических свойств мембраны и морфологических изменениях аксоплазмы живых миелиновых волокон, которые наступают еще до морфологических проявлений поврежденного миелина [2, 5—7].
Наши данные свидетельствуют о том, что, возможно, в основе развития демиелинизирующего процесса при рассеянном склерозе лежат нарушения, происходящие в нейроне, и рассеянный склероз яв-
ляется заболеванием, в первую очередь нарушающим метаболизм нервных клеток. До сих пор большинство исследователей рассматривают рассеянный склероз как первично-демиелинизирующее заболевание, а нейрональная и аксональная деструкция наступает позже и считается вторичной [1, 8, 10]. Однако накопленные в последние десятилетия морфологические данные и результаты магнитно-резонансной спектроскопии свидетельствуют о ранних повреждениях аксонов и нейронов [2, 9, 11, 12, 14, 20]. Результаты наших исследований подкрепляют новый взгляд на рассеянный склероз, согласно которому нарушение нейронов и нейрон-глиальных взаимодействий является первичным [21, 24, 28].
ЛИТЕРАТУРА
1.Гусев Е.И., Демина Т.Л., Бойко А.Н. Рассеянный склероз. М 1997.
2.Запрянова Э., Сотников О.С., Сергеева С.С. и др. Реакция аксонов предшествует демиелинизации в экспериментальных моделях рассеянного склероза. Морфология 2002; 122: 5: 54—59.
3.Сергеева С.С. Изменение характера импульсной активности нейрона Ретциуса при возрастании частоты его синаптической активации. Журн высш нервн деят 1994; 44: 6: 1144—1147.
4.Сергеева С.С. Электрофизиологическое исследование топографии аксодендритных синапсов нейрона Ретциуса пиявки. Физиол журн 1995; 81: 10: 113—116.
5.Сергеева С.С., Делева Д., Запрянова Э. и др. Реакция нейрона Ретциуса пиявки на синаптическую активацию различной частоты при действии антисыворотки к ганглиозидам. ДАН 1998;
362:2: 280—282.
6.Сергеева С.С., Запрянова Э., Сотников О.С. и др. Анализ влияния антител к ганглиозидам на электрическую активность нейрона Ретциуса пиявки и на функциональную активность натриевых каналов входящего тока. Физиол журн 2002; 89: 1: 66—74.
7.Сотников О.С. Функциональная морфология живого мякотного нервного волокна. Л: Наука 1976.
8.Столяров И.Д. Рассеянный склероз. ЭЛБИ 2002.
9.Casanova B., Martinezbisbal M.C., Valero C. et al. Evidence of Walerian degeneration in normal appearing white matter in the early stages of relapsing-remitting multiple sclerosis.J Neurol 2003; 250: 22—28.
10.Compston A., Coles A. Multiple sclerosis. Lancet 2002; 359: 1221— 1231.
11.De Stefano N., Marayanan S., Francis G.S. et al. Evidence of axonal damage in the early stages of multiple sclerosis and its relevance to disability. Arch Neurol 2001; 58: 65—70.
12.Ferguson B., Matyszak M.K., Esiri M.M., Perry V.H. Axonal damage in acute multiple sclerosis lesions.Brain 1997; 120: 393—399.
13.Ledeen R.W. Gangliosides of the neuron. Trends in Neurosci 1985;
8:169—174.
14.Mattews P.M., De Stefano N., Narayanan S. Putting magnetic resonance spectroscopy studies in context: axonal damage and disability in multiple sclerosis.Sem Neurol 1998; 18: 327—336.
15.Poser C.M., Paty K.W., Scheingberg L. et al. New diagnostic criteria
for multiple sclerosis: guidelines for research protocols.Ann Neurol 1983; 13: 227—231.
16.Sadatipour B.,Greer J.,Pender M. Increased circulating antiganglioside antibodies in primary and secondary progressive multiple sclerosis. Ann Neurol 1998; 44: 980—983.
17.Schwerer B., Kitz K., Lassmann H., Bernheimer H. Demonstration by ELISA and relation to serum in vivo demyelinating activity. J Neuroimmunol 1984; 7: 107—119.
18.Stevens A., Weller M., Wietholter H. CSF and serum ganglioside antibody patterns in MS. Acta Neurol Scand 1992; 86: 485—489.
19.Thompson R.F., Spenser W.A. Habituation: a model phenomenon for the study of neuronal substrates of the behaviour. Physiol Rev 1966;
73:16.
20.Trapp B.D., Peterson J., Ransohoff R.M. et al. Axonal transection in the lesions of multiple sclerosis.N Engl J Med 1998; 338: 278—285.
21.Waxman S. Multiple sclerosis as a neuronal disease. Arch Neurol 2000; 57: 22—24.
22.Wiegandt H. Gangliosides: Structure and physiological possibility. Brain Res 1995; 66: 85—97.
23.Yu R., Iqbal K. Sialosylgalactosyl ceramide as a specific marker for the human myelin and oligodendroglial perikarya: gangliosides of human myelin, oligodendroglia and neurons. J Neurochem 1979; 32: 293—300.
24.Zaprianova E. Central nervous system myelin sheath. Abstr. Regional South-East Europ. Conf. Neurol. Psych. Varna 1984; 107.
25.Zaprianova E., Mikova O., Deleva D. et al. Serum antibodies to GM1 ganglioside in patients with multiple sclerosis.Abstr.Second Balkan Immunology Conference. Varna 1998; 119.
26.Zaprianova E., Deleva D., Sultanov B., Majtenyi K. Serum polyclonal antibodies to GM1 ganglioside in autoimmune diseases of the nervous system. Clin Neurosci 2001; 54: 221—227.
27.Zaprianova E., Deleva D., Ilinov P. et al. Serum ganglioside patterns in multiple sclerosis.Neurochem Res 2001; 2: 95—100.
28.Zaprianova E., Deleva D., Majtenyi K. et al. Serum GD1a ganglioside in patients with multiple sclerosis.ActaMorphol Anthropol 2003; 8: 3—7.
29.Zaprianova E., Majtnyi K., Deleva D. Serum IgG and IgM ganglioside GM1 antibodies in patients with multiple sclerosis.Clin Neurosci 2004; 57: 3—4: 94—99.
Поступила 24.01.05
34 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 10, 2005 |
