
Журнал неврологии и психиатрии / 2007 / NEV_2007_01_08
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Анализ полиморфизма гена FABP2 в связи с эффективностью действия препаратов вальпроевой кислоты
М.Г. АКСЕНОВА, С.Г. БУРД, Е.Ю. КАЧАЛИН, Г.Н. АВАКЯН, О.Л. БАДАЛЯН, А.А. САВЕНКОВ, О.Ю. ТЕРТЫШНИК, М.Ю. ДОРОФЕЕВА, Е.Д. БЕЛОУСОВА, Е.И. ГУСЕВ
An association between the FABP2 gene polymorphism and efficacy of valproates
M.G. AKSENOVA, S.G. BURD, E.YU. KACHALIN, G.N. AVAKYAN, O.L. BADALYAN, A.A. SAVENKOV, O.YU. TERTYSHNIK, M.YU. DOROFEEVA, E.D. BELOUSOVA, E.I. GUSEV
Лаборатория молекулярно-генетической диагностики НИИ экологии человека и гигиены окружающей среды им. А.Н. Сысина РАМН; кафедра неврологии и нейрохирургии лечебного факультета Российского государственного медицинского университета; отдел психоневрологии и эпилептологии Московского НИИ педиатрии и детской хирургии Росздрава, Москва
Задачей настоящего исследования являлось изучение полиморфного локуса 163G>А гена FABP2 в связи с внутриклеточным транспортом вальпроевой кислоты в тонком кишечнике человека. Обследовали 168 пациентов с различными формами эпилепсии. Возраст больных составил от 1 года до 89 лет, с разной длительностью заболевания. Больным назначали препараты вальпроевой кислоты (127 пациентов) или топирамат (41 пациент) в режиме монотерапии. Результаты проведенной работы показывают, что полиморфизм 163G>A (Ala54Thr) значи- мо влияет на эффективную дозу вальпроевой кислоты и не влияет на дозу топирамата.
Ключевые слова: эпилепсия, полиморфизм гена, ген FABP2, вальпроаты.
To search for association between the 163G>A polymorphism of the fatty acid binding protein 2 (FABP2) gene and intracellular transport of the valproic acid in the small intestines, 168 patients with different forms of epilepsy, aged from 1 to 89 years, and different illness duration have been studied. The patients received valproates (127 patients) and topiramate (41 patients) as a monotherapy. It has been shown that the 163G>A (Ala54Thr) polymorphism exerts an influence on effective dose of the valproic acid but not of topiramate.
Key words: epilepsy, gene polymorphism, FABP2 gene, valproates.
Эпилепсия требует многолетней (не менее 2 лет после |
структуре являющиеся производным жирных кислот, при- |
||
прекращения приступов) терапии, что имеет принципи- |
меняются практически при всех типах приступов и формах |
||
альное значение для здоровья и качества жизни больного. |
эпилепсии. Однако их адекватное назначение не всегда дает |
||
В последнее время при назначении противоэпилепти- |
ожидаемый клинический эффект у больных с одинаковыми |
||
ческих препаратов больным эпилепсией значительно повы- |
формами эпилепсии и типом приступов. |
||
сились требования как к безопасности, так и к оптимиза- |
Мы предположили, что в переносе вальпроевой |
||
ции их использования. Прежде всего они не должны оказы- |
|||
кислоты в кишечнике участвует белок, связывающий |
|||
вать токсического действия, вызывать побочных эффектов |
|||
жирные кислоты, — продукт гена FABP2 (fatty acid |
|||
и нарушать работоспособность [1]. Назначение этих препа- |
|||
binding protein), который локализуется на длинном |
|||
ратов основано на клинико-нейрофизиологических пока- |
|
||
зателях. Очевидно, что полиморфизм генов, контролирую- |
плече 4-й хромосомы. В связывании гидрофильного |
||
щих рецепторы, ферменты, транспортные системы, кото- |
|
топирамата он не участвует, поэтому пациенты, при- |
|
рые определяют фармакодинамику и фармакокинетику ле- |
нимавшие этот препарат, составили группу сравне- |
||
карственных средств, является важнейшей причиной ин- |
íèÿ. |
||
дивидуальных различий в реакциях на них [2]. На сегодняш- |
|||
Задачей настоящго исследования было изучение |
|||
ний день нет данных, позволяющих назначать препарат с |
|||
полиморфного локуса 163G>A гена FABP2 в связи с |
|||
учетом индивидуальных особенностей метаболизма у чело- |
|||
внутриклеточным транспортом вальпроевой кислоты |
|||
века. Необходимость получения таких результатов требует |
|||
в тонкой кишке человека. |
|||
проведения фармакологических исследований с привлече- |
|||
нием генетических методов. |
|
|
|
Наиболее распространенными антиконвульсантами, |
Материал и методы |
||
обладающими широким спектром действия, являются вальп- |
|
||
роаты. Препараты вальпроевой кислоты, по химической |
Обследовали 168 пациентов с разными формами |
||
|
|
эпилепсии: идиопатической генерализованной, крип- |
|
|
|
тогенной локально обусловленной, симптоматической |
|
© Коллектив авторов, 2007 |
|
||
|
локально обусловленной, у которых диагноз был ус- |
||
|
|
||
Zh Nevrol Psikhiatr Im SS Korsakova 2007;107:1:42—45 |
тановлен на основании клинических и инструменталь- |
||
|
|||
42

АНТИЭПИЛЕПТИЧЕСКОЕ ЛЕЧЕНИЕ И ГЕНЕТИКА
ных данных. Возраст их составлял от 1 года до 89 лет, длительность заболевания была разной. Все больные принимали препараты вальпроевой кислоты и топирамат в режиме монотерапии. В исследование вклю- чали больных с адекватным ответом на лечение, т.е. при урежении приступов минимум на 50%.
Препараты вальпроевой кислоты принимали 127 пациентов, топирамат — 41. В исследовании были использованы только оригинальные препараты вальпроевой кислоты в лекарственных формах депакин («Sanofi-Aventis») и конвулекс («Gerot Pharmazeutika») в суточных дозах от 250 до 2000 мг/сут, топирамат — топамакс («Янсен-Силлаг») в дозах от 25 до 500 мг/сут. Образцы крови больных эпилепсией были предоставлены окружными неврологическими отделениями больниц Москвы, отделом психоневрологии и эпилептологии Московского НИИ педиатрии и детской хирургии и областной городской больницей г. Люберец.
Для получения ДНК необходимой степени чистоты использовали фенол/хлороформный метод выделения ее из крови (Grimberg, 1989). Полимеразную цепную реакцию проводили на амплификаторе Терцик («ДНК-технология», Россия) с использованием следующих праймеров: прямой — CTA CCG AGT TTT CTT CCC ACC и обратный — AAT TAA ACC ATC CAA TGA AAT AGA GC. Реакционная смесь для амплификации объемом 25 мкл содержала 0,67 М трисHCl рН 8,8; 16,7 мМ (NH4)2SO4; 0,01% твин-20; 0,2 мМ каждого dNTP; 0,1 мкг геномной ДНК; 20 пмоль каждого праймера; 2 ед Taq полимеразы; MgCl2 в концентрации 1,5 мМ. Амплификация состояла из предварительной денатурации при 95°С — 4 мин, 36 циклов, состоящих из денатурации при 94°С — 20 c, отжига праймеров при 62°С — 20 с, синтеза продукта при 72°С — 10 с; затем следовала стадия заключи- тельного синтеза при 72°С — 5 мин. Получившийся фрагмент длиной 375 пар оснований (п.о.) расщепляли ферментом BstHH I при температуре 50°С. В слу- чае аллеля G (Ala) образовывались фрагменты 200 и 175 п.о. Препараты ДНК разделяли посредством электрофореза в 4% агарозном геле. В качестве маркера использовали ДНК плазмиды pBR322, расщепленную рестриктазами Mva I или Alu I, а также ДНК плазмиды pUC19, расщепленную рестриктазой Msp I. Гели красили бромистым этидием и визуализировали в ультрафиолете.
Скорость метаболизма вальпроата оценивали по пиковой концентрации свободного вальпроата в крови, измеренной методом высокоэффективной жидкостной хроматографии, а также косвенно по дозе препарата, которая оказывает эффективное действие на пациента.
Для статистического анализа результатов использовали следующие критерии и компьютерные программы: R (A Language and Environment for Statistical Computing), критерии Стьюдента, критерий Манна— Уитни, χ2.
Результаты
×àñòóты аллелей полиморфного маркера Ala54Thr гена FABP2 составили Ala(G) — 0,66, Thr(A) — 0,34, частóты генотипов: Ala/Ala — 0,42, Thr/Thr — 0,9,
Ala/Thr — 0,49. Распределение частот генотипов под- чинялось закону Харди—Вайнберга (χ2=1,94<3,84).
По результатам исследования в выборке из 127 пациентов было установлено, что средние эффективные дозы вальпроевой кислоты для носителей гомозиготных генотипов AA и GG составляют 846±144 и 1131±56 мг соответственно (среднее значение ± стандартная ошибка). Для носителей гетерозиготного генотипа AG средняя эффективная доза составила 924±61 мг/сут. Статистически достоверного различия средних между гомозиготным генотипом AA и гетерозиготным AG не выявлено.С учетом редкой встре- чаемости генотипа AA при статистической обработке данных генотипы AA и AG были объединены в одну группу (A+), средняя доза при этом составила 910±56 мг/сут (рис. 1).
Средние эффективные дозы вальпроевой кислоты для носителей генотипов (A+) и гомозиготного GG (A–) статистически достоверно различались (p=0,007).
Âгруппе сравнения средние эффективные дозы топирамата составили 142±35, 204±34 и 177±27 мг для носителей генотипов AA, AG и GG соответственно. Между каждой из групп статистически достоверных различий в средних значениях выявлено не было.
Для части обследованных пациентов — 77 была определена пиковая концентрация несвязанной (сво-
бодной) вальпроевой кислоты в крови (Cmax). При исследовании связи Cmax с генотипами достоверных различий не установлено.
Концентрации вальпроатов в крови были соотнесены с индивидуальными суточными дозами (doz).
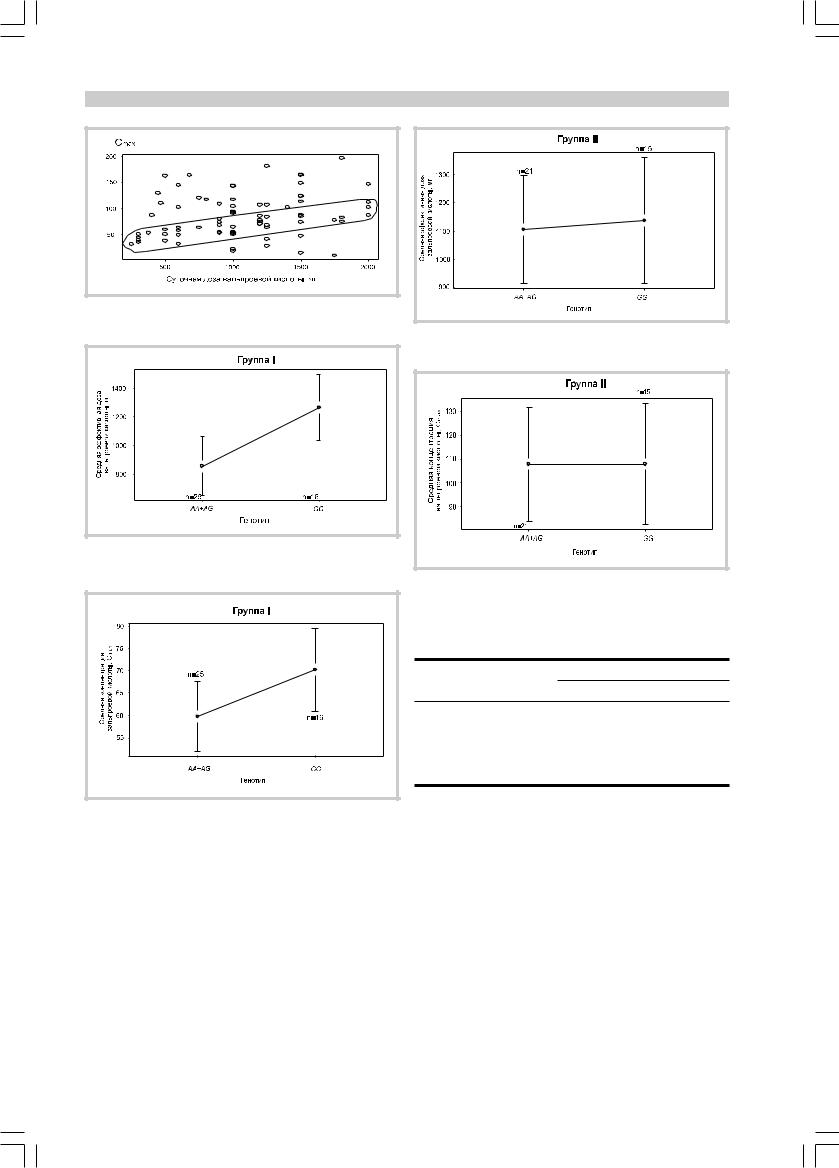
У 41 пациента (группа I) выявлена линейная зависимость концентрации от дозы препарата (рис. 2).
Ко второй группе были отнесены 36 пациентов,
óкоторых концентрация препарата не зависела от дозы. В группе I средние дозы препарата для разных генотипов достоверно различались (рис. 3). Зависимость
средней Cmax от генотипа была близка к достоверной: р=0,056 (рис. 4).
Âгруппе II взаимосвязи генотипов и средних doz или средних Cmax выявленно не было (рис. 5 и 6).
Рис. 1. Зависимость средней эффективной дозы вальпрое- |
вой кислоты от генотипа (р=0,007). |
Вертикальные линии — доверительные интервалы; n — число об- |
разцов, попадающих в эту группу. |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
43 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
Рис. 2. Линейная зависимость концентрации от дозы препа- |
рата (выделенный фрагмент). |
Рис. 3. Зависимость дозы вальпроевой кислоты от генотипа |
(ð=0,013). |
Рис. 4. Зависимость Сmax вальпроевой кислоты в крови от |
генотипа (р=0,056). |
При анализе зависимости средних doz и средних Cmax от генотипа основной вклад вносят пациенты группы I. В ней средняя суточная доза вальпроевой кислоты для генотипов A+ и A– составила 855±100 и 1263±108 мг соответственно. Для подгруппы A+ эффективны меньшие дозы вальпроата и соответственно меньшие концентрации его в крови. Для носителей генотипа A– эффективны бóльшие дозы препарата и бóльшие его концентрации в крови (см. таблицу).
В качестве условной разделительной границы доз вальпроевой кислоты было выбрано значение 850 мг/сут, так как именно при этом эмпирически подобранном
Рис. 5. Зависимость дозы вальпроевой кислоты от генотипа |
для группы II. |
Рис. 6. Зависимость Сmax вальпроевой кислоты в крови от |
||
генотипа для группы II. |
|
|
Распределение генотипов в зависимости от дозы препарата |
||
для группы I |
|
|
|
Доза вольпроата, мг/сут |
|
Генотип |
≤850 |
>850 |
|
||
N(AA) |
3 |
3 |
N(AG) |
10 |
9 |
N(GG) |
1 |
15 |
N(GG)/N(AG) |
10 |
0,6 |
значении N(GG)/N(AG) по левую и по правую сторону границы наглядно различаются 10 и 0,6 в данном случае. Из таблицы видно, что генотип А– в группе I концентрируется в области средних и высоких суточ- ных доз вальпроевой кислоты и только однажды встре- чается в области низких доз.
Обсуждение
Среди всех известных полиморфизмов гена FABP2 только точечная замена 163 G>A во втором экзоне связана с изменением первичной структуры белка (Ala54Thr), что дает основание считать этот полиморфизм связанным с функциональными свойствами белка FABP2 [16]. Частота аллеля Thr54 варьирует от 0,14 у американских индейцев (Oji-Cree) до 0,43 у
44 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |

|
АНТИЭПИЛЕПТИЧЕСКОЕ ЛЕЧЕНИЕ И ГЕНЕТИКА |
японцев. В азиатских популяциях она встречается с |
шенным уровнем инсулина и натощак, и после на- |
частотой от 0,30 до 0,40, в европейских — от 0,27 до |
грузки глюкозой [13]. Многие исследования в самых |
0,35 [16]. В исследованной нами популяции частота |
разных популяциях подтверждают ассоциацию поли- |
аллеля Thr54 составила 0,34. |
морфизма Ala54Thr с наличием инсулинорезистент- |
При изучении постпрандиальной липемии в свя- |
ности [6, 9, 11, 12, 15]. |
зи с разными вариантами преимущественно потреб- |
Несмотря на известную способность белка FABP2 |
ляемых жирных кислот было показано, что для но- |
связываться с жирными кислотами и гидрофобными |
сителей аллеля Thr54 характерен повышенный пост- |
лекарственными препаратами [14], в целом о его |
прандиальный уровень холестерина в хиломикронах |
функциях сведений мало. |
[10]. Кроме того, согласно результатам исследований |
Результаты проведенной нами работы показыва- |
с нагрузкой пациентов пищевыми жирами аффин- |
ют, что полиморфизм 163G>A (Ala54Thr) значимо |
ность к длинноцепочечным жирным кислотам белка |
влияет на эффективную дозу вальпроевой кислоты и |
FABP2 с заменой Thr54 оказалась выше в условиях |
не влияет на дозу топирамата. Для носителей геноти- |
как in vivo [4], так и in vitro [7], что указывает на |
па А– дозы вальпроевой кислоты у определенной час- |
возможную роль этого полиморфизма в этиологии |
ти пациентов (группа I) скорее всего будут высоки- |
нарушений липидного обмена [5]. Носители аллеля |
ми для достижения лечебного эффекта. Мы предпо- |
Thr54 имеют статистически достоверно повышенный |
лагаем, что само наличие двух групп пациентов — I и |
уровень триглицеридов натощак в составе липопро- |
II («линейной» и «нелинейной» зависимости концен- |
теинов высокой плотности [8], а также повышенный |
трации от дозы) объясняется существенным влияни- |
постпрандиальный уровень триглицеридов в составе |
åì íà Cmax группы II неуточненных факторов. Таковы- |
хиломикронов и липопротеинов низкой и очень низ- |
ми могут быть сопутствующие заболевания желудоч- |
кой плотности [3]. В ряде публикаций приводятся со- |
но-кишечного тракта, прием других лекарственных |
гласованные данные об ассоциации между наличием |
препаратов и индивидуальные различия в активно- |
генотипа FABP2 Thr/Thr и повышенным уровнем |
сти ферментных систем. Для объяснения и уточнения |
инсулина, определяемого натощак [5]. В японской |
этих особенностей необходимы дальнейшие исследо- |
популяции генотип Thr/Thr ассоциирован с повы- |
вания. |
ЛИТЕРАТУРА
1.Гусев Е.И., Авакян Г.Н., Бадалян О.Л. и др. Тактика ведения и дополнительные возможности терапии больных эпилепсией: пособие для врачей. М 2005.
2. Середенин С. Б. Лекции по фармакогенетике. М: Медицинское информационное агентство 2004.
3. Agren J.,Valve R.,Vidgren H. et al. Postprandial lipemic response is modified by the polymorphism at codon 54 of the fatty acid-binding protein 2. Gene Arterioscler Thromb Vasc Biol 1998; 18: 1606— 1610.
4. Agren J., Vidgren H.M., Valve R.S. et al. Postprandial responses of individual fatty acids in subjects homozygous for the threonineor alanine-encoding allele in codon 54 of the intestinal fatty acid binding protein 2 gene. Am J Clin Nutr 2001; 73: 31—35.
5.Albala C., Santos J.L., Cifuentes M. et al. Intestinal FABP2 A54T polymorphism: association with insulin resistance and obesity in women. Obesity Research 2004; 12: 2: 340—345.
6.Baier L.J., Sacchettini J.C., Knowler W.C. et al. An amino acid substitution in the human intestinal fatty acid binding protein is associated with increased fatty acid binding, increased fat oxidation, and insulin resistance. J Clin Invest 1995; 95: 1281—1287.
7. Baier L.J., Sacchettinit J.C., William C. An amino acid substitution in the human intestinal fatty acid binding protein is associated with increased fatty acid binding, increased fat oxidation, and insulin resistance. J Clin Investigation 1995; 95: 1281—1287.
8. Berthier M.-T., Couillard C., Prudhomme D. et al. Effects of the FABP2 A54T mutation on triglyceride metabolism of viscerally obese men. Obesity Research 2001; 9: 11: 668—675.
9. Chiu K.C., Chuang L.M., Yoon C. The A54T polymorphism at the intestinal fatty acid binding protein 2 is associated with insulin resistance in glucose tolerant Caucasians. BMC Genet 2001; 2: 7—13.
10. Dworatzek P.D.N.,Hegele R.A.,Wolever T.M.S. Postprandial lipemia in subjects with the threonine 54 variant of the fatty acid-binding protein 2 gene is dependent on the type of fat. Am J Clin Nutr 2004;
79: 1110—1117.
11.Kim C.H., Yun S.K., Byun D.W. et al. Codon 54 polymorphism of the fatty acid binding protein 2 gene is associated with increased fat oxidation and hyperinsulinemia but not with intestinal fatty acid absorption in Korean. Men Metabolism 2001; 50: 473—476.
12. Mitchell B.D., Kammerer C.M., O’Connell P. et al. Evidence for linkage of postchallenge insulin levels with intestinal fatty acid-binding protein (FABP-2) in Mexican. Am Diabetes 1995; 44: 1046—1053.
13. Sipilainen R.,Uusitupa M.,Heikkinen S. et al. Variants of the human intestinal fatty acid binding protein 2 gene in obese subjects. J Clin Endocrinol Metab 1997; 82: 2629—2632.
14. Velkov T.,Chuang S.,Wielens J. et al. The interaction of lipophilic drugs with intestinal fatty acid-binding protein. J Biol Chem 2005; 6: 280: 18: 17769—17776.
15. Weiss E.P., Brown M.D., Shuldiner A.R., Hagberg J.M. Fatty acid binding protein 2 gene variants and insulin resistance: gene and geneenvironmental interaction effects. Physiol Genomics 2002; 10: 145— 157.
16.Weiss E.P., Brown M.D., Shuldiner A.R. et al. Fatty acid binding pro- tein-2 gene variants and insulin resistance: gene and gene-environ- ment interaction effects. Physiol Genomics 2002; 10: 145—157.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
45 |
