
Журнал неврологии и психиатрии / 2007 / NEV_2007_01_06
.pdf
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Оксидантный стресс и кислородный статус при ишемическом инсульте
В.И. СКВОРЦОВА, Я.Р. НАРЦИССОВ, М.К. БОДЫХОВ, И.В. КИЧУК, Н.А. ПРЯНИКОВА, Ю.В. ГУДКОВА, Т.Д. СОЛДАТЕНКОВА, Т.Т. КОНДРАШОВА, Е.В. КАЛИНИНА, М.Д. НОВИЧКОВА, А.Б.ШУТЬЕВА, О.Б. КЕРБИКОВ
Oxidative stress and oxygen status in ischemic stroke
V.I. SKVORTSOVA, YA.R. NARTSISSOV, M.K. BODYKHOV, I.V. KICHUCK, N.A. PRYANIKOVA, YU.V. GUDKOVA, T.D. SOLDATENKOVA, T.T. KONDRASHOVA, E.V. KALININA, M.D. NOVICHKOVA, A.B. SHUTYEVA, O.B. KERBIKOV
Кафедра фундаментальной и клинической неврологии Российского государственного медицинского университета; НИИ цитохимии и молекулярной фармакологии, Москва
Проведена динамическая оценка кислородного статуса артериальной крови, активности ключевых ферментов антиоксидантной системы (АОС), активности сукцинатдегидрогеназы (СДГ), митохондриальной α-глицерофосфат- дегидрогеназы (α-ГФДГ) и щелочной фосфатазы (ЩФ) с помощью цитохимических методик, а также концентрации восстановленного глутатиона и вторичных продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой (ТБКРП) у больных в остром периоде ишемического инсульта полушарной локализации. Выявлена относительная гипероксия, развивающаяся в результате гипервентиляционного синдрома, максимально выраженная на 1-е и 3-и сутки инсульта; угнетение активности ферментов АОС и повышение концентрации ТБКРП, развивающиеся с 1-х суток инсульта. Установлено снижение активности СДГ, и повышение активности α- ГФДГ (в 2,8 раза по сравнению с контролем) и ЩФ лимфоцитов. Показано, что нормализация активности ЩФ на 7-е сутки инсульта позволяет прогнозировать хорошее функциональное восстановление к 21-му дню заболевания. Таким образом, результаты исследования свидетельствуют, что развитие относительной гипероксии в условиях скомпрометированного ишемическим повреждением АОС и биоэнергетической гипоксии приводит к усилению оксидантного стресса
Ключевые слова: ишемический инсульт, оксидантный стресс, цитотоксическая гипоксия, гипероксия.
A dynamic assessment of oxygen status of the arterial blood, activity of antioxidant system enzymes (AOS), succinatedehydrogenase (SDG), mitochondrial α-glycero-phosphate-dehydrogenase (α-GPDH) and alkaline phosphatase (AP) as well as concentrations of reduced glutathione (GSH) and secondary products of lipid peroxidation reacting with thiobarbituric acid (PLPRTA) has been carried out in patients at the acute stage of ischemic stroke of hemispheric location. Relative hyperoxia as a result of the hyperventilation syndrome was mostly pronounced on day 1 and 3. At the same time, a reduced activity of AOS system and an increase of PLPRTA concentration have been observed from the 1st day after stroke. There were also a decrease of the SDG activity and a marked (2,8 fold) increase of the α- GPDH activity as compared to the controls. A decrease of the AP leukocyte activity in the peripheral blood to day 7 after stroke makes possible a prognosis of good functional rehabilitation to the 21st day of the disease. Therefore, the results of the study suggest that the development of oxidative stress in patients with ischemic stroke is caused by tprimary disruption of bioenergetic processes during the reduction of AOS activity.
Key words: ischemic stroke, oxidative stress, cytotoxic hypoxia, hyperoxia.
Развитие оксидантного стресса возможно в условиях как недостаточности, так и избыточности кислорода [1, 9]. Он играет одну из ведущих ролей в патогенезе ишемического инсульта и развивается уже в первые часы ишемии [3]. Спонтанная или индуцированная реканализация сосуда, а также наличие коллатералей способны приводить к реоксигенации ишемизированной зоны мозга, что может вызывать новую волну оксидантного стресса. Хорошо известно, что важнейшее значение в резистентности нервной ткани к подобного рода воздействиям играет состояние биоэнергетики митохондрий [15]. Ранее была по-
© Коллектив авторов, 2007
Zh Nevrol Psikhiatr Im SS Korsakova 2007;107:1:30—36
казана эффективность применения цитохимических методов для сравнительного анализа изменений митохондриальных процессов при различных патологи- ческих состояниях [5]. Поэтому использование методик определения активности ферментов in situ наряду с количественным описанием состояния антиоксидантной системы и динамическим мониторингом физиологических показателей крови пациентов позволяет выявить новые патогенетические особенности процесса формирования ишемического очага на молекулярном уровне.
Целью данного исследования явилась оценка изменений газового состава артериальной крови, состояния антиоксидантной системы и уровня митохондриальных ферментов в остром периоде ишеми- ческого инсульта.
30 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |

Материал и методы
В основу работы положены результаты обследования 37 больных с ишемическим инсультом в каротидной системе в возрасте 45—85 лет (средний 71,4±9,2 года) — 13 мужчин и 24 женщины.
Критериями включения в исследование являлись клиническая картина первого в жизни ишемического инсульта в каротидной системе атеротромботического или кардиоэмболического генеза по критериям TOAST (Trial of Org 10172 in Acute Stroke Treatment), поступление в клинику в первые 24 ч развития заболевания. Критериями исключения были полный регресс неврологической симптоматики в течение 24 ч от начала заболевания, наличие лакунарного инсульта (по ТOAST), а также острого инфаркта миокарда, выраженной сердечной, печеночной или почечной недостаточности и других состояний, сопровождающихся грубыми нарушениями системной гемодинамики и метаболизма.
На основании анализа неврологического статуса больных разделили на две группы (табл. 1): с инсультом средней тяжести (балл по шкале NIH на момент госпитализации от 3 до 13 и с тяжелым (NIH≥14).
Всем пациентам проводили максимально унифицированную базисную терапию в соответствии с рекомендациями Европейской инициативной группы по проблеме инсульта (EUSI, 2003) [7]. Учитывая эффективность глицина, доказанную в ходе рандомизированного двойного слепого плацебо-контролируе- мого исследования [11], во всех случаях в остром периоде заболевания этот нейропротектор назначали в дозе 1 г раз в сутки сублингвально.
Группа контроля включала 27 практически здоровых добровольцев, у которых в анамнезе не было инсульта или транзиторных ишемических атак.
Проводили исследование соматического и неврологического статуса больных по общепринятым методикам при поступлении и затем на 3, 7, 14 и 21-е сутки инсульта. Для объективизации тяжести состояния, выраженности очагового неврологического дефицита и оценки динамики клинических показателей использовали балльную шкалу NIH (H. Adams и J. Biller, 1989). Степень функционального восстановления определяли на 21-е сутки инсульта с помощью индекса Бартел.
Ишемический характер инсульта был установлен по данным анамнеза, клинической картине заболевания и подтвержден результатами МРТ головного мозга. Патогенетический вариант развития заболевания определяли в соответствии с критериями TOAST, на основании анамнеза и особенностей клинической картины, данных ультразвуковой допплерографии
ИШЕМИЧЕСКИЙ ИНСУЛЬТ
магистральных артерий головы, электро-, эхокардиографии, МРТ, лабораторных показателей.
Для анализа газового состава крови использовали газоанализатор ABL 500 («Radiometer», Дания). Кровь брали из бедренной артерии по общепринятой методике в гепаринизированные шприцы при поступлении, на 3-и и 7-е сутки от начала инсульта.
Для определения активности ферментов антиоксидантной системы — супероксиддисмутазы, каталазы, глутатионпероксидазы, глутатионредуктазы, концентрации восстановленного глутатиона (глутатион SH) и вторичных продуктов перекисного окисления липидов, реагирующих с тиобарбитуровой кислотой (ТБКРП), в 1-е сутки заболевания (при поступлении, до начала терапии), на 3, 7 и 14-е сутки брали кровь из локтевой вены (10,0 мл) с использованием вакуумных пробирок, содержавших гепарин, немедленно разделяли ее на клеточный компонент и плазму (центрифугированием в течение 15 мин при 2000 об/мин на центрифуге ОС-6М) с помощью стандартных пипеток, помещали в эпиндорфы (1,0 мл) и замораживали при —20°С. Активность ферментов определяли спектрофотометрически на спектрофотометре SPECORD W-VIS в кювете с перемешиванием при толщине слоя 1 см. Расчет активности ферментов проводили на 1 мг гемоглобина. Концентрацию гемоглобина в гемолизате определяли гемоглобинцианидным методом.
Для исследования цитохимических показателей крови в те же сроки — при поступлении, на 3, 7 и 14-е сутки от начала инсульта брали капиллярную кровь, готовили мазки, высушивали и фиксировали в течение 30 с 10% раствором спирт-формалина (для определения активности щелочной фосфатазы — ЩФ) или раствором ацетона, насыщенным трилоном Б (для определения активности сукцинатдегидрогеназы — СДГ и α-глицерофосфатдегидрогеназы — α-ГФДГ). Затем предметные стекла с мазками промывали дистиллированной водой и высушивали. Окраску мазков проводили методом азосочетания (для определения активности ЩФ) и методом Р.П. Нарциссова (с помощью солей тетразолия) для определения активности СДГ и α-ГФДГ. После этого осуществляли микрокопирование мазков под масляной или водной иммерсией, подсчитывали прокрашенные гранулы и определяли активность ферментов.
ЭЭГ регистрировали по стандартной методике на приборе EEG-24 (фирма МБН, Москва) в течение 15 мин до начала терапии, а также на 3, 7 и 14-е сутки заболевания. Использовали монополярный монтаж, 19 активных электродов, располагавшихся на коже головы по международной системе 10—20 относительно раздельных референтных ушных электродов.
Таблица 1. Общая характеристика больных инсультом разной тяжести
Инсульт |
n |
Мужчины/ |
Возраст, годы |
Атеротромботический/ |
Áàëë ïî NIHSS |
|
женщины |
кардиоэмболический |
|||||
|
|
|
|
|||
|
|
|
|
|
|
|
Средней тяжести |
27 |
10/17 |
69,8±8,6 |
19/8 |
7,9±3,1 |
|
Тяжелый |
10 |
3/7 |
75,8±9,8 |
5/5 |
16,6±2,4 |
|
Всего |
37 |
13/24 |
71,4±9,2 |
24/13 |
10,3±4,9 |
|
|
|
|
|
|
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
31 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
Для анализа, обработки и хранения ЭЭГ-данных |
тельствовать о развитии у больных альвеолярной ги- |
использовали пакет программ ЭЭГ-Нейрокартограф. |
первентиляции и гипероксии, которые регрессиро- |
Во всех случаях проводили визуальный анализ всей |
вали к 7-м суткам. |
записи. Для спектрального анализа использовали без- |
В оценке доставки кислорода к тканям, особен- |
артефактные эпохи продолжительностью 30 с. |
но в условиях гипокапнии, большое значение имеет |
При статистической обработке данных применя- |
pH. Наличие алкалемии обусловливает сдвиг кривой |
ли программу STATISTICA 6.0. Учитывая, что боль- |
диссоциации гемоглобина влево и нарушение отдачи |
шинство совокупностей данных имели распределение, |
кислорода тканям [8, 10, 13]. Метаболическая ком- |
отличное от нормального, достоверность различий |
пенсация (снижение НСО –), наиболее выраженная |
|
3 |
устанавливали с помощью непараметрического U- |
в 1-е сутки инсульта, не приводит к значительному |
критерия Манна—Уитни [2]. Ранговые коэффициен- |
повышению pH и, следовательно, не повышает срод- |
ты корреляции рассчитывали по Спирмену. Для всех |
ство гемоглобина к кислороду. |
тестов был выбран двусторонний 5% уровень значи- |
При изучении митохондриальных ферментов и |
мости. |
ЩФ установлено, что уже в 1-е сутки инсульта про- |
|
исходило снижение активности СДГ, при этом ак- |
Результаты и обсуждение |
тивность α-ГФДГ повышалась по сравнению с кон- |
|
тролем в 2,8 раза (табл. 3). Эти данные свидетельству- |
Учитывая широкую распространенность хрониче- |
ют о снижении сукцинатзависимого дыхания в мито- |
ских заболеваний легких и возрастные изменения |
хондриях. Наряду со снижением уровня одного из |
органов дыхания у пациентов пожилого возраста, |
основных компенсаторных метаболических путей при |
некоторые авторы [8, 10] рекомендовали индивиду- |
гипоксии, возрастает значение переноса восстанов- |
альный подход к оценке напряжения кислорода в |
ленных эквивалентов из цитоплазмы. Примечатель- |
артериальной крови. Должное значение РаО2 рассчи- |
но, что этот процесс сопровождается понижением |
тывали по формуле Лахмана: 96,63 — (0,2833½возраст). |
выхода энергетического продукта в форме АТФ, что |
В 1-е сутки инсульта фиксировали максимальные |
обусловлено, с одной стороны, тканеспецифичностью |
значения PaO2, которые при пересчете с поправкой |
глицерофосфатного челночного механизма для мозга |
на возраст пациентов превышали расчетные более чем |
[14], а с другой — ингибированием комплекса I ды- |
на 20%. На 3-и и 7-е сутки инсульта прослеживалась |
хательной цепи митохондрий при гипоксии. |
тенденция к снижению этого показателя, что приво- |
При анализе активности исследованных фермен- |
дило к нивелированию различий между измеренным |
тов в зависимости от времени развития инсульта вы- |
и расчетным PaO2. Однако во всех наблюдавшихся |
явлено достоверное повышение активности α-ГФДГ |
случаях этот параметр не опускался ниже 60 мм рт.ст. |
(более чем в 5 раз) у пациентов, госпитализирован- |
(òàáë. 2). |
ных в первые 12 ч инсульта, тогда как активность |
Средние значения PaСO2 в 1-е и на 3-и сутки |
СДГ у этих больных была несколько выше, но досто- |
инсульта были ниже нормы. Поэтому относительное |
верно не отличалась от контрольного значения. Иная |
повышение этого показателя и тенденция к его сни- |
картина наблюдалась у больных, госпитализирован- |
жению в 1-е и на 3-и сутки заболевания могут свиде- |
ных позднее: активность α-ГФДГ и СДГ снижалась, |
Таблица 2. Показатели газового состава артериальной крови и кислотно-основного равновесия у больных с ишемическим инсультом при самостоятельном дыхании (FiO2 0,21)
Показатель |
1-е сутки |
3-и сутки |
7-е сутки |
|
|
|
|
PaO2 истинное, мм рт.ст. |
90,0±28,8 |
77,82±14,0 |
71,0±10,9 |
% PaO2 от расчетного |
124,95±31,7 |
116,67±22,3 |
106,7±15,8 |
SaO2, % |
95,4±3,8 |
95,1±2,2 |
93,2±5,4 |
ÐàÑÎ2, ìì ðò.ñò. |
35,7±5,2 |
34,84±4,7 |
36,9±4,2 |
ÍÑÎ3–, ìýêâ/ë |
22,7±3,9 |
23,07±2,6 |
23,8±2,9 |
ðH |
7,41±0,03 |
7,44±0,02 |
7,43±0,02 |
|
|
|
|
Таблица 3. Активность митохондриальных ферментов и ЩФ в 1-е сутки инсульта
Время от начала развития |
|
|
|
Активность, усл.ед. |
|
|
Áàëë ïî NIHSS |
Возраст, годы |
|
|
|
||
инсульта |
ÑÄÃ |
α-ÃÔÄÃ |
ÙÔ |
|||
|
|
|||||
|
|
|
|
|
|
|
3—12 ÷ |
10,5±7,0 |
70,5±8,4 |
605,8±60,0 |
234,0±90,9** |
48,2±16,0* |
|
12—24 ÷ |
12,7±5,3 |
72,4±9,2 |
473,7±92,2^^ ** |
111,2±56,2^^ ** |
31,0±22,3 |
|
3—24 ÷ |
10,5±5,7 |
69,4±9,8 |
496,0±104,1* |
115,6±79,3** |
35,3±21,9 |
|
Группа контроля |
|
64,4±5,2 |
562,0±68,6 |
41,4±14,4 |
27,8±20,9 |
|
|
|
|
|
|
|
Примечание. Достоверные различия с группой контроля: * — p<0,05, ** — p<0,01; с показателями в первые 12 ч: ^^ — p<0,01.
32 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
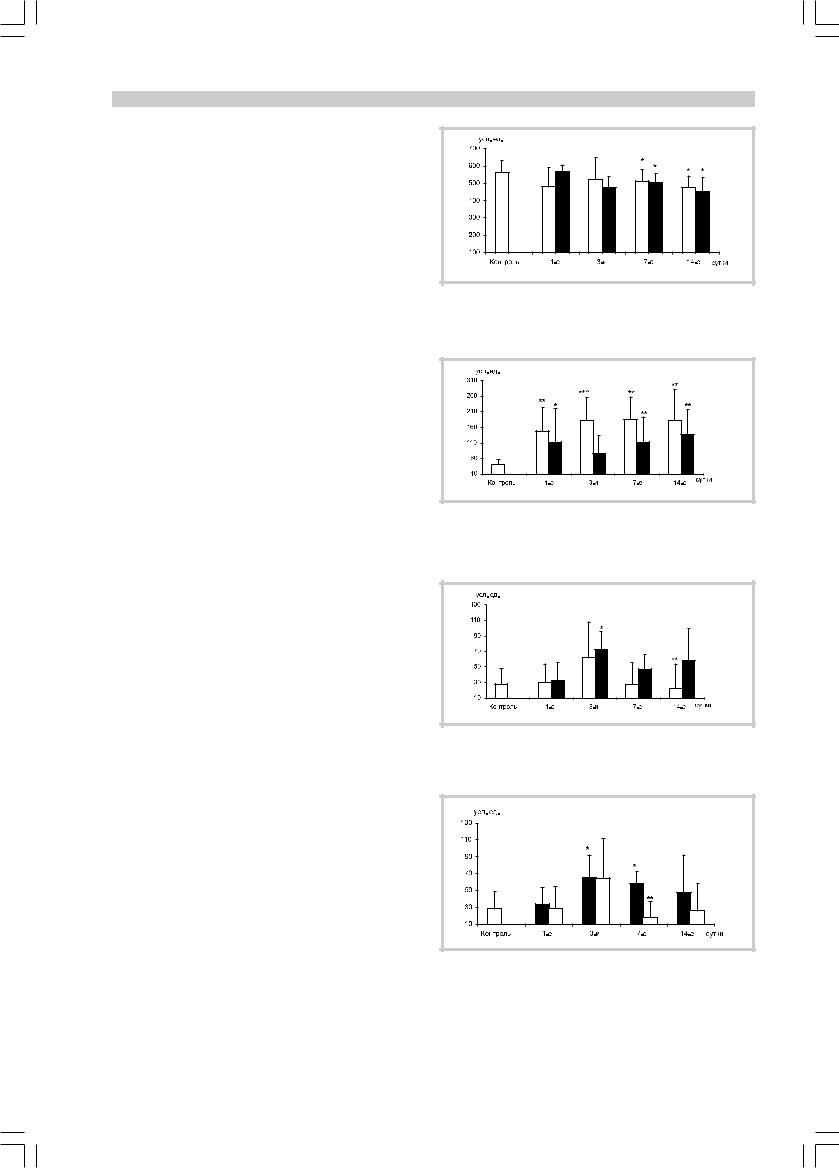
но при этом активность α-ГФДГ оставалась в 2,7 раза выше контроля (см. табл. 3).
Таким образом, в первые часы ишемического инсульта имеет место преобладание первой (компенсаторной) стадии биоэнергетической гипоксии, о чем свидетельствует тенденция к повышению активности СДГ [6]. Отсутствие достоверного ее повышения, по всей видимости, связано с большей выраженностью этого процесса в более ранние сроки инсульта. Можно предположить, что повышение активности α-ГФДГ
â1-å сутки инсульта является следствием активации гликолиза, наиболее выраженной в первые 12 ч от начала заболевания, о чем свидетельствует и резкое повышение активности ЩФ в те же сроки.
Ó16 больных с инсультом разной тяжести, не получавших препаратов с антиоксидантными и ан-
тигипоксантными свойствами, было проведено исследование активности СДГ, α-ГФДГ и ЩФ в динамике.
Óбольных обеих групп наблюдалось снижение активности СДГ лимфоцитов по сравнению с контрольными значениями, особенно выраженное к 7-ì
и 14-м суткам инсульта (рис. 1).
Активность α-ГФДГ по сравнению с СДГ претерпевала обратные изменения — отмечалась общая тенденция к ее повышению. Обращает на себя внимание достоверное повышение активности этого фермента у больных с инсультом средней тяжести на 3-и сутки заболевания по сравнению как с контролем,
так и с группой больных с тяжелым инсультом. При этом активность α-ГФДГ у больных с тяжелым инсультом на 3-и сутки заболевания достоверно не отличалась от таковой в группе контроля (рис. 2).
Активность ЩФ нарастала к 3-м суткам инсульта
âобеих группах, однако достоверные отличия от контроля установлены только у больных с тяжелым инсультом, что свидетельствует о выраженности у них процессов деструкции [4, 12]. После 3-х суток активность фермента между группами была разной: у пациентов с инсультом средней тяжести она не отлича- лась от контроля, а при тяжелом инсульте сохранялась высокой, причем на 14-е сутки различия между группами достигли уровня достоверности (рис. 3).
Кроме того, выявлено достоверное повышение активности ЩФ на 7-е сутки инсульта у больных с тяжелой инвалидизацией по сравнению с контролем и группой больных с хорошим восстановлением неврологических функций (рис. 4).
При анализе активности ферментов антиоксидантной системы, концентрации глутатиона SH и ТБКРП
âпериферической крови уже в первые часы заболевания определялось снижение активности глутатионпероксидазы, концентрации глутатиона SH и повышение концентрации ТБКРП по сравнению с контрольными значениями. Позднее (у больных, госпитализированных в первые 12—24 ч) наблюдалось снижение активности супероксиддисмутазы, каталазы, глутатионредуктазы, глутатионпероксидазы по сравнению как с контрольными значениями, так и с больными, госпитализированными в более ранние сроки (3—12 ч от дебюта заболевания). При динамическом наблюдении выявлено снижение при сравнении с контролем активности супероксиддисмутазы, катала-
ИШЕМИЧЕСКИЙ ИНСУЛЬТ |
Рис. 1. Активность СДГ у больных с инсультом разной тяжести. |
Здесь и на рис. 2, 3 и 5 в парах столбцов: светлые — состояние |
средней тяжести, темные — тяжелое состояние. * — р<0,05 |
по сравнению с контролем. |
Рис. 2. Активность α-ГФДГ у больных с инсультом разной тяжести.
* — р<0,05, ** — р<0,01 по сравнению с контролем; ^ — р<0,01 по сравнению с группой тяжелых больных.
Рис. 3. Активность ЩФ у больных с инсультом разной тяжести. |
* — р<0,01 по сравнению с контролем; ** — р<0,05 по сравнению с |
группой тяжелых больных. |
Рис. 4. Активность ЩФ у больных с разной степенью функционального восстановления на 21-е сутки инсульта.
Здесь и на рис. 6 и 7 в парах столбцов: темные — тяжелая инвалидизация, светлые — хорошее восстановление. * — р<0,01 по сравнению с контролем; ** — р<0,01 по сравнению с группой больных c тяжелой инвалидизацией.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
33 |
ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ
Таблица 4. Активность ферментов антиоксидантной системы, концентрация глутатиона SH и ТБКРП у больных с разной тяжестью инсульта, не получавших антиоксидантов
|
|
|
Срок от начала инсульта |
|
|
|
||
Фермент |
|
|
|
|
|
|
Kонтроль |
|
3—12 ÷ |
12—24 ÷ |
1-е сутки |
3-и сутки |
7-е сутки |
14-е сутки |
|||
|
|
|||||||
|
|
|
|
|
|
|
|
|
ÑÎÄ, Åä/Hb |
276,9±82,9 |
151,2^^ **±62,1 |
215,9*±91,4 |
224,0*±82,2 |
211,4**±70,9 |
210,3**±82,9 |
278±66,0 |
|
Kаталаза, ммоль/мин/Hb |
3,1±0,6 |
2,7^ **±0,8 |
2,8**±0,8 |
2,9**±0,9 |
2,7**±0,8 |
3,0**±0,6 |
3,3±0,4 |
|
Глутатионпероксидаза, |
26,5*±4,9 |
21,9^^ **±7,4 |
24,6**±7,1 |
26,3**±6,8 |
25,6**±5,3 |
25,2**±6,4 |
30,2±4,5 |
|
мкмоль/мин/Hb |
|
|
|
|
|
|
|
|
Глутатионредуктаза, |
4,6±1,5 |
3,6^**±1,0 |
3,9±1,3 |
4,1±1,5 |
4,1±1,5 |
4,0±1,3 |
4,5±1,0 |
|
мкмоль/мин/Hb |
|
|
|
|
|
|
|
|
Глутатион SH, |
2,1**±1,4 |
3,1^ **±2,0 |
3,0**±2,1 |
2,8**±1,8 |
3,0**±1,9 |
3,8**±2,1 |
5,1±0,9 |
|
мкмоль/Hb |
|
|
|
|
|
|
|
|
ТБKРП, нмоль/мл |
5,1*±1,0 |
5,2±1,5 |
4,9±1,2 |
5,1±1,2 |
5,3±1,4 |
5,1±1,2 |
4,4±0,5 |
|
|
|
|
|
|
|
|
|
|
Примечание. Достоверные различия с группой контроля: * — p<0,05, ** — p<0,01; с группой больных, госпитализированных в первые 3—12 ч развития инсульта: ^ — p<0,05; ^^ — p<0,01.
зы, глутатионпероксидазы, концентрации глутатиона SH (табл. 4).
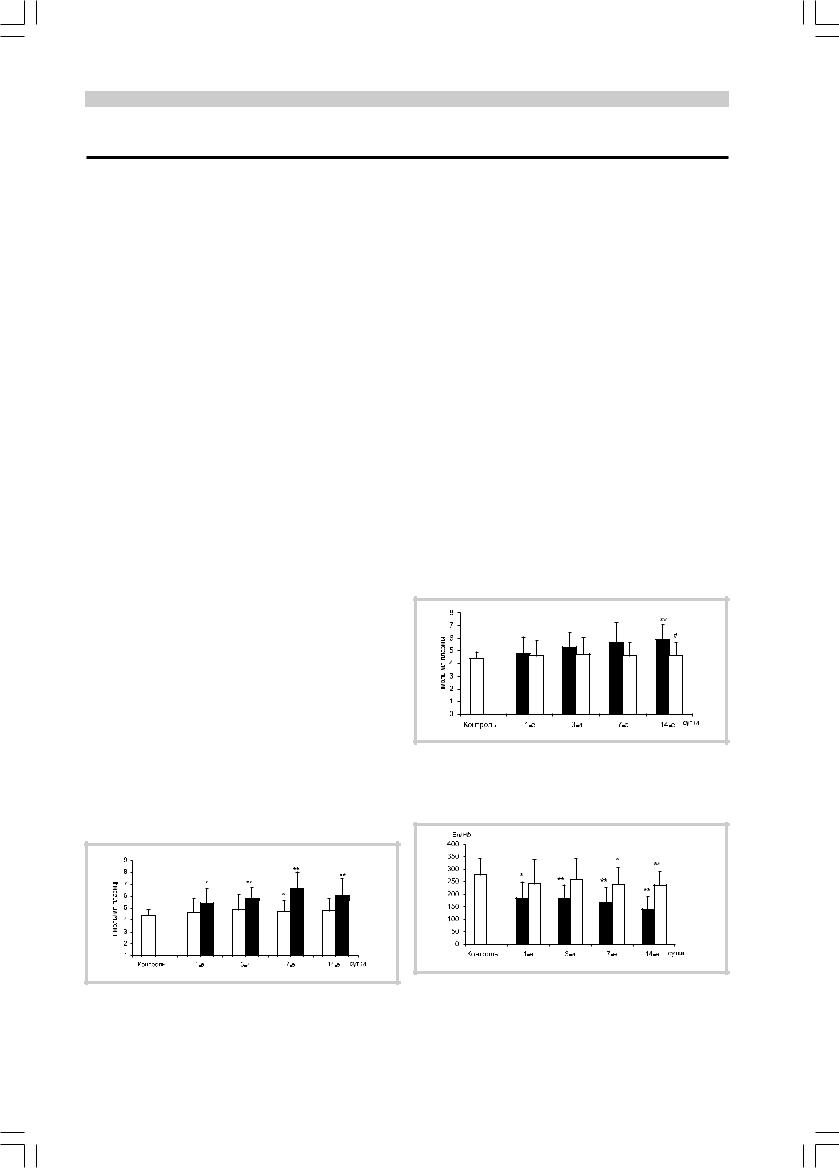
Среднее содержание ТБКРП по группе в целом не отличалось от контроля, однако у больных с тяжелым инсультом выявлено его достоверное повышение во все моменты исследования, по сравнению с контролем, и на 7-е сутки, по сравнению с больными инсультом средней тяжести (рис. 5). Кроме того, у больных с плохим восстановлением неврологических функций отмечалось повышение концентрации ТБКРП на 14-е сутки инсульта, по сравнению как с контролем, так и с группой хорошего восстановления (рис. 6).
Активность супероксиддисмутазы также влияла на исход инсульта: у больных с плохим восстановлением она была ниже контрольного значения на всех этапах исследования, а также ниже, чем у больных с хорошим восстановлением на 7-е и 14-е сутки (рис. 7).
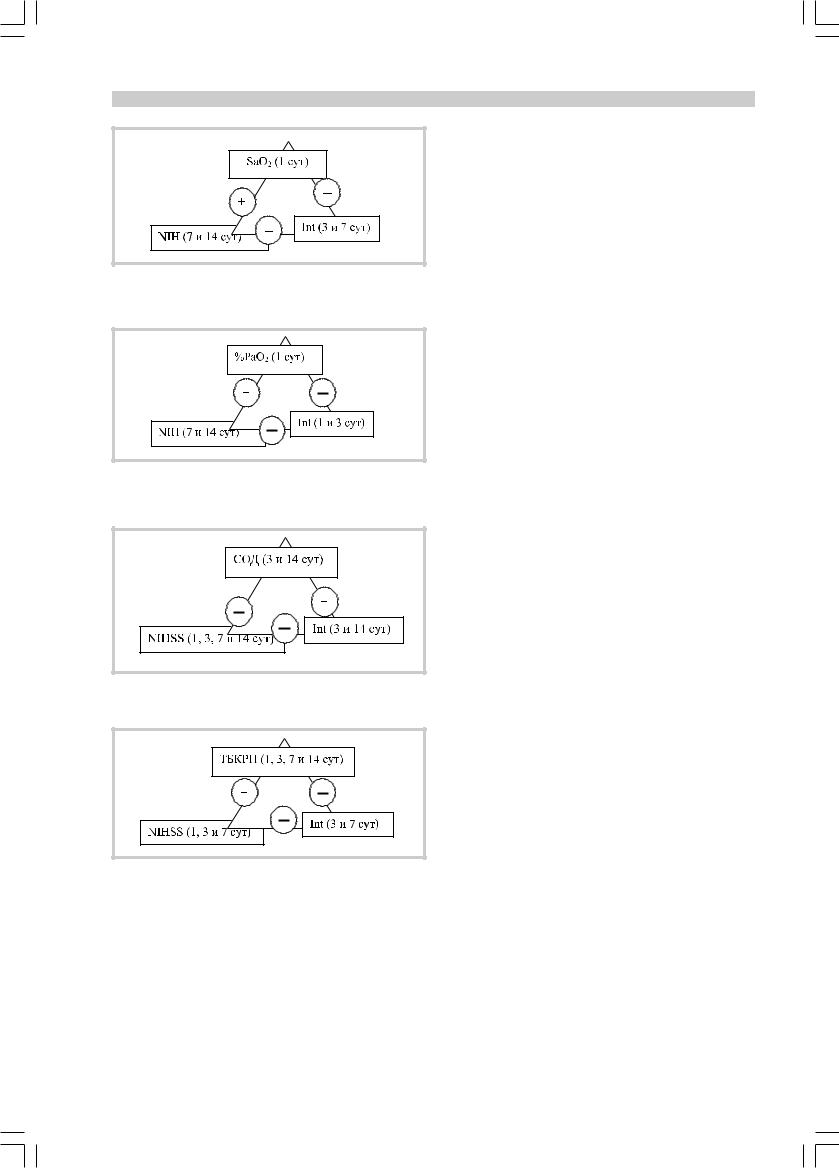
При анализе зависимостей между баллом по NIHSS и интегральным показателем ЭЭГ (Int=βα/θ∆) были установлены тесные отрицательные связи во все моменты исследования как для интактного, так и для пораженного полушария головного мозга (r=–0,6; p<0,01). Таким образом, было подтверждено, что чем тяжелее инсульт (выше балл по NIH), тем ниже интегральный показатель ЭЭГ, отражающий соотношение основных ритмов ЭЭГ и патологических медленных ритмов.
Рис. 5. Концентрация ТБКРП у больных с инсультом разной |
тяжести. |
* — р<0,05, ** — р<0,01 по сравнению с контролем; ^ — р<0,01 по |
сравнению с группой тяжелых больных. |
При анализе зависимостей показателей кислородного статуса и клинико-электроэнцефалографических характеристик больных были выявлены прямые корреляции между SaO2 в 1-е сутки инсульта и баллом по NIHSS на 7-е (r=0,8; р<0,01) и обратные (r=–0,8; р<0,01) между SaO2 в 1-е сутки и Int (для обоих полушарий) на 7-е (рис. 8). Кроме того, установлены корреляции между SaO2 в 1-е сутки и баллом по NIHSS на 14-е (r=0,7; р<0,05); SaO2 в 1-е сутки и Int для пораженного полушария мозга на 3-и (r=–0,8; р<0,05) и 7-е сутки (r=–0,9; р<0,01).
Рис. 6. Концентрация ТБКРП у пациентов с разной степенью |
восстановления на 21-е сутки инсульта. |
* — р<0,01 по сравнению с контролем; # — р<0,01 по сравнению с |
группой больных c тяжелой инвалидизацией. |
Рис. 7. Активность супероксиддисмутазы у пациентов с разной степенью восстановления на 21-е сутки инсульта.
* — р<0,05; ** — р<0,01 по сравнению с группой контроля; ^ — р<0,05; ^^ — р<0,01 по сравнению с группой больных с тяжелой инвалидизацией.
34 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
ИШЕМИЧЕСКИЙ ИНСУЛЬТ
Рис. 8. Корреляции между насыщением гемоглобина артериальной крови кислородом (SaO2), баллом по NIHSS и интегральным показателем ЭЭГ (Int).
Рис. 9. Корреляции между величиной процента от расчетно- |
го напряжения кислорода в артериальной крови (%PaO2), |
баллом по NIHSS и интегральным показателем ЭЭГ. |
Рис. 10. Корреляции между активностью супероксиддисмута- |
зы, баллом по NIHSS и интегральным показателем ЭЭГ. |
Установлены связи между активностью супероксиддисмутазы на 3-и сутки инсульта и баллом по NIHSS в 1-е сутки (r=–0,4; р<0,05), активностью супероксиддисмутазы на 14-е сутки и баллом по NIHSS на 3, 7 и 14-е сутки (r=–0,4; р<0,05); между активностью супероксиддисмутазы на 14-е сутки и Int как для пораженного, так и для интактного полушария мозга на 3-и (r=0,6; р<0,01), активностью супероксиддисмутазы на 3-и сутки и Int (для обоих полушарий) на 14-е (r=0,6; р<0,01) (рис. 10).
Более тесные связи определены между концентрацией ТБКРП и Int: концентрацией ТБКРП в 1-е, на 3, 7 и 14-е сутки инсульта и Int как для пораженного, так и для здорового полушария на 3-и сутки (r=–0,5; р<0,01); концентрацией ТБКРП в 1-е сутки и Int для пораженного полушария на 7-е (r=–0,4; р<0,01); концентрацией ТБКРП на 7-е сутки и баллом по NIHSS в 1-е, на 3-и и 7-е сутки (r=0,5; р<0,01) (рис. 11).
Кроме того, установлены зависимости между % PaO2 на 3-и сутки и активностью супероксиддисмутазы на 7-е сутки (r=–0,8; р<0,05); PaO2 è SaO2 на 3-и сутки и активностью супероксиддисмутазы на 14-е (r=–0,9; р<0,05); PaO2 è SaO2 на 3-и сутки и концентрацией ТБКРП на 14-е (r=0,9; р<0,05).
Полученные корреляции свидетельствуют о том, что повышение SaO2 и процента от расчетного PaO2 в 1-е сутки инсульта соотносится с преобладанием патологических медленных ритмов ЭЭГ над основными и с более тяжелым течением инсульта (выше балл по шкале NIH). Кроме того, сохранение высоких значений PaO2, SaO2 è %PaO2 на 3-и сутки инсульта связано со снижением активности супероксиддисмутазы и повышением концентрации ТБКРП. Последние в свою очередь тесно коррелируют как с тяжестью инсульта, так и с интегральным показателем ЭЭГ.
Таким образом, относительная гипероксия отрицательно влияет на биоэлектрическую активность мозга и течение инсульта по причине активации процессов оксидантного стресса.
|
Выводы |
|
1. У больных в остром периоде ишемического ин- |
|
сульта имеется гипервентиляционный синдром, со- |
|
провождающийся относительной гипероксией, ко- |
|
торая максимально выражена в 1-е и на 3-и сутки |
|
заболевания (увеличение PaO2 на 20 и 16% соответ- |
|
ственно). |
|
2. Относительная гипероксия в 1-е и на 3-и сутки |
Рис. 11. Корреляции между концентрацией ТБКРП, баллом |
инсульта является неблагоприятным патогенетиче- |
ским и прогностическим фактором, отрицательно |
|
по NIHSS и интегральным показателем ЭЭГ. |
влияющим как на клиническую картину заболевания |
|
|
|
(r=0,8; р<0,001), так и на биоэлектрическую актив- |
Выявлены также связи между величиной процен- |
ность головного мозга (r=–0,8; р<0,001). |
та от расчетного PaO2 (% PaO2): % PaO2 в 1-е сутки и |
3. У больных в остром периоде ишемического ин- |
áàëë ïî NIHSS íà 7-å (r=0,8; ð<0,05) è 14-å (r=0,7; |
сульта наблюдаются снижение по сравнению с кон- |
ð<0,05); % PaO2 в 1-е сутки и Int для пораженного |
тролем активности ферментов антиоксидантной сис- |
полушария в 1-е сутки (r=–0,9; p<0,01), а также Int |
темы и концентрации восстановленного глутатиона, |
для пораженного и здорового полушарий мозга на 3-и |
а также нарастание концентрации ТБКРП в перифе- |
сутки (r=–0,9; р<0,01 и r=–0,8; р<0,05 соответствен- |
рической крови, более выраженное при тяжелом ин- |
íî) (ðèñ. 9). |
сульте (р<0,05). |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
35 |

ЭКСПЕРИМЕНТАЛЬНО-ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ |
|
4. Снижение активности супероксиддисмутазы в |
6. В остром периоде инсульта происходит повы- |
периферической крови менее 185 Ед/Hb с первых су- |
шение активности ЩФ лимфоцитов, максимально |
ток инсульта и сохранение ее на низком уровне к 7-м |
выраженное на 3-и сутки, что отражает интенсив- |
и 14-м суткам дает основание прогнозировать плохое |
ность воспалительных процессов при ишемическом |
восстановление неврологических функций к 21-му |
повреждении мозга. Снижение этого показателя на |
дню заболевания (индекс Бартел менее 35). Повыше- |
7-е сутки менее 18,2 усл.ед. позволяет прогнозировать |
ние концентрации ТБКРП в периферической крови |
хорошее функциональное восстановление к 21-му дню |
более 5,4 нмоль/мл с первых суток заболевания со- |
инсульта (индекс Бартел более 65). |
провождает тяжелое течение инсульта; сохранение |
Таким образом, относительная гипероксия в ус- |
высокой концентрации ТБКРП к 14-м суткам соот- |
ловиях скомпрометированной ишемическим повре- |
носится с плохим восстановлением неврологических |
ждением антиоксидантной системы приводит к па- |
функций к 21-м суткам (индекс Бартел менее 35). |
тологическому пути утилизации кислорода — обра- |
5. У больных в остром периоде с первых 12—24 ч |
зованию его активных форм в результате развития |
инсульта снижается активность СДГ (до 16% по срав- |
цитотоксической (биоэнергетической) гипоксии. В |
нению с контролем; р<0,01) и повышается активность |
связи с этим, больным в остром периоде ишемиче- |
α-ГФДГ в 2,8 раза против контроля (p<0,01). Актив- |
ского инсульта, не осложненного нарушениями функ- |
ность α-ГФДГ более 182,6 усл.ед. (р<0,01 по сравне- |
ций внешнего дыхания и газотранспортной функции |
нию с контролем и с группой больных с тяжелым |
крови, не показано рутинное проведение оксигено- |
инсультом) на 3-и сутки заболевания сопровождает |
терапии. С целью предупреждения гипоксемии целе- |
среднетяжелое течение заболевания. |
сообразно проводить неинвазивный мониторинг SaO2. |
ЛИТЕРАТУРА
1. Алексеева Г.В., Гурвич А.М., Семченко В.В. Постреанимационная |
8. Морган мл. Дж.Э., Мэгид С.М. Клиническая анестезиология. М: |
|
БИНОМ 2001. |
||
энцефалопатия. Омск 2002. |
||
|
2.Гланц С. Медико-биологическая статистика. М: Практика 1999. 9. Неговский Н.А. Неврологические аспекты реаниматологии. М
3.Гусев Е.И., Скворцова В.И. Ишемия головного мозга. М: Медицина 2001.
4.Загурский А.А. Щелочная фосфатаза клеток человека, культивируемых in vitro: активность, свойства и их роль в клеточной регуляции: Автореф. дис. ... канд. биол. наук. М 1986.
5.Комисарова И.А. Применение цитохимических методов исследования лейкоцитов крови для оценки состояния больных в острый период ишемического инсульта. Клинико-лабораторный консилиум. М 2004; 2: 9—13.
6.Лукьянова Л.Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции. Бюл экспер биол 1997; 124: 9.
7.Методические рекомендации по профилактике и лечению инсульта. Европейская инициативная группа по проблеме инсульта. М 2003.
1991.
10.Рябов Г.А. Гипоксия критических состояний. М: Медицина 1988.
11.Скворцова В.И., Раевский К.С., Коваленко А.В. и др. Журн неврол и психиат 1999; 99: 2.
12.Соколов В.В., Нарциссов Р.П., Иванова Л.А. Цитохимия ферментов в профпатологии. М: Медицина 1975.
13.Царенко С.В. Нейрореаниматология. Интенсивная терапия че- репно-мозговой травмы. М: Медицина 2005.
14.Nelson D.L., Cox M.M. Leninger principles of biochemistry 4-th ed.W.H. Freeman & Company N.Y. 1119.
15.Nicholls D.G., Budd S.L. Mitochondria and neuronal survival. Physiological Rev 2000; 80, 315—360.
36 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
