
Журнал неврологии и психиатрии / 2007 / NEV_2007_01_01
.pdf
КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Прогноз синдрома мягкого когнитивного снижения по данным двухлетнего клинико-катамнестического исследования
С.И. ГАВРИЛОВА, Я.Б. ФЕДОРОВА, И.Ф. РОЩИНА, Г.И. КОРОВАЙЦЕВА
Prognosis of the syndrome of mild cognitive impairment: the data of the biennial follow-up study
S.I. GAVRILOVA, YA.B. FEDOROVA, I.F. ROSHCHINA, G.I. KOROVAITSEVA
Научный центр психического здоровья РАМН, Москва
Изучали психопатологическую структуру и прогностическое значение синдрома мягкого когнитивного снижения (MCI). Для этой цели провели 2-летнее проспективное исследование рандомизированной когорты пожилых людей, психическое состояние которых соответствовало критериям MCI. Обследовали 40 пациентов в возрасте от 50 до 80 лет. Проведено клиническое катамнестическое, нейропсихологическое, психометрическое, генетическое обследование (АроЕ генотипирование), а также прижизненная визуализация структур головного мозга. Представлены психопатологическая структура, а также психометрические характеристики синдрома MCI. Выделены клинические и генетические факторы, имеющие прогностическое значение.
Ключевые слова: синдром мягкого когнитивного снижения, болезнь Альцгеймера, АроЕ генотип.
Structure and prognostic significance of the syndrome of mild cognitive impairment (MCI) were studied in a prospective biennial study of a randomized cohort of elderly people meeting current MCI criteria. The study comprised 40 patients aged from 50 to 80 years. Clinical follow up study included psychopathological, psychometric, neuropsychological, neuroimaging and molecular genetic (ApoE genotyping) examinations were made. Psychopathological structure and psychometric characteristics of the MCI syndrome are described, and clinical and genetic factors of prognostic value are singled out.
Key words: the syndrome of mild cognitive impairment, Alzheimer’s disease, ApoE4 genotype.
Проблема доклинической диагностики болезни |
|
нием когнитивных функций, которое представляет |
|
Альцгеймера (БА) приобретает все большую научную |
собой промежуточную стадию между возрастной нор- |
||
и практическую значимость по мере расширения воз- |
мой и деменцией и имеет повышенный риск перехо- |
||
можностей патогенетической терапии этого заболе- |
да в деменцию в течение ближайших 3—5 лет, а так- |
||
вания. Быстрый прогресс в развитии методов патоге- |
же выявить и в перспективе сделать объектом пре- |
||
нетического воздействия на базисные механизмы ней- |
вентивной терапии наиболее раннюю (доклиниче- |
||
родегенерации альцгеймеровского типа делает впол- |
скую) стадию развивающейся деменции [13]. Особую |
||
не реалистичными ожидания скорой разработки так- |
важность в связи с масштабом проблемы приобрета- |
||
же и превентивных направлений ее терапии, что в |
ет распознавание синдрома MCI предположительно |
||
свою очередь ставит вопрос об объекте будущего пре- |
альцгеймеровского типа, т.е. доклинического этапа |
||
вентивного терапевтического вмешательства. В связи |
развития БА. B. Dubois и M. Albert [11] недавно пред- |
||
с тем, что обусловленная первичным нейродегенера- |
ложили усовершенствованные критерии диагности- |
||
тивным процессом деменция имеет малозаметное |
ки синдрома MCI, включающие: 1) жалобы пациен- |
||
начало и в течение длительного времени (месяцы или |
та или членов его семьи на ухудшение памяти, под- |
||
даже годы) может оставаться нераспознанной, зада- |
твержденное с помощью тестирования; 2) отсутст- |
||
ча идентификации проявлений прогрессирующего |
вие данных за наличие синдрома деменции; 3) ис- |
||
когнитивного дефицита и отграничение этих состоя- |
ключение вероятной связи когнитивного дефицита с |
||
ний от когнитивного снижения непрогредиентного |
какими-либо иными состояниями, потенциально от- |
||
характера приобретает особую актуальность и прак- |
ветственными за когнитивное снижение; 4) данные |
||
тическую значимость. |
о том, что когнитивная недостаточность имеет про- |
||
Современная исследовательская концепция мяг- |
грессирующий характер. |
||
кого когнитивного снижения — «mild cognitive im- |
Распространенность синдрома MCI в популяции |
||
pairment» (MCI)1 создана из-за необходимости иден- |
лиц в возрасте 65 лет и старше колеблется по разным |
||
тифицировать категорию пациентов с таким ухудше- |
данным в диапазоне от 11 до 20% [1]. Установлено, |
||
|
|
|
|
|
|
1 Из-за несовпадений в русскоязычной терминологии мы |
|
© Коллектив авторов, 2007 |
|
||
|
|
пользуемся соответствующей аббревиатурой от англ. ориги- |
|
Zh Nevrol Psikhiatr Im SS Korsakova 2007;107:1:4—10 |
нального наименования. |
||
4 |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
|

что от 3 до 15% случаев MCI в течение одного года трансформируются в деменцию. За 6 лет до 80% таких лиц получают диагноз болезни Альцгеймера [1, 4].
Большинство исследователей сходятся во мнении о том, что синдром MCI в его настоящих диагности- ческих границах является гетерогенным как по своей клинической картине, так и по особенностям тече- ния. По предложению R. Petersen [16—20] выделены 3 основных клинических варианта синдрома MCI: 1) амнестический вариант, который встречается наиболее часто и отличается преобладанием в клиниче- ской картине нарушений памяти на текущие события; у значительной части таких пациентов развивается в дальнейшем болезнь Альцгеймера; 2) синдром MCI с множественной легкой когнитивной недостаточностью, характеризующийся сочетанным поражением нескольких когнитивных функций; он может встречаться на начальных стадиях различных заболеваний головного мозга, в том числе при болезни Альцгеймера, сосудистой деменции, лобно-височной дегенерации и др.; 3) синдром MCI с избирательным нарушением какой-либо одной когнитивной функции при сохранной функции памяти. Полагают, что этот наиболее редкий вариант синдрома может быть дебютом первичной прогрессирующей афазии или вариантом болезни Альцгеймера. Однако до сих пор нет полной ясности в критериях отнесения наблюдаемого у пожилых мягкого когнитивного снижения к одному из вариантов синдрома, как и аргументированных данных об их прогностической значимости.
Целью настоящего исследования было изучение психопатологической структуры и определение прогностической значимости синдрома MCI на основании проспективного (в течение 2 лет) исследования невыборочной когорты пожилых людей, соответствующих современным критериям его диагностики.
Материал и методы
В когорту проспективного исследования включа- лись пациенты в возрасте 50 лет и старше, которые соответствовали приведенным ниже операциональным критериям, основанным на соглашении международной исследовательской группы по MCI [22], т.е. на основании предъявляемых пациентом и подтверждаемых объективным информантом жалоб на снижение памяти и/или легкие когнитивные нарушения, которые можно было подтвердить с помощью нейропсихологического тестирования; выраженность когнитивного снижения должна соответствовать оценке >24 баллов по шкале MMSE [12], оценке <1 по шкале тяжести деменции (Clinical Dementia Rating — CDR) [15] и 1—3 стадии по шкале общего ухудшения — Global Deterioration Scale — GDS [23]; повседневная активность пациентов должна оставаться сохранной, хотя возможно легкое ухудшение в наиболее сложных видах повседневной или социальной активности; диагноз деменции в соответствии с критериями МКБ10 не может быть поставлен.
Критериями исключения являлись любые неврологические, психические или соматические заболевания, которые могли быть ответственны за когнитивную недостаточность пациента.
МЯГКОЕ КОГНИТИВНОЕ СНИЖЕНИЕ
Работа была основана на применении мультидисциплинарного методического подхода, включающего клинико-катамнестический, психопатологический, психометрический, нейропсихологический, нейроинтраскопический (рентгеновская и магнитно-резонанс- ная компьютерная терапия — КТ и МРТ) и молеку- лярно-генетический (определение генотипа АпоЕ4) методы исследования.
Для первичной и динамической оценки состояния когнитивных функций пациентов применялись следующие психометрические тесты и клинические шкалы: мини-тест психического состояния (MMSE), батарея тестов на выявление лобной дисфункции (Frontal Assessment Battery — FAB) [10], тест рисования часов (Clock Drawing Test — CDT) [24], тест воспроизведения «10 слов» [5, 6], тест «Узнавание рисунков» [5, 6], Бостонский тест называния (Boston Naming Test — BNT) [14], тесты «Повторение цифр» и «Звуковые ассоциации» из шкалы Векслера для взрослых [25].
Для исключения вероятной связи когнитивного снижения с церебрально-сосудистой патологией или
ñдепрессивными расстройствами в дополнение к клиническим методам использовались модифицированная шкала Хачинского (Modified Hachinski Ischemia Scale — MIS) [8] и Гериатрическая шкала депрессии (Geriatric Depression Scale — GDeprS) [26].
Состояние высших психических функций (ВПФ) у всех включенных в когорту лиц также оценивалось
ñприменением нейропсихологического подхода, основанного на адаптированной для данного контингента пациентов методике А.Р. Лурии. Использовалась шкала количественной оценки степени выраженности нарушений различных составляющих (трех блоков) психической деятельности [7]2.
Для исключения объемных образований, воспалительных, травматических повреждений головного мозга, оценки степени расширения ликворной системы и выраженности очаговых (сосудистых) изменений проводилась МРТ головного мозга. МРТ у пациентов обследованной когорты характеризовалась преимущественно слабой или реже умеренной наружной и внутренней сообщающейся гидроцефалией. У 24 пациентов, кроме того, были выявлены единич- ные мелкоочаговые изменения в подкорковых структурах.
Для оценки значимости генетического фактора риска по БА — генотипа АпоЕ4 (+) для прогноза синдрома MCI было проведено генетическое исследование3. Геномная ДНК выделялась из лейкоцитов периферической крови с помощью стандартной методики фенол/хлороформной экстракции. Генотипирование АпоЕ4 аллелей проводилось методом полимеразной цепной реакции по стандартной процедуре [3].
2 Эта часть исследования выполнялась под руководством канд. психол. наук И.Ф. Рощиной, однако эти данные будут рассмотрены в отдельной публикации.
3 Это исследование осуществлялось канд. биол. наук Г.И. Коровайцевой в лаборатории клинической генетики Науч- ного центра психического здоровья РАМН.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
5 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
Анамнестические сведения на всех пациентов восстанавливались ретроспективно на основании данных, полученных как с их слов, так и от одного или двух объективных информантов, а также из имеющейся медицинской документации (амбулаторные карты поликлиник, истории болезни или выписки сомати- ческих стационаров).
Âсоответствии с указанными критериями отбора
âкогорту проспективного исследования были вклю- чены 40 пожилых лиц (12 мужчин и 28 женщин) в возрасте от 50 до 80 лет (средний возраст 69,3±7,2 года), отобранных из числа пациентов, обратившихся за консультативной помощью в Центр по изуче- нию болезни Альцгеймера и ассоциированных с ней расстройств Научного центра психического здоровья РАМН. Большинство пациентов (24 человека) были в возрасте от 65 до 74 лет. Втрое меньшее число больных (по 8 человек) относились к возрастным группам от 50 до 64 лет и от 75 до 80 лет.
Большинство включенных в исследование пациентов (30) имели высшее образование, остальные — среднее специальное образование. 13 человек на момент первичного обследования занимались трудовой деятельностью, причем 11 из них работали по специальности и лишь 2 человека занимались малоквалифицированным трудом. Остальные пациенты были пенсионерами по возрасту или по инвалидности второй группы по соматическому заболеванию.
При исследовании генотипа АпоЕ было установлено, что 21 пациент (7 мужчин и 14 женщин) имел вариант гена, содержащий аллель Е4 [АроЕ4 (+)] и у 19 (5 мужчин и 14 женщин) отсутствовал аллель Е4 [АроЕ4 (–)]4.
Результаты и обсуждение
При первичном исследовании клиническая картина синдрома MCI у включенных в исследование пациентов определялась широким спектром легких когнитивных дисфункций, в целом соответствующих тем, которые характерны для доклинического этапа течения БА [2, 9]. Для всех без исключения пациентов были характерны дисмнестические расстройства, преимущественно нарушения запоминания новой информации и воспроизведения событий недавнего прошлого. Кроме того, у всех пациентов были выявлены легкие когнитивные дисфункции, которые охватывали разные сферы когнитивной деятельности, в том числе функции речи, праксиса, оптико-про- странственной деятельности, счета, письма, внимания и собственно интеллектуальной, т.е. аналитикосинтетической деятельности. Таким образом, тип синдрома MCI у включенных в исследование пациентов можно квалифицировать как амнестический или комбинированный (амнестический и мультифункциональный) в соответствии с типологией, предложенной R. Petersen [21].
У 12 из 40 пациентов, помимо когнитивных дисфункций, при первичном обследовании были выявле-
4 В связи с малочисленностью клинической выборки статистическая обработка результатов в этом случае не проводилась.
ны легкие аффективные нарушения: пониженное настроение, в основном ситуационно обусловленное (в связи со служебной или семейной ситуацией или в связи с появившимися когнитивными дисфункциями).
Гипотимический аффект сопровождался снижением психической и физической активности, ограничением контактов с друзьями, коллегами и родственниками. Длительность таких состояний до вклю- чения пациентов в исследование была различной: от 1 мес до 1 года. У 6 включенных в когорту пациентов выявлялись псевдоневрастенические расстройства в виде повышенной утомляемости, непереносимости обычных нагрузок, постоянного отсутствия бодрости, повышенной чувствительности к внешним раздражителям, жалоб на периодические головные боли и снижение работоспособности. В части случаев псевдоневрастенические расстройства сочетались со сниженным настроением, раздражительностью, плаксивостью.
У 15 из 40 пациентов при первичном обследовании были выявлены нерезко выраженные характерологические изменения или черты нивелировки свойственных пациентам ранее личностных особенностей, причем в ряде случаев характерологические изменения сочетались с дистимическим аффектом. Личностные изменения у 6 из 15 пациентов носили характер психопатоподобных, они определялись возбудимостью, вспыльчивостью, требовательностью, нетерпимостью к возражениям, обидчивостью. Сглаживание личностных особенностей (1 человек) в виде ослабления эмоциональных привязанностей, появления равнодушия к близким, безразличия к своему внешнему виду сочеталось со снижением прежних интересов и активности. У 8 человек личностные изменения приближались к сенильноподобным, хотя и носили относительно маловыраженный характер. Для этих пациентов было характерно появление придирчивости, мелочности, эгоистичности, не свойственной им ранее. Признаки сенильноподобного личностного сдвига в основном выявлялись у пациентов в возрасте старше 65 лет, тогда как психопатоподобные характерологические изменения главным образом встре- чались у лиц, не достигших 65-летнего возраста.
Катамнестический период наблюдения за когортой пациентов составил 2 года. За этот период 4 человека выпали из исследования по причинам немедицинского характера, поэтому анализ данных проспективного исследования приводится для 36 человек.
По данным катамнестической оценки, состояния этих пациентов были выделены в 2 группы: 1-я группа состояла из 23 пациентов, у которых на протяжении 2 лет не наблюдалось нарастания когнитивного дефицита или признаков функционального снижения; 2-ю группу составили 13 пациентов, у которых за 2 года произошло нарастание когнитивного дефицита. В качестве критериев прогрессирования когнитивного снижения рассматривалось нарастание признаков функциональной недостаточности в повседневной, социальной или профессиональной сфере по данным объективной катамнестической оценки в сочетании с наличием двух и более перечисленных ниже признаков: 1) снижение оценки по MMSE на 1 балл и более; 2) снижение оценки в Бостонском тесте назы-
6 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
|
МЯГКОЕ КОГНИТИВНОЕ СНИЖЕНИЕ |
вания более чем на 1 балл; 3) снижение оценки в тес- |
агностирована БА, напротив, установлено статисти- |
те рисования часов на 1 балл и более; 4) снижение |
чески значимое ухудшение показателей практически |
суммарной оценки нарушений ВПФ по данным нейро- |
по всем психометрическим тестам и шкалам. Разли- |
психологического обследования не менее чем на 0,5 |
чий по Гериатрической шкале депрессии и по моди- |
балла в любом из трех блоков мозга. У 5 пациентов 2-й |
фицированной шкале Хачинского, отражающей вы- |
группы при катамнестической оценке была диагности- |
раженность церебральной, сосудистой патологии, не |
рована деменция альцгеймеровского типа (подгруппа |
было установлено, что может служить подтвержде- |
2-А). У остальных 8 пациентов (подгруппа 2-Б), не- |
нием того, что негативная динамика когнитивных |
смотря на нарастание когнитивного дефицита, диаг- |
функций у этих пациентов не связана с нарастанием |
ноз деменции (в соответствии с критериями диагно- |
за период наблюдения выраженности депрессивных |
стики по МКБ-10) не мог быть поставлен. |
или церебрально-сосудистых расстройств. |
Подтверждением стабильного состояния пациен- |
У пациентов 2-Б подгруппы (рис. 3), у которых |
тов 1-й группы на протяжении 2-летнего периода |
наблюдалось прогрессирование когнитивного дефи- |
наблюдения служит отсутствие негативной динами- |
цита, но без перехода в деменцию, также не было |
ки в показателях тестовой оценки их когнитивного |
установлено значимых различий ни по Гериатриче- |
функционирования. На рис. 1 представлены результа- |
ской шкале депрессии, ни по модифицированной |
ты оценки в баллах (ось ординат) по основным пси- |
шкале Хачинского, что подтверждает спонтанную |
хометрическим и клиническим шкалам и тестам (ось |
отрицательную динамику когнитивного дефицита и в |
абсцисс) у пациентов 1-й группы при первичном |
этой подгруппе. В отличие от пациентов 2-А подгруп- |
обследовании и через 2 года наблюдения. Статисти- |
пы у этих пациентов достоверно ухудшились показа- |
ческая обработка проводилась с использованием про- |
тели только по 5 из 8 применявшихся когнитивных |
граммы Statistica Electronic Manual 6.0 на персональ- |
тестов и шкал, тогда как показатели теста рисования |
ном компьютере типа IBM. При статистическом ана- |
часов, теста воспроизведения 10 слов и шкалы MMSE |
лизе у этой группы пациентов не было выявлено зна- |
ухудшились только в минимальной степени. |
чимых статистических различий между исходной и |
Для установления возможных прогностических |
катамнестической оценками когнитивных тестов. Дос- |
критериев динамики синдрома MCI в течение сле- |
товерно изменились только оценки по Гериатриче- |
дующего за первичной оценкой двухлетнего периода |
ской шкале депрессии в сторону уменьшения субде- |
были проанализированы межгрупповые различия в |
прессивных симптомов, выявленных у этих пациен- |
исходных клинических и психометрических характе- |
тов при первичном обследовании. |
ристиках пациентов по традиционно используемому |
У пациентов 2-А подгруппы (рис. 2), у которых к |
для этих целей критерию Стьюдента при уровне зна- |
моменту катамнестического обследования была ди- |
чимости 0,05. Пациенты «стабильной» группы оказа- |
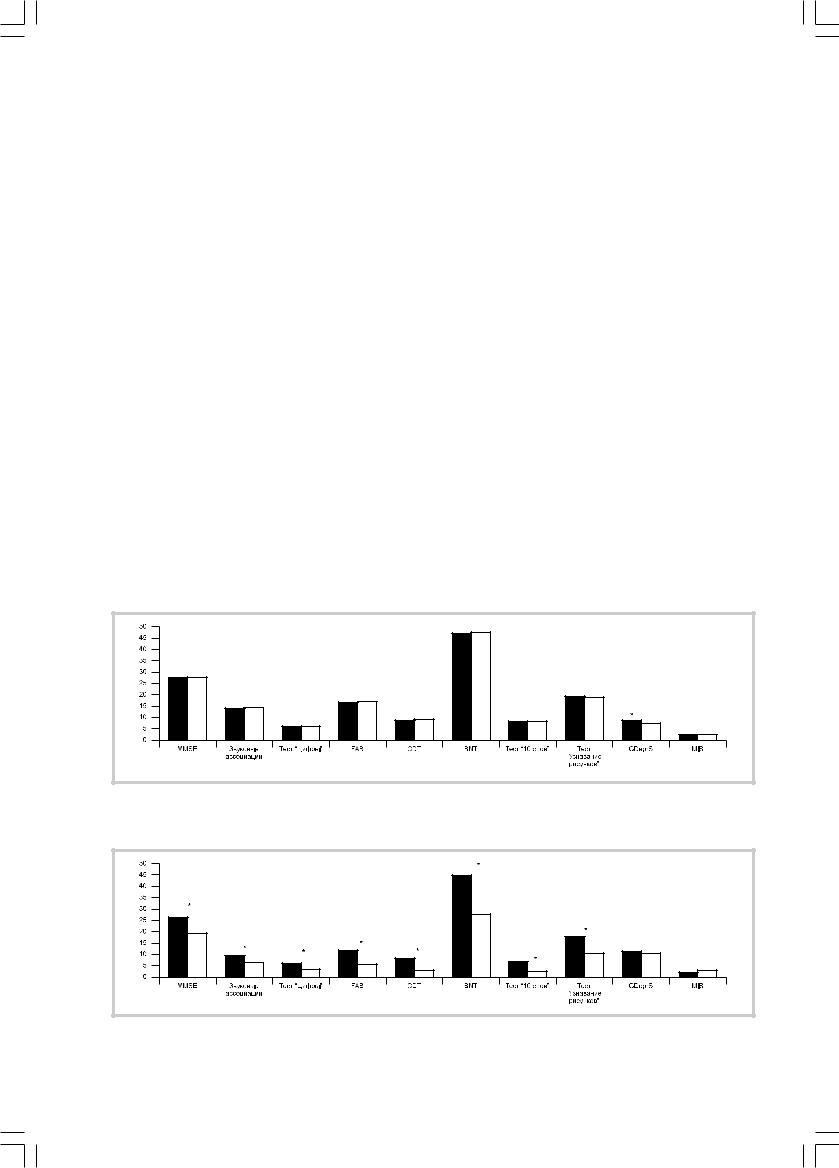
Рис. 1. Динамика клинических и психометрических показателей у пациентов 1-й группы. |
Здесь и на рис. 2 и 3: черные столбики — при включении в исследование, белые — через 2 года. По оси ординат — баллы, по оси абсцисс |
— тесты и шкалы. Звездочкой обозначены достоверные изменения по сравнению с первичным обследованием. |
Рис. 2. Динамика клинических и психометрических показателей у пациентов 2-А подгруппы. |
|
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
7 |
КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ |
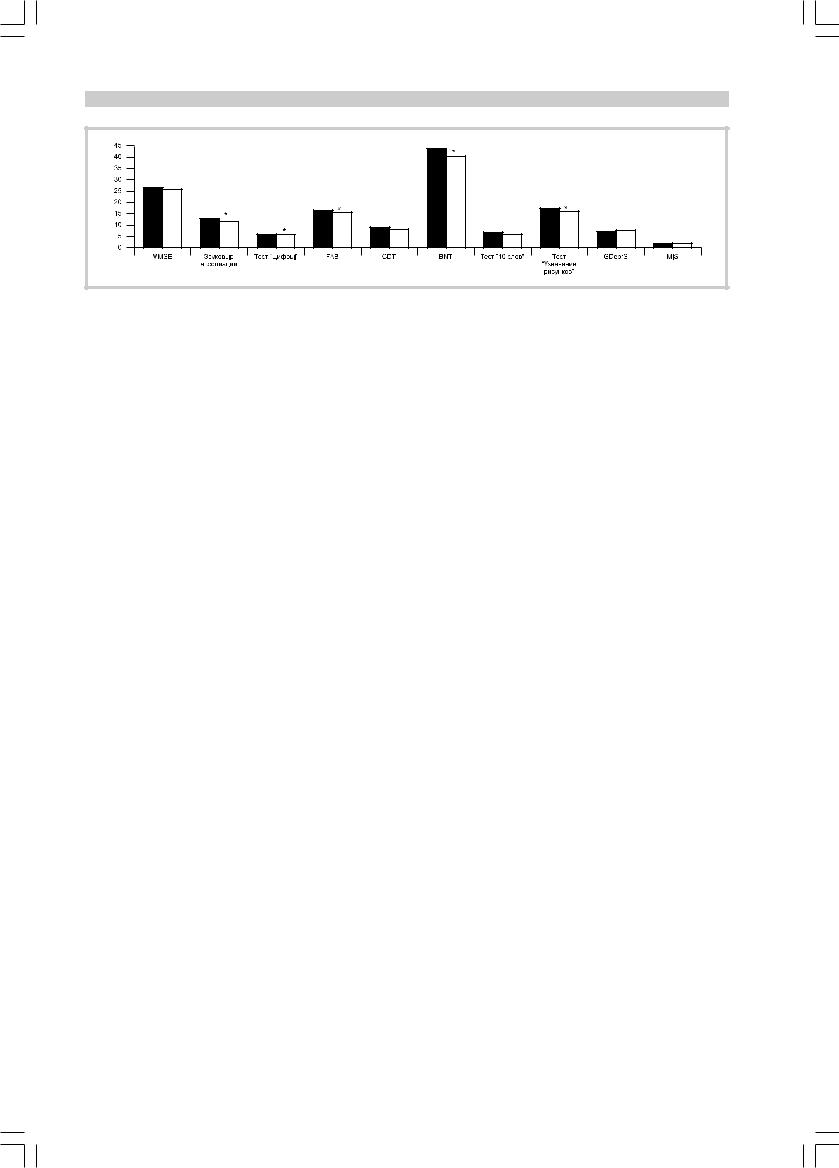
Рис. 3. Динамика клинических и психометрических показателей у пациентов 2-Б подгруппы. |
лись достоверно моложе пациентов из группы с прогрессированием когнитивного дефицита, средний возраст пациентов составил соответственно 67,7±7,1 (в 1-й группе) и 73,3±4,4 года (во 2-й). В то же время достоверных различий между 1-й группой и 2-А подгруппой не было, хотя средний возраст больных 2-А группы превышал таковой у пациентов 1-й группы (соответственно 72,0±6,2 и 67,7±7,1 года). Достоверных возрастных различий между прогрессирующей до деменции (2-А) и прогрессирующей без деменции (2-Б) подгруппах также не было (соответственно 72,0±6,2 и 74,1±3,0 года), но пациенты 2-А подгруппы оказались даже более молодыми (недостоверно) по сравнению с больными из 2-Б подгруппы.
Сравнительная характеристика исходной психопатологической структуры синдрома MCI и сравнительная частота генетического фактора риска по БА
— генотипа АпоЕ(4)+ в зависимости от 2-летней динамики синдрома представлена в таблице. Исходное функциональное состояние всех обследованных пациентов соответствовало оценке CDR — 0,5, но среднегрупповые исходные оценки по шкале MMSE у пациентов 1-й группы оказались достоверно лучшими, нежели у пациентов 2-й группы. Достоверные межгрупповые различия по модифицированной шкале Хачинского (в обеих группах показатели этой шкалы были минимальными) отсутствовали. В отличие от 1-й и 2-Б подгрупп у пациентов 2-А подгруппы исходные средние групповые показатели по шкале GDS указывали на наличие признаков субдепрессии (12,20±4,87 баллов). Признаки сенильноподобного
характерологического сдвига в структуре синдрома MCI у пациентов 2-й группы встречались в 12,5 раз чаще, нежели у пациентов 1-й группы, причем частота этого признака оказалась максимальной у пациентов 2-А подгруппы (80%). Среди пациентов 2-Б подгруппы его частота также оказалась в 8,7 раз выше, нежели у пациентов 1-й (стабильной) группы (соответственно 37,5 и 4,3%).
При исследовании частоты генотипов АпоЕ, содержащих аллель Е4, было установлено, что в случае прогрессирующего течения синдрома генотип АпоЕ с Е4 аллелем выявлялся у пациентов 2-А и 2-Б подгрупп соответственно в 2,0 и 1,9 раза чаще, нежели у пациентов 1-й группы.
Для определения 2-летней прогностической зна- чимости исходной тестовой оценки когнитивных функций был проведен дополнительный статистиче- ский анализ их внутригрупповых различий по всем изучавшимся психометрическим параметрам. Достоверные различия исходных психометрических показателей между 1-й (стабильной) группой и прогрессирующей до деменции (2-А) подгруппой были установлены, помимо ранее упоминавшейся шкалы MMSE (соответственно 28±0,9 и 26,6±0,6; р=0,003), также в тестах FAB (соответственно 16,7±0,8 и 12±2,4; p=0,00001), CDT (соответственно 9,5±0,9 и 8,5±1,0; p=0,03) и «Звуковые ассоциации» (соответственно 14,6±3,5 и 9,6±4,0; р=0,009). При сравнении 1-й группы и 2-Б подгруппы достоверные различия выявлены только по шкале MMSE (соответственно 28±0,9 и 26,4±0,8; р=0,001) и тесту «Воспроизведение 10 слов»
Сравнительная характеристика |
исходной психопатологической |
структуры |
синдрома |
MCI è |
частоты |
генотипа |
ÀïîÅ4(+) |
|||
в зависимости от 2-летней динамики когнитивного дефицита |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сенильно- |
|
|
|
|
|
Возраст, |
MMSE, |
MIS, |
GDeprS, |
подобный |
|
АпоЕ4 генотип |
|||
|
характерологи- |
|||||||||
Группа |
ãîäû |
баллы, |
баллы, |
баллы, |
|
|
||||
ческий сдвиг |
|
|
|
|||||||
|
̱SD |
̱SD |
̱SD |
̱SD |
|
|
|
|||
|
|
|
|
|
|
|
||||
|
|
|
|
|
àáñ. |
% |
|
àáñ. |
% |
|
|
|
|
|
|
|
|
|
|
|
|
1-ÿ (n=23) |
67,7±7,1 |
28±0,9 |
2,0±0,8 |
9,09±4,1 |
1 |
4,3 |
|
9 |
39,1 |
|
2-ÿ (n=13) |
73,3±4,4* |
26,5±0,7* |
1,9±1,0 |
9,08±4,2 |
7 |
53,8 |
|
10 |
76,9 |
|
2-А подгруппа (n=5) |
72,0±6,2 |
26,6±0,6** |
2,0±1,4 |
12,20±4,9 |
4 |
80 |
|
4 |
80 |
|
2-Б подгруппа (n=8) |
74,1±3,0*** |
26,4±0,8*** |
1,8±0,7 |
7,13±2,2 |
3 |
37,5 |
|
6 |
75 |
|
|
|
|
|
|
|
|
|
|
|
|
Примечание. * — достоверные различия (р<0,05) между 1-й и 2-й группой; ** — достоверные различия (р<0,05) между 1-й группой и 2-А подгруппой; *** — достоверные различия (р<0,05) между 1-й группой и 2-Б подгруппой.
8 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |

МЯГКОЕ КОГНИТИВНОЕ СНИЖЕНИЕ
(соответственно 8,1±1,2 и 6,8±1,3; р=0,01). Таким образом, как наиболее прогностически значимые психометрические тесты, коррелирующие с вероятностью развития деменции у лиц с синдромом MCI в тече- ние ближайших 2 лет были определены тесты FAB, CDT, тест «Звуковые ассоциации».
Оценка прогностической значимости медикаментозного лечения не входила в задачи настоящего исследования. Однако для достоверности полученных результатов мы сравнили 2-летний исход синдрома MCI у пациентов, получивших в начале исследования курс 6-месячной терапии препаратом танакан (EGb 761) в дозах 80 мг 3 раза в день (внутрь) и у пациентов, не получавших такого лечения. На начальном этапе терапии была установлена достоверная позитивная терапевтическая динамика по всем применявшимся шкалам и тестам5. Однако катамнести- ческое исследование показало, что проведение такого курса терапии не оказало влияния на отдаленный исход. Среди больных с прогрессированием когнитивного дефицита доля лиц, получавших на начальном этапе исследования 6-месячную терапию танаканом, оказалась выше, нежели в группе пациентов со «стабилизацией» состояния. По-видимому, для получения позитивного профилактического эффекта в течение последующих 1,5 лет было необходимо проведение повторных курсов такой терапии или непрерывный пролонгированный прием танакана. Изучение этого вопроса требует проведения специального долговременного исследования.
Таким образом, анализ психопатологической структуры, клинических и психометрических характеристик пациентов, соответствующих международным критериям диагностики синдрома MCI, показал клиническую и генетическую неоднородность этого синдрома. Двухлетний катамнез когорты таких пациентов обнаружил различную динамику когнитивного и функционального дефицита: от стабилизации со-
5 См. статью «Опыт клинического применения танакана в лечении синдрома мягкого когнитивного снижения», авторы — С.И. Гаврилова и соавт. Журн неврол и психиат 2006; 106: 10: 42—46.
стояния (63,9% от общего числа катамнезированных пациентов) до развития деменции альцгеймеровского типа (13,9%). У остальных 22,2% пациентов наблюдалось прогрессирование когнитивного дефицита, которое за период наблюдения не достигло уровня деменции.
Анализ исходных межгрупповых различий у пациентов с разной динамикой синдрома MCI позволил установить неблагоприятные прогностические характеристики синдрома. Пациенты с прогрессированием когнитивного дефицита в течение ближайших 2 лет (2-я группа) достоверно старше по возрасту, нежели лица со стабильным состоянием когнитивных функций. Однако достоверных различий по возрасту между пациентами с развившейся на протяжении 2-летнего периода деменцией (2-А подгруппа) и у больных, не достигших уровня деменции (2-Б подгруппа), не было установлено. Пациенты, у которых спустя 2 года был поставлен диагноз БА, отличались от «стабильной» группы 19-кратно большей частотой присутствия в структуре синдрома признаков сенильноподобного характерологического сдвига (соответственно 80 и 4,3%), а также вдвое большей частотой варианта АпоЕ4(+) соответственно 80 и 39,1%. По исходным психометрическим характеристикам достоверные различия между стабильным и прогрессирующим до деменции вариантами синдрома MCI установлены только по четырем из восьми применявшихся психометрических тестов: MMSE, батарее лобной дисфункции, тесту рисования часов и тесту «Звуковые ассоциации», причем наиболее значимыми из них следует считать показатели батареи лобной дисфункции.
Выявленные различия позволяют рассматривать пожилых пациентов с синдромом MCI, имеющих аллель Е4, в генотипе АпоЕ, признаки сенильноподобного характерологического сдвига в структуре синдрома, оценку по шкале MMSE ниже 27 баллов, а также снижение показателей по упомянутым выше трем психометрическим тестам (FAB, CDT и «Звуковые ассоциации») как группу максимального риска по развитию БА или как пациентов с доклиническим этапом течения БА. По отношению к таким пациентам, по-видимому, должны применяться те же терапевтические подходы, что и к больным с БА.
ЛИТЕРАТУРА
1.Гаврилова С.И. Фармакотерапия болезни Альцгеймера. М: Пульс 2003; 319.
2.Калын Я.Б. Клиника инициальных проявлений и последующего те- чения сенильной деменции: Автореф. дис. ...…канд. мед. наук. М 1990.
3.Коровайцева Г.И., Щербатых Т.В., Селезнева Н.Д. и др. Генетиче- ская ассоциация между аллелями гена аполипопротеина Е (АпоЕ) и различными формами болезни Альцгеймера. Генетика 2001; 37: 4: 529—535.
4.Курц А. Синдром мягкого когнитивного снижения. Российская конференция «Болезнь Альцгеймера и старение: от нейробиологии к терапии», 2-я: Материалы. М 1999.
5.Лурия А.Р. Основы нейропсихологии. Лурия А.Р. М: МГУ 1973.
6.Лурия А.Р. Высшие корковые функции человека и их нарушение при локальных повреждениях мозга. М: МГУ 1962; 1: 1969; 2. М: Академ проект 2000; 3.
7.Рощина И.Ф., Жариков Г.А. Нейропсихологический подход в диагностике мягкой деменции у лиц пожилого и старческого возраста. Журн неврол и психиат 1998; 2: 34—40.
8.Руководство по психиатрии. Под ред. А.С. Тиганова. М: Медицина 1999; 1: 246—247.
9.Селезнева Н.Д. Сравнительно-возрастные особенности клиники и течения болезни Альцгеймера: Автореф. дис. ...…канд. мед. наук. М 1990.
10.Dubois B., Slachevsky A., Litvan I., Pillon B. A frontal assessment battery at bedside. Neurology 2000; 55: 1621—1626.
11.Dubois B., Albert M.L. Amnestic MCI or prodromal Alzheimer’s disease. Lancet Neurology 2004; 3: 246—248.
12.Folstein M.F., Folstein S.E., McHugh P.R. Mini-Mental State. A practical method for grading the cognitive state of patients for the clinicàn. J Psychiat Res 1975; 2: 189—198.
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
9 |

КЛИНИКА НЕРВНЫХ И ПСИХИЧЕСКИХ ЗАБОЛЕВАНИЙ
13.Golomb J., Kluger A., Garrard P., Ferris S. Clinician’s Manuel on Mild Cognitive Impairment. Science Press Ltd. London 2001; 56.
14.Kaplan E.H., Goodglass H., Weintraub S. The Boston Naming Test. Philadelphia 1983.
15.Morris J.C. The clinical dementia rating (CDR). Current version and scoring rules. Neurology 1993; 43: 2412—2414.
16.Petersen R.C., Stevens J.C., Ganguli M. et al. Practice parameter: early detection of dementia: mild cognitive impairment (an evidencebased review), Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001; 56: 9: 1133— 1142.
17.Petersen R.Ñ. Aging, mild cognitive impairment, and Alzheimer’s disease. Neurol Clin 2000; 18: 4: 789—806.
18.Petersen P.C., Knopman D.S., Boeve B.F. et al. Mild Cognitive Impairment. Alzheimer’s Disease and Related Disorders: Research Advances. Published by «Ana Aslas» International Academy of Aging. Bucharest, Romania 2002; 111.
19.Petersen R.C., Smith G.E., Waring S.C. et al. Mild cognitive impairment: Clinical characterization and outcome. Archives of Neurology 1999; 56: 303—308.
20.Petersen R.C., Stevens J.C., Ganguli M. et al. Practice parameter: early detection of dementia: mild cognitive impairment (anevidence-based
review). Report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2001; 56: 9: 1133—1142.
21.Petersen R.C. Mild cognitive impairment as a diagnostic entity. J Intern Med 2004; 256: 183—194. Mild Cognitive Impairment . Petersen and O’Brien. 153 Figure 3. Number of publications with mild cognitive impairment either in the title or the abstract from 1990 through 2004.
22.Petersen R.C., Touchon J. Consensus on mild cognitive impairment. «Research and Practice in Alzheimer’s Disease» Joint Meeting, Serdi Publisher. Paris 2005; 10: 24—32.
23.Reisberg B., Ferris S.H., de Leon M.J. et al. The global deterioration scale (GDS). An instrument for the assessment of primary degenerative dementia. Am J Psychiat 1982; 139: 1136—1139.
24.Shulman K.I., Shedletsky R., Silver I. The challenge of time: clock drawing and cognitive function in the elderly. Int J Geriat Psychiat 1986; 1: 135—140.
25.Wechsler D. Wechsler Memory Scale manual. Psychological Corporation. San Antonio TX 1974.
26.Yesavage J.A., Brink T.L., Rose T.L. et al. Development and validation of a geriatric depression screening scale: A preliminary report. J Psychiat Res 1983; 17: 37—49.
10 |
ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 1, 2007 |
