
- •Краткое содержание
- •Предисловие
- •1. Статус настоящего документа
- •2. Мандат на подготовку настоящего документа
- •3. Значимые нормативно-правовые положения Директивы КПКЗ и определение НДТ
- •4. Цель настоящего документа
- •5. Источники информации
- •6. Как использовать настоящий документ
- •Область применения
- •1. Введение и определения
- •1.1. Введение
- •1.1.1. Энергия в промышленном секторе ЕС
- •1.1.2. Воздействия энергопотребления на окружающую среду и экономику
- •1.1.3. Вклад энергоэффективности в сокращение эффектов глобального потепления и повышение устойчивости
- •1.1.4. Энергоэффективность и Директива КПКЗ
- •1.1.5. Место энергоэффективности в системе комплексного предотвращения и контроля загрязнения
- •1.1.6. Экономические аспекты и вопросы воздействия на различные компоненты окружающей среды
- •1.2. Понятие энергии и законы термодинамики
- •1.2.1. Энергия, теплота, мощность и работа
- •1.2.2. Законы термодинамики
- •1.2.2.1. Первый закон термодинамики: сохранение энергии
- •1.2.2.2. Второй закон термодинамики: рост энтропии
- •1.2.2.3. Баланс эксергии: сочетание первого и второго законов
- •1.2.2.4. Диаграммы свойств
- •1.2.2.5. Дальнейшая информация
- •1.2.2.6. Необратимость и ее источники
- •1.3. Определения показателей энергоэффективности и повышения энергоэффективности
- •1.3.1. Вопросы энергоэффективности и ее оценки в Директиве IPPC
- •1.3.2. Эффективное и неэффективное использование энергии
- •1.3.3 Показатели энергоэффективности
- •1.3.4. Практическое применение показателей
- •1.3.5. Значимость систем и границ систем
- •1.3.6. Другие используемые термины
- •1.3.6.1. Первичная энергия, вторичная энергия и конечная энергия
- •1.3.6.2. Теплота сгорания топлива и КПД
- •1.3.6.3. Меры по повышению энергоэффективности на стороне производителя и стороне потребителя
- •1.4. Показатели энергоэффективности в промышленности
- •1.4.1. Введение: определение показателей и других параметров
- •1.4.2. Энергоэффективность производственных единиц
- •1.4.2.1. Пример 1. Простой случай
- •1.4.2.2. Пример 2. Типичный случай
- •1.4.3. Энергоэффективность предприятия
- •1.5. Вопросы, которые должны быть рассмотрены при определении показателей энергоэффективности
- •1.5.1. Определение границ системы
- •1.5.1.1.Выводы относительно систем и границ систем
- •1.5.2. Другие существенные вопросы, заслуживающие рассмотрения на уровне установки
- •1.5.2.1. Документирование используемых подходов к отчетности
- •1.5.2.2. Внутреннее производство и потребление энергии
- •1.5.2.3. Утилизация энергии отходов и газа, сжигаемого в факелах
- •1.5.2.4. Эффект масштаба (снижение УЭП с ростом объемов производства)
- •1.5.2.5. Изменения в производственных методах и характеристиках продукции
- •1.5.2.6. Интеграция энергосистем
- •1.5.2.7. Неэффективное использование энергии из соображений устойчивого развития и/или повышения энергоэффективности предприятия в целом
- •1.5.2.8. Отопление и охлаждение помещений
- •1.5.2.9. Региональные факторы
- •1.5.2.10. Явная теплота
- •1.5.2.11. Дальнейшие примеры
- •2. Технологии, которые следует рассматривать для обеспечения энергоэффективности на уровне установки
- •2.1. Системы менеджмента энергоэффективности (СМЭЭ)
- •2.2. Планирование и определение целей и задач
- •2.2.1. Постоянное улучшение экологической результативности и вопросы воздействия на различные компоненты окружающей среды
- •2.2.2. Системный подход к менеджменту энергоэффективности
- •2.3. Энергоэффективное проектирование (ЭЭП)
- •2.3.1. Выбор технологии производственного процесса
- •2.4. Повышение степени интеграции процессов
- •2.5. Обеспечение дальнейшего развития инициатив в области энергоэффективности и поддержание мотивации
- •2.6. Поддержание и повышение квалификации персонала
- •2.7. Информационный обмен
- •2.7.1. Диаграммы Сэнки
- •2.8. Эффективный контроль технологических процессов
- •2.8.1. Автоматизированные системы управления технологическими процессами
- •2.8.2. Менеджмент (контроль, обеспечение) качества
- •2.9. Техническое обслуживание
- •2.10. Мониторинг и измерения
- •2.10.1. Косвенные методы мониторинга
- •2.10.2. Оценки и расчеты
- •2.10.3. Учет потребления энергоресурсов и усовершенствованные системы учета
- •2.10.4. Снижение потери давления при измерении расходов в трубопроводах
- •2.11. Энергоаудиты и энергетическая диагностика
- •2.12. Пинч-анализ
- •2.13. Энтальпийный и эксергетический анализ
- •2.14. Термоэкономика
- •2.15. Энергетические модели
- •2.15.1. Энергетические модели, базы данных и балансы
- •2.15.2. Оптимизация использования энергоресурсов и управление ими на основе моделей
- •2.16. Сравнительный анализ
- •2.17. Прочие инструменты
- •3. Технологии, которые следует рассматривать для обеспечения энергоэффективности на уровне энергопотребляющих систем, процессов и видов деятельности
- •3.1. Сжигание
- •3.1.1. Снижение температуры дымовых газов
- •3.1.1.1. Установка подогревателя воздуха или воды
- •3.1.2. Рекуперативные и регенеративные горелки
- •3.1.3. Сокращение массового расхода дымовых газов за счет снижения избытка воздуха горения
- •3.1.4. Автоматизированное управление горелками
- •3.1.5. Выбор топлива
- •3.1.6. Кислородное сжигание
- •3.1.7. Сокращение потерь тепла при помощи теплоизоляции
- •3.1.8. Сокращение потерь тепла через отверстия печей
- •3.2. Паровые системы
- •3.2.1. Общие свойства пара
- •3.2.2. Обзор методов повышения энергоэффективности паровых систем
- •3.2.3. Дросселирование и использование турбодетандеров
- •3.2.4. Методы эксплуатации и управления технологическим процессом
- •3.2.5. Предварительный подогрев питательной воды (в т.ч. с помощью экономайзера)
- •3.2.6. Предотвращение образования и удаление накипи с поверхностей теплообмена
- •3.2.7. Оптимизация продувки котла
- •3.2.8. Оптимизация расхода пара в деаэраторе
- •3.2.9. Оптимизация работы котла короткими циклами
- •3.2.10. Оптимизация парораспределительных систем
- •3.2.11. Теплоизоляция паропроводов и конденсатопроводов
- •3.2.11.1. Использование съемных панелей для теплоизоляции клапанов и фитингов
- •3.2.12. Реализация программы контроля состояния конденсатоотводчиков и их ремонта
- •3.2.13. Сбор и возврат конденсата в котел
- •3.2.14. Использование самоиспарения
- •3.2.15. Утилизация энергии продувочной воды котла
- •3.3. Утилизация тепла и охлаждение
- •3.3.1. Теплообменники
- •3.3.1.1. Мониторинг состояния и техническое обслуживание теплообменников
- •3.3.2. Тепловые насосы (в т.ч. механическая рекомпрессия пара)
- •3.3.3. Системы охлаждения и холодильные установки
- •3.4. Когенерация
- •3.4.1. Различные методы когенерации
- •3.4.2. Тригенерация
- •3.4.3. Централизованное холодоснабжение
- •3.5. Электроснабжение
- •3.5.1. Компенсация реактивной мощности
- •3.5.2. Гармоники
- •3.5.3. Оптимизация систем электроснабжения
- •3.5.4. Энергоэффективная эксплуатация трансформаторов
- •3.6. Подсистемы с электроприводом
- •3.6.1. Энергоэффективные двигатели
- •3.6.2. Выбор оптимальной номинальной мощности двигателя
- •3.6.3. Приводы с переменной скоростью
- •3.6.4. Потери при передаче механической энергии
- •3.6.5. Ремонт двигателей
- •3.6.6. Перемотка
- •3.6.7. Экологические преимущества, воздействие на различные компоненты окружающей среды, применимость и другие соображения относительно методов повышения энергоэффективности систем с электроприводом
- •3.7. Системы сжатого воздуха
- •3.7.1. Оптимизация общего устройства системы
- •3.7.2. Использование приводов с переменной скоростью
- •3.7.3. Высокоэффективные электродвигатели
- •3.7.4. Централизованная система управления системой сжатого воздуха
- •3.7.5. Утилизация тепла
- •3.7.6. Сокращение утечек в системах сжатого воздуха
- •3.7.7. Техническое обслуживание фильтров
- •3.7.8. Использование холодного наружного воздуха для питания компрессоров
- •3.7.9. Оптимизация давления системы
- •3.7.10. Создание запаса сжатого воздуха вблизи потребителей с существенно варьирующим уровнем потребления
- •3.8. Насосные системы
- •3.8.1. Инвентаризация и оценка насосных систем
- •3.8.2. Выбор насоса
- •3.8.3. Оптимизация трубопроводной системы
- •3.8.4. Техническое обслуживание
- •3.8.5. Управление насосными системами и их регулирование
- •3.8.6. Привод и передача
- •3.8.7. Экологические преимущества, воздействие на различные компоненты окружающей среды, применимость и другие соображения относительно методов повышения энергоэффективности насосных систем
- •3.9. Системы отопления, вентиляции и кондиционирования воздуха (ОВКВ)
- •3.9.1. Отопление и охлаждение помещений
- •3.9.2. Вентиляция
- •3.9.2.1. Оптимизация проектных решений при внедрении новой или модернизации существующей системы вентиляции
- •3.9.2.2. Повышение эффективности существующей вентиляционной системы
- •3.9.3. Естественное охлаждение
- •3.10. Освещение
- •3.11. Процессы сушки, сепарации и концентрирования
- •3.11.1. Выбор оптимальной технологии или сочетания технологий
- •3.11.2. Механические процессы
- •3.11.3. Методы термической сушки
- •3.11.3.1. Расчет энергозатрат и КПД
- •3.11.3.2. Конвективная сушка
- •3.11.3.3. Контактная сушка
- •3.11.3.4. Перегретый пар
- •3.11.3.5. Утилизация тепла в процессах сушки
- •3.11.3.6. Выпаривание в сочетании с механической рекомпрессией пара или тепловым насосом
- •3.11.3.7. Оптимизация теплоизоляции сушильных систем
- •3.11.4. Радиационная сушка
- •3.11.5. Системы автоматизированного управления процессами термической сушки
- •4. Наилучшие доступные технологии
- •4.1. Введение
- •4.2. Наилучшие доступные технологии обеспечения энергоэффективности на уровне установки
- •4.2.1. Менеджмент энергоэффективности
- •4.2.2. Планирование и определение целей и задач
- •4.2.2.1. Постоянное улучшение экологической результативности
- •4.2.2.2. Выявление аспектов энергоэффективности установки и возможностей для энергосбережение
- •4.2.2.3. Системный подход к менеджменту энергоэффективности
- •4.2.2.4. Установление и пересмотр целей и показателей в области энергоэффективности
- •4.2.2.5. Сравнительный анализ
- •4.2.3. Энергоэффективное проектирование (ЭЭП)
- •4.2.4. Повышение степени интеграции технологических процессов
- •4.2.5. Поддержание поступательного развития инициатив в области энергоэффективности
- •4.2.6. Поддержание уровня квалификации персонала
- •4.2.7. Эффективный контроль технологических процессов
- •4.2.8. Техническое обслуживание
- •4.2.9. Мониоринг и измерения
- •4.3. Наилучшие доступные технологии обеспечения энергоэффективности энергопотребляющих систем, технологических процессов, видов деятельности и оборудования
- •4.3.1. Сжигание
- •4.3.2. Паровые системы
- •4.3.3. Утилизация тепла
- •4.3.4. Когенерация
- •4.3.5. Электроснабжение
- •4.3.6. Подсистемы с электроприводом
- •4.3.7. Системы сжатого воздуха
- •4.3.8. Насосные системы
- •4.3.9. Системы отопления, вентиляции и кондиционирования воздуха (ОВКВ)
- •4.3.10. Освещение
- •4.3.11. Процессы сушки, сепарации и концентрирования
- •5. Новые технологии обеспечения энергоэффективности
- •5.1. Беспламенное сжигание (беспламенное окисление)
- •5.2. Сжатый воздух как средство хранения энергии
- •6. Заключительные замечания
- •6.1. Временные рамки и основные этапы подготовки настоящего документа
- •6.2. Источники информации
- •6.3. Степень консенсуса
- •6.4. Пробелы и дублирование информации. Рекомендации по дальнейшему сбору информации и исследованиям
- •6.4.1. Пробелы и дублирование информации
- •6.4.3. Конкретная производственная информация
- •6.4.3. Направления дальнейших исследований и практической деятельности
- •6.5. Пересмотр настоящего документа
- •Источники
- •Глоссарий
- •7. Приложения
- •7.1. Энергия и законы термодинамики
- •7.1.1. Общие принципы
- •7.1.1.1. Описание систем и процессов
- •7.1.1.2. Формы энергии и способы ее передачи
- •7.1.2. Первый и второй законы термодинамики
- •7.1.2.1. Первый закон термодинамики: баланс энергии
- •7.1.2.2. Второй закон термодинамики: энтропия
- •7.1.2.2.2. Баланс энтропии для закрытой системы
- •7.1.2.3. Баланс энтропии для открытой системы
- •7.1.2.4. Анализ эксергии
- •7.1.3. Диаграммы свойств, таблицы свойств, базы данных и программы
- •7.1.3.1. Диаграммы свойств
- •7.1.3.2. Таблицы свойств, базы данных и программное моделирование
- •7.1.3.3. Источники неэффективности
- •7.1.4. Использованные обозначения
- •7.1.4.1. Библиография
- •7.2. Примеры термодинамической необратимости
- •7.2.1. Пример 1. Дросселирование
- •7.2.2. Пример 2. Теплообменники
- •7.2.3. Пример 3. Процессы перемешивания
- •7.3. Примеры анализа энергоэффективности производства
- •7.3.1. Производство этилена методом парового крекинга
- •7.3.2. Производство мономера винилацетата (МВА)
- •7.3.3. Горячая прокатка стали
- •7.4. Примеры внедрения систем менеджмента энергоэффективности
- •7.5. Примеры энергоэффективных технологических процессов
- •7.6. Пример подхода к поступательному развитию инициатив в сфере энергоэффективности: «совершенство в производственной деятельности»
- •7.7. Мониторинг и измерения
- •7.7.1. Количественные измерения
- •7.7.2. Оптимизация использования энергоресурсов
- •7.7.3. Энергетические модели, базы данных и балансы
- •7.8. Другие инструменты аудита и поддержки мероприятий по повышению энергоэффективности на уровне предприятия
- •7.8.1. Инструменты аудита и менеджмента энергоэффективности
- •7.9. Сравнительный анализ
- •7.9.1. Нефтеперерабатывающие заводы
- •7.9.2. Австрийское энергетическое агентство
- •7.9.3. Схема для норвежских МСП
- •7.9.4. Соглашения о сравнительном анализе в Нидерландах
- •7.9.5. Сравнительный анализ в стекольной промышленности
- •7.9.6. Распределение энергозатрат и выбросов CO2 между различными видами продукции в сложном последовательном процессе
- •7.10. Примеры к главе 3
- •7.10.1. Паровые системы
- •7.10.2. Утилизация отходящего тепла
- •7.11. Мероприятия на стороне потребителя
- •7.12. Энергосервисные компании
- •7.13. Сайт Европейской комиссии, посвященный вопросам энергоэффективности и Национальные планы действий государств-членов
- •7.14. Европейская схема торговли квотами (ETS)
- •7.15. Оптимизация транспортных систем
- •7.15.1. Энергоаудит транспортных систем
- •7.15.2. Менеджмент энергоэффективности автомобильного транспорта
- •7.15.3. Улучшение упаковки с целью оптимизации использования транспорта
- •7.16. Европейский топливный баланс
- •7.17. Коррекция коэффициента мощности при электроснабжении
теряется как можно меньшая доля «доступной работы» (эксергии), поступающей в систему.
Как правило, обеспечение большей эксергетической эффективности сопряжено с увеличением затрат на строительство предприятия или установки, поэтому необходимо найти оптимальный баланс между объемом капитальными затратами и эффективностью в процессе эксплуатации.
1.2.2.4. Диаграммы свойств
Если свойства системы (например, температура T, давление P, концентрация) измерены и не меняются самопроизвольно с течением времени, говорят, что система достигла состояния равновесия, определяемого данными свойствами. Равновесное состояние системы может быть воспроизведено в другой (аналогичной) системе и может быть однозначно определено набором свойств, представляющих собой функции состояния системы: этот принцип получил название постулата состояния. Из этого следует, в частности, что состояние однокомпонентной системы (системы, состоящей из одного чистого вещества) может быть представлено точкой на двумерной диаграмме, по осям которой отложены два независимых свойства. Пять основных свойств, обычно используемых при построении диаграмм свойств, включают: давление (P), температуру (T), удельный объем (v), удельную энтальпию (h) и удельную энтропию (s). Для системы, состоящей из двух (или более) веществ или фаз, вводится дополнительный параметр «качество» (X), отражающий состав системы. Чаще всего используются следующие виды диаграмм свойств: давление – температура (P–T), давление – удельный объем (P–v), температура – удельный объем (T–v), температура – энтропия (T–s), энтальпия – энтропия (h–s), а также диаграммы температура
– энтальпия (T–h), используемые в процессе пинч-анализа (см. раздел 2.12). Все эти диаграммы могут быть полезны для графического представления различных процессов. Кроме того, три первые диаграммы могут использоваться для иллюстрации соотношения между тремя фазами вещества.
Диаграммы температура – давление (фазовые диаграммы)
На фазовых диаграммах представлены равновесные состояния различных фаз системы, отличающихся друг от друга теми или иными термодинамическими свойствами.
На диаграмме P – T (рис. 1.5) для однокомпонентной системы двумерные области являются однофазными, т.е. соответствуют определенным фазам системы (твердой, жидкой или газообразной). В этих областях фазовое состояние однозначно определяется парой параметров – температурой и давлением.
Линии, отделяющие однофазные области друг от друга (границы раздела фаз), представляют состояния (определяемые давлением и температурой), при которых две фазы могут существовать в равновесии. При условии равновесия между фазами давление и температура не является независимыми переменными; состояние системы определяется значением одного интенсивного свойства (P или T). Линия, разделяющая области твердой и газообразной фазы, называется линией сублимации, области жидкой и газообразной фазы – линией испарения, твердой и жидкой фазы – линией плавления.
Все три границы раздела встречаются в тройной точке, где все три фазы могут сосуществовать в равновесии. В этом случае независимые переменные отсутствуют – условие равновесия трех фаз однозначно определяет температуру и давление.
Линия испарения заканчивается в критической точке. При давлениях и температурах, превышающих критическое, вещество находится в сверхкритическом состоянии, где не существует четкого различия между жидкой и газообразной фазой. Таким образом, при достаточно высоких давлениях и температурах жидкая и газообразная фаза становятся неразличимы. Для воды критические значения составляют примерно 647 K (374 °C) и 22,064 МПа. Состояние вещества, находящееся на диаграмме слева от линии испарения, описывается как сжатая жидкость, а справа – как перегретый пар.
17
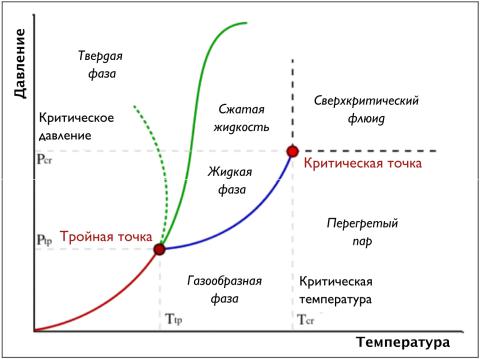
Рисунок 1.5: Диаграмма давление – температура (фазовая диаграмма) [153, Wikipedia]
1.2.2.5. Дальнейшая информация
Дополнительные сведения по данным вопросам могут быть получены в стандартных учебниках по термодинамике, физической химии и т.п.
Существует большое количество печатных справочников и электронных баз данных, содержащих данные и таблицы по термодинамическим свойствам различных веществ, а также диаграммы, отражающие взаимосвязь этих свойств. Приводимая в этих источниках информация основана на экспериментальных данных. Чаще всего приводятся значения таких свойств, как удельный объем, внутренняя энергия, удельная энтальпия и удельная энтропия. Информационные ресурсы такого рода, в частности, доступны через Интернет.
Поскольку состояние системы в однофазной области однозначно задается двумя независимыми переменными, в таблицах обычно приводятся значения V, U, H и S в зависимости от температуры при заданных значениях давления для перегретого пара и сжатой жидкости. Если данные для сжатой жидкости отсутствуют, в качестве разумного приближения можно использовать характеристики насыщенной жидкости при той же температуре. Это связано с тем, что свойства сжатой жидкости определяются ее температурой в большей степени, чем давлением.
Так называемые «таблицы насыщения» отражают характеристики состояний насыщенной жидкости и насыщенного пара. Поскольку на границе раздела фаз температура и давление не являются независимыми параметрами, состояние однозначно определяется одним параметром. Поэтому в таблицах насыщения значения V, U, H и S даются в зависимости либо от температуры, либо от давления. В случае смеси насыщенных жидкости и пара вводится дополнительный параметр состояния, «качество», представляющий собой массовую долю пара в смеси.
Дополнительная информация о базах данных и программных пакетах для термодинамического моделирования приведена в Приложении 7.1.3.2.
1.2.2.6. Необратимость и ее источники
В термодинамике обратимый процесс является теоретическим понятием, используемым при выводе формул и анализе различных процессов. Однако на практике процессы в любых реальных системах являются необратимыми. Это означает, что процесс невозможно обратить – провести через те же состояния в обратном порядке – без использования дополнительной энергии (как
18
следствие второго закона термодинамики). Трем типам равновесия термодинамической системы – механическому, тепловому и химическому – соответствуют три типа или источника необратимости (на практике все они могут рассматриваться как разновидности термодинамической неэффективности). Изменения в состоянии системы вызываются движущими силами, например, разницей температур, давлений, концентраций и т.п. Процесс тем ближе к теоретическому обратимому процессу, чем меньше величина движущих сил. Однако на практике оказывается, что меньшие движущие силы требуют большего размера оборудования; например, необходимая площадь теплообменных поверхностей тем больше, чем меньше разница температур. Цикл Карно, в котором достигается теоретически максимальный КПД тепловой машины, подразумевает нулевую величину движущих сил и, как следствие, не может быть реализован на практике. Дополнительная информация о цикле Карно приводится в Справочном документе по крупным топливосжигающим установкам [125, EIPPCB] или учебниках термодинамики.
Механическая необратимость связана с трением и, как правило, приводят к изменению (потере) давления.
Тепловая необратимость проявляется в ситуациях, где имеет место конечная разница температур между элементами системы, как, например, в любом теплообменнике. Теплота самопроизвольно перетекает от теплого тела к холодному, что приводит к потере эксергии. Чем больше разница температур, тем больше потеря эксергии, и тем более необратимым является процесс.
Химическая необратимость проявляется в процессах смешивания и растворения, а также в химических реакциях. Например, при смешивании воды и соли эксергия системы уменьшается. Эту потерянную эксергию можно наглядно представить как количество работы, которое было затрачено ранее для разделения воды и соли, например, посредством дистилляции, ионообмена, мембранной фильтрации или сушки. Химическая необратимость имеет место в любой ситуации загрязнения воды или атмосферы. Загрязнение (смешивание) происходит самопроизвольно, но очистка (разделение смеси) требует затрат эксергии.
Из термодинамического анализа необратимых процессов следует, что для обеспечения оптимальной энергоэффективности и энергосбережения необходимо выявлять, контролировать и минимизировать все источники механической, тепловой и химической необратимости на производстве.
Примеры необратимости каждого типа приведены в Приложении 7.2.
Чем больше степень необратимости процессов, реализуемых в системе, тем больше потенциал для повышения энергоэффективности последней. Помимо значительных разниц давления, температур и/или химических потенциалов, существенной причиной необратимости может быть большой промежуток времени и/или расстояние между производством и потреблением энергии. Время является важным фактором, определяющим степень необратимости процессов. С течением времени энергетическая система стремится к самопроизвольному уменьшению температуры, давления и химических потенциалов для достижения равновесия с окружающей средой. Существуют две принципиальные стратегии предотвращения этого. Одна из них – непосредственное соединение источников энергии с ее потребителями (см., например, раздел 3.3). Вторая стратегия состоит в окружении системы жесткими (не передающими давление) адиабатическими (теплонепроницаемыми) стенками и/или поддержании химической системы в метастабильном состоянии. Иными словами, эти стратегия сводится к изоляции системы от окружающей среды, что позволяет поддерживать ее интенсивные свойства с течением времени.
Термодинамика играет важную роль в оптимизации энергоэффективности. В частности, она занимает важное место в таких подходах, как:
•энергоэффективное проектирование (см. раздел 2.3);
•различные аналитические инструменты, включая пинч-анализ, а также анализ энтальпии и эксергии (см. разделы 2.12 и 2.13);
•термоэкономика, представляющая собой сочетание термодинамического и экономического анализа (см. раздел 2.14.).
19
