
- •Неподвижные фазы(адсорбенты) в жах
- •Модифицированные адсорбенты
- •Цели и задачи, решаемые методами жах при исследовании нефтей
- •Координационная хроматография
- •Ионообменная хроматография
- •Гель - хроматография (эксклюзионная хроматография)
- •Характеристика фаз в гжх
- •2) Полярные фазы
- •Применение гжх в исследовании нефтей
- •1. Метод удаления части компонентов
- •За 100% принимается сумма исправленных параметров Ki Пi и результат анализа рассчитывают как в методе простой нормировки.
- •Хроматографический анализ в исследовании нефтяных объектов
- •2.Окисление.
Лекция 11
http://chromatography.by.ru/lecture/diagram_gc.html (лекции по хроматографии)
Х Р О М А Т О Г Р А Ф И Я
Хроматографический метод анализа впервые был разработан русским ботаником М.С.Цветом в 1903 г. Хромато (цвето) графия (описание) с греческого. М.С. Цвет впервые установил, что при разделении экстракта зеленых листьев считавшийся однородным зеленый пигмент хлорофилл на самом деле состоит из нескольких веществ. В настоящее время хроматография используется и для разделения бесцветных веществ. Заметное развитие началось в 30-е годы XXвека, когда возникла потребность в новом методе разделения смесей и очистке веществ, разлагающихся при нагревании. Хроматография продолжает бурно развиваться и в настоящее время является одним из перспективных методов анализа. За работы, выполненные с применением хроматографических методов было присуждено 14 Нобелевских премий.Хроматографию можно определить как процесс, основанный на многократном повторении актов сорбции и десорбции вещества при перемещении его в потоке подвижной фазы вдоль неподвижного сорбента.
Сорбцией (лат.-sorbeo-поглощаю) называют процесс поглощения твердым телом или жидкостью (сорбентом) газообразного, парообразного или растворенного вещества (сорбата). Обратный процесс называютдесорбцией. Сорбцию подразделяют на адсорбцию, абсорбцию и хемосорбцию.
Адсорбция – поглощение (концентрирование) вещества (адсорбата) поверхностью твердого или жидкого адсорбента, вызванное физико-химическим взаимодействием адсорбата и поверхности.
Абсорбция – избирательное поглощение вещества (абсорбата) из раствора или газовой смеси жидкостью или твердым телом поверхностью абсорбента в объеме.
Хемосорбция – поглощение вещества сорбентом с образованием химических соединений.
Существует множество вариантов хроматографии. Различные методы хроматографии классифицируют по разным признакам.
По агрегатному состоянию фаз:
|
Неподвижная фаза |
Подвижная фаза |
Название (краткое) хроматографии |
|
Твердая
Твердая
Жидкая
Жидкая |
Газ
Жидкая
Газ
Жидкая |
Газовая адсорбционная (ГАХ)
Жидкостная адсорбционная (ЖАХ)
Газо- жидкостная (ГЖХ)
Распределительная жидкостная (ЖЖХ) |
Если неподвижная фаза твердая, а подвижная жидкость или газ – адсорбционная (газовая ГАХ или жидкостная ЖАХ) хроматография. В качестве адсорбентов чаще всего используют природные или полученные в заводских условиях твердые тела с большой внутренней или наружной поверхностью.
В основе методов ГАХ и ЖАХ лежит неодинаковая адсорбционная способность, зависящая от структуры разделяемых компонентов, а главным образом от их полярности.
В основе распределительной хроматографии ГЖХ и ЖЖХ лежит неодинаковая растворимость компонентов разделяемой смеси в подвижной и неподвижной фазах (компоненты имеют разные коэффициенты распределения между подвижной и неподвижной фазами).
II. По форме проведения процесса разделения:
а)Колоночная
б)Капиллярная
в) Тонкослойная
а) Колоночная хроматография. Колонка (стеклянная, кварцевая, из нержавеющей стали) заполняется адсорбентом, вверху (в начало) вводят разделяемую смесь. Неподвижная фаза – адсорбент, подвижная фаза – газ, органический растворитель, (реже - водяной пар). Этот метод преимущественно используется в исследовательской практике, его преимущества:
– разделение идет в мягких условиях, это сохраняет нативность входящих в смесь веществ,
– результаты хорошо воспроизводимы.
– препаративное получение отдельных хроматографических фракций.
Эффективность хроматографического разделения зависит от следующих факторов:
А) природы адсорбента, б) природы элюента, в) соотношения размеров колонки d:h=>1:10, г) загрузки колонки – соотношение массы смеси к массе адсорбента >=1:20-30. Чем сложнее разделяемая смесь, тем меньше должна быть загрузка вещества.
Для ГЖХ диаметр набивных колонок 3-8 мм, длина 1-3 м.
б) Капиллярная хроматография. Колонка внутри полая, жидкую неподвижную фазу наносят на внутренние стенки. Для ГЖХ диаметр капиллярных колонок 0,2-1 мм, длина 1-100 м.
В) Тонкослойная хроматография. Если сорбент помещен не в колонке, а в виде тонкого слоя на пластинке, то мы получаем один из вариантов хроматографии – тонкослойную хроматографию (ТСХ). В качестве основы может быть использовано стекло, металл (алюминиевая фольга), пластмасса (для водных растворов). В качестве сорбентов обычно применяют оксид кремния (силикагель), оксид алюминия. В настоящее время выпускают готовые пластинки с нанесенным сорбентом с флуоресцирующими добавками.
В качестве растворителей используют те же элюотропные ряды, что и в колоночной хроматографии.
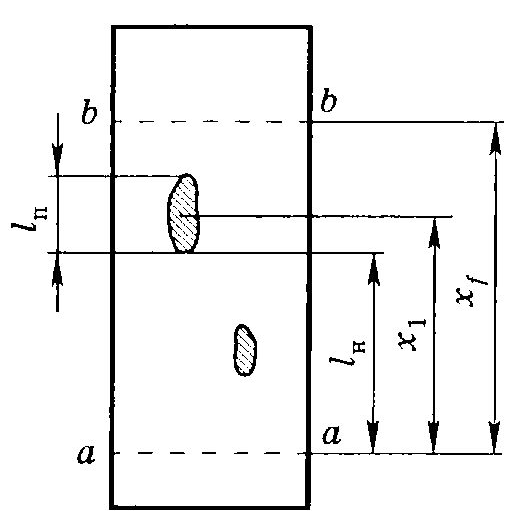
Схема разделения смеси веществ на пластинке с тонким слоем сорбента:
а) линия старта, б) линия фронта (финиша)
Количественной мерой скорости переноса вещества при использованиии определенного адсорбента и растворителя в тонкослойной хроматографии является величина Rf (retentionfactor=коэффициент задержки):Sn
Rf = --------
S0
где: Sn- расстояние от старта до пятна (мм, см)
S0- расстояние от старта до фронта растворителя (мм, см)
Для проявления разделенных соединений используют:
- спектрофотометрическое облучение (УФ - область), для веществ, содержащих хромофоры (ароматические УВ)
- химическое проявление обработкой пластин реагентом, взаимодействующим с одним из разделяемых соединений.
С целью детального исследования разделяемых соединений можно снимать отдельные зоны с пластинок. Надежным методом идентификации является также метод свидетелей, когда вместе с пробой на старт вносят индивидуальные модельные вещества.
Возможности ТСХ как аналитического так и исследовательского метода существенно расширяются благодаря сочетанию с такими физико-химическими методами, как спектрофотометрия, газо-жидкостная хроматография, хромато-масс-спектрометрия, а также с колоночной хроматографией.
Наиболее часто ЖАХ реализуют а) колоночной, б) тонкослойной хроматографией
III. По природе сил, действующих в хроматографии:
1.Молекулярные (слабые межмолекулярные взаимодействия, в основе которых лежат дисперсионные, индукционные силы) – ЖАХ, ГАХ, ГЖХ, ЖЖХ.
2. Хемосорбционные – сильные взаимодействия, в основе которых лежат химические реакции (ионообменные, комплексообразование и т.п.)
IY. По целям хроматографии:
1. Аналитическая – качественный и количественный анализ
2. Неаналитическая – слежение за ходом реакции
3. Препаративная : ЖАХ – выделение чистого вещества из смеси и его исследование.
Y.По методике проведения хроматографии. Иначе – по способу относительного
перемещения фаз:
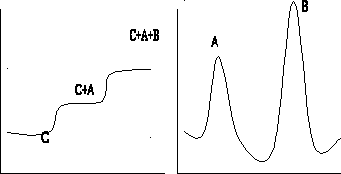
Фронтальный способ. Наиболее простейший вариант. Через колонку с адсорбентом непрерывно пропускают анализируемую смесь компонентовA и B в растворителеС (при этом компонент А имеет более слабое сродство к выбранному сорбенту, чемB). Фронт движущейся смеси состоит из менее сорбирующегося компонентаА, затем движется исходная смесь. В растворе, вытекающем из колонки, определяют концентрацию каждого компонента и строят график в координатах:[С]- концентрация вещества,V (мл) – объем раствора, прошедшего через колонку, который называют хроматограммой. (рис. Кривая фронтального анализа),
[C] Кривая фронтального анализа [C] Кривая проявительного анализа
V, млV, мл
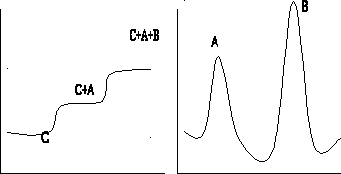
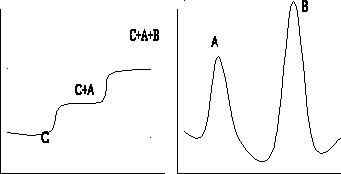
Элюентный (проявительный).В колонку вводят анализируемую смесь компонентовA и
Bв виде порции раствора или газа, колонку непрерывно промывают подвижной фазой
(газом-носителем или растворителем С). При этом анализируемая смесь компонентовA и B
разделяется на зоны: хорошо сорбирующееся вещество B занимает верхнюю часть колонки,
а менее сорбирующийся компонент A будет занимать нижнюю часть. (рис. вверху)
Вытеснительный. Анализируемую смесь компонентовA и B в растворителе С вводят в колонку и промывают раствором вещества D (вытеснитель), который сорбируется лучше, чем любой из компонентовA и B. Концентрация раствора не уменьшается в отличие от проявительного метода. Недостатком является частое наложение зоны одного вещества на зону другого, поскольку зоны компонентов в этом методе не разделены зоной растворителя.
Вещество подвижной фазы непрерывно вступает в контакт с новыми участками сорбента и
частично сорбируется, а сорбированное вещество контактирует со свежими порциями
подвижной фазы и частично десорбируется.
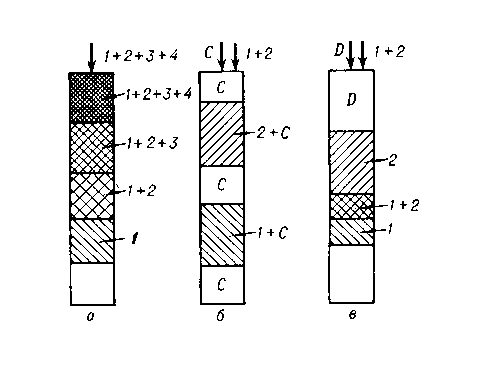
Рис. Основные варианты проведения хроматографического процесса: а — фронтальный; б — проявительный; в — вытеснительный; 1, 2, 3, 4 — разделяемые вещества; C — несорбирующаяся подвижная фаза; D — вытеснитель.
При постоянной Т0С адсорбция увеличивается с ростом концентрации раствора или давлении газа. Математически процесс адсорбции выражается уравнением:
a =a ооbc/1+bc
где: a – количество адсорбированного вещества при равновесии
aоо - максимальное количество вещества, которое может быть адсорбировано на
данном адсорбенте, (оо – знак бесконечности)
b- постоянная,c- концентрация вещества
Зависимость количества поглощенного вещества аот концентрации раствора или давлении газаCпри постоянной Т0С называютизотермой адсорбции (рис.).
a
 a
оо - - - - - - - - -
- - - -
a
оо - - - - - - - - -
- - - -

Рис. Изотерма адсорбции [C]
Таким образом, на поверхности твердого тела имеется некоторое число мест с минимальной энергией, расположенных через определенные интервалы по всей поверхности. На этих местах могут адсорбироваться молекулы из раствора или газа. В области небольших концентраций изотерма линейна: при bc<<1знаменатель становится равным 1, уравнение (линейной адсорбции) переходит в вид (соответствует уравнению Генри,Г – коэффициент Генри):
 a
= a
оо
bc
= Г
*c
a
= a
оо
bc
= Г
*c
 a
a
 [C]
[C]
При высокой концентрации bc >>1,a =aоо, что соответствует так называемому насыщению: изотерма адсорбции выходит практически на прямую, параллельную оси абсцисс.
Лекция 12
Неподвижные фазы(адсорбенты) в жах
Количество адсорбированного вещества будет определяться не только его концентрацией, но и сродством к адсорбенту. При адсорбции нескольких веществ проявление сродства особенно заметно, так как возможно вытеснение одних сорбированных веществ другими, обладающими большим сродством, хотя имеющими, может быть, и меньшую концентрацию.
Все адсорбенты делятся на:
- полярные (SiO2,Al2O3, цеолиты) - у них очень развитая внутренняя поверхность,
очень много пор
- модифицированные адсорбенты (обработка кислотами, щелочами, солями металлов)
- неполярные (активированные угли, графитированная сажа) – у них очень развитая
внешняя поверхность,
Требования к адсорбентам:
высокая удельная поверхность (м2/г), косвенно отражает способность удерживания веществ
высокая химическая инертность
высокая селективность
достаточная механическая прочность
относительная низкая стоимость, доступность
ПОЛЯРНЫЕ АДСОРБЕНТЫ
Силикагель SiO2 *n(H2O)- это неорганическое ВМС переменного состава, получают при высушивании геля кремниевой кислоты. Химический состав – 89%SiO2, остальное -Al2O3, Fe2O3, оксиды щелочных и щелочноземельных металлов. На поверхностиSiO2 имеются гидроксильные группы.
Гидроксильные группы бывают разных видов:
1.Связанная ОН-группа:
O=H2….OHOH….H2 =Oнаходится в воздухе, образуется водородная связь
____I________I___________
I I
___ Si ____ __Si____
I I
SiOH – силанольная группа
В таком виде существует в воздушно-сухом состоянии, при хранении на воздухе, содержит значительное количество воды, основная часть которой адсорбирована на связанных гидроксильных группах. Свободных ОН - групп на поверхности мало, адсорбционная способность низкая, адсорбент не работает, его необходимо прокалить.
2. Свободная ОН - группа- образуется если прокаливать при Т=150-200оС (4-5 часов), то при этом происходит разрыв водородной связи, удаляется вода:
OHOHнаходится в воздухе
____I________I___________________
I I
___ Si____ __Si____
II
Появляются свободные ОН-группы, активность SiO2 повышается.
3. Реактивная ОН-группа– образуется, если повысить Т до 200-380оС, такой силикагель реакционно неактивен:
OH……….OHнаходится в воздухе
____I________ I___________
I I
_ Si ___ ___Si _
II
4. Неактивная (геминальная) О -группа– если повысить Т выше 400оС :
О
 Силоксановая
группа
Силоксановая
группа
_______________
_Si___ ___Si_
II
Из полярных адсорбентов обладает наибольшей емкостью, достаточно инертен к большинству соединений и растворителей.
Силикагели: марка АСКГ А-активированный С-силикагель К-крупнопористый, Г-гранулированный (мелкозернистый) (0.2-0.5 мм).
Основной недостаток использования силикагеля – при хроматографии нефтей и нефтяных фракций в насыщенных УВ кроме н-алканов содержатся изо-, цикло- соединения, с ароматическими выходят и сернистые соединения, т.к. они близки по полярности.
Окись алюминия Al2O3. Cуществуют разновидности(альфа) и(гамма) –формы. Чаще используют-формуAl2O3. В обычных условиях на поверхности находится вода в хемосорбированном состоянии, которая при нагревании частично десорбируется, а частично реагирует с образованием гидроксильных групп. При прокаливании в течение 5-6 часов при Т=600-800оС получают абсолютно-безводный адсорбент, который хранят в герметичной склянке.
Избыточная адсорбционная активность такого адсорбента устраняется путем прибавления при комнатной температуре определенного количества воды, причем на поверхности образуется монослой хемосорбированной воды. При этом получают окись алюминия с активностью по Брокману, для сравнения приведены данные дляSiO2:
Степень I II III IY Y
активности
% воды 0 3 6 10 15 Al2O3
0 10 12 15 20 SiO2
Поверхность, образованная ионами О2 иAl, создает сильное электростатическое поле, благодаря которому на поверхности появляются адсорбционные центры 3 типов:
кислотные центры, создающие сильное положительное поле, на которых адсорбируются молекулы с легко поляризуемыми электронами за счет индукционных сил,
центры основного типа, протоноакцепторные (ионы О2), на которых адсорбируются кислые соединения,
электроноакцепторные центры, на которых адсорбируются молекулы с избытком электронной плотности (ароматические УВ) в виде комплексов с переносом заряда.
Окись алюминия используют чаще всего при выделении и разделении ароматических соединений по числу циклов, т.к. ионы Alявляются кислотами Льюиса, они способны оттягивать электронную плотность (акцептор электронов). Подобное разделение осуществляется также для других компонентов, содержащих ароматические системы. ИоныAl+3создают положительно заряженное поле и оно взаимодействует с легкополяризуемыми- электронами. Чем больше плотность- электронов, тем сильнее взаимодействие, при этом появляется индукционный импульс, который удерживает ароматические соединения на поверхностиAl.
Недостатком окиси алюминия является необратимая адсорбция при хроматографии некоторых компонентов нефти (карбоновых кислот, ВМС).
Природа межмолекулярных взаимодействий в адсорбционной хроматографии.
Межмолекулярные взаимодействия можно подразделить:
1. неспецифические – за счет сил Ван-дер-Ваальса (Е в/д = 4 кДж/моль), которые имеют природу: а) дисперсионные,
б) индукционные,
в) ориентационные
2. специфические – отличаются по (Е в/д= 20- 40 кДж/моль):
а) образование водородной связи,
б) комплексы с переносом заряда
|
Варианты ЖАХ |
Диспер-сионные |
Индук-ционные |
Ориента-ционные |
Водород. связи |
Образов.комплек-сов |
|
1. Неполярные молекулы на неполярном адсорбенте
2. Полярные молекулы на неполярном адсорбенте
3. Полярные молекулы на полярном адсорбенте
4. Соединения основного характера
5. Молекулы, образующие комплекс с поверхностью адсорбента
|
+
+
+
+
+ |
+
+
+
+ |
+
+
+
|
+
-
|
+ |
Цеолиты Являются наиболее селективными адсорбентами, обладающими упорядоченной кристаллической структурой и определенным размером входных окон. Название «кипящий камень» (18 век) – способность вспучиваться при нагревании в результате выделения воды из пор. Природные вещества составаMe2/nОAl2O3 хSiO2 yH2OMe– щелочной, щелочноземельный металл, х, у могут изменяться.n-валентность металла. Существуют промышленно синтезированные цеолиты (около 100 видов):
1. КА – 0.3 (диаметр пор 0.3 нм) 2. NaA– 0.4
3. СаА – 0.5 4. СаХ –0.8
Где К – катион, входящий в решетку, А - тип (х=2), Х-тип (х=2,4-2,8)
Цеолиты называют также молекулярными ситами. В соответствие с критическими размерами молекул и dокон цеолит 1) адсорбирует только воду, 3) адсорбирует н-алканы, 4)-нормальные УВ и спирты. На 5) не адсорбируются соединения аром. УВ и с большими Мм. В исследовательской практике известно адсорбционное разделение на цеолитах с целью выделения н-алканов из нефтей, фракций, битумоидов. Так цеолит МС 5А (d=0.5 нм) хорошо поглощает алканы (d=0.49 нм), но не поглощает изо-алканы и ароматические УВ (d=0.56 нм). Разделение намного селективнее, чем карбамидом.
