
Chastnaya_mikrobiologia
.pdf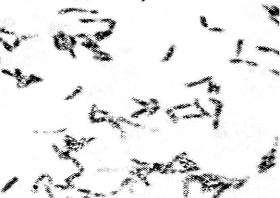
Рис. 16. Возбудитель дифтерии - Corynebacterium diphtheriae. Окраска по Нейссеру. Расположение в виде римских цифр V или Х, включения волютина по полюсам. х900
Идентификацию выделенной культуры проводят с учетом, прежде всего, ключевых свойств (токсигенность, наличие цистиназы). Токсигенность обычно определяют с помощью реакции преципитации в геле («чашечный» метод). Для этого в чашку Петри с питательной средой (МПА, 15—20 % лошадиной сыворотки, 0,3 % мальтозы, 0,03 % цистина) накладывают полоску фильтровальной бумаги, пропитанную антитоксической противодифтерийной сывороткой (5000 АЕ/мл), чашку подсушивают 30 минут в термостате, после чего засевают штрихами исследуемые культуры перпендикулярно полоске бумаги. В качестве контроля используют токсигенную культуру. Посевы инкубируют в термостате при 370 С в течение 1820 часов. При наличии токсигенности в местах соединения токсина с антитоксическими антителами в питательной среде образуются белые линии преципитата, напоминающие усики. Для определения токсигенности дифтерийных бактерий также разработаны ИФА и ПЦР.
Цистиназу у выделенных культур (проба Пизу) определяют путем посева методом укола петли исследуемой культуры на цистиновый МПА с азотнокислым свинцом. Посевы помещают на сутки в термостат при 370 С. При наличии цистиназы в среде образуется почернение (образование сульфида свинца) по ходу укола, вокруг которого появляется коричневое облачко.
Выделенную культуру идентифицируют и дифференцируют от сходных с ней непатогенных коринебактерий по биологическим свойствам (табл. 16). Для определения уреазы петлю исследуемой культуры вносят в пробирку, содержащую спиртовый раствор мочевины и индикатор феноловый красный. Пробирку выдерживают 30 минут в термостате при 370 С, при наличии уреазы содержимое пробирки окрашивается в красный цвет.
При выделении нетоксигенной культуры ставят реакцию агглютинации с противодифтерийной сывороткой для выявления видового антигена Corynebacterium diphtheriae.
Серологический метод – РА, РНГА с целью определения антител в парных сыворотках крови больных дифтерией.
Таблица 16. Биологические свойства коринебактерий
Вид |
|
|
ферментация |
|
|
|
|
||
|
Волютин |
Гемолиз |
сахарозы |
глюкозы |
крахмала |
токсин |
цистиназа |
уреаза |
РА с ПДС |
C. diphtheriae |
|
|
|
|
|
|
|
|
|
биовар |
+ |
- |
- |
+ |
+ |
± |
+ |
- |
+ |
биовар |
+ |
+ |
|
+ |
- |
± |
+ |
- |
+ |
C.xerosis |
± |
- |
+ |
+ |
- |
- |
- |
- |
- |
C. pseudodiphtheriae |
± |
- |
- |
- |
- |
- |
- |
+ |
- |
61

Самостоятельная работа студентов
1. Морфологические свойства возбудителя дифтерии – Corynebacterium diphtheriae
(мазок из чистой культуры, окраска по Нейссеру). Дифтерийные коринебактерии в препарате расположены в виде римской цифры V или X, по полюсам содержат темно-синие включения волютина.
2. Бактериологический метод. Изучение культуральных, ферментативных и антигенных свойств дифтерийной культуры:
учет роста дифтерийной палочки на среде Клауберга (МПА с теллуритом натрия, гли-
церином и дефибринированной кровью). Колонии мелкие, круглые с уплотнением в центре, при сплошном росте поверхность культуры выглядит в виде шагреневой кожи. Колонии биовара gravis серые, радиально исчерчены, напоминающие розетку, колонии биовара mitis - черные, круглые, выпуклые. Демонстрацию описать, зарисовать;
биохимические свойства коринебактерий представлены демонстрацией в соответствии
стаблицей. Описать, зарисовать;
определение токсигенности культур дифтерийных бактерий с помощью реакции пре-
ципитации в геле. На цистиновый МПА в чашке Петри нанесена полоска фильтровальной бумаги, пропитанной антитоксической противодифтерийной сывороткой, перепендикулярно которой засеяны исследуемые культуры. Если культура токсигенна, в местах соединения токсина
сантитоксином образуется преципитат в виде белых линий (усы);
цистиназная активность (проба Пизу) на столбике МПА с цистином посевом в виде укола. При наличии фермента отмечается почернение среды по ходу укола (образование сульфида свинца) и коричневое облако вокруг. Учесть демонстрационную реакцию;
наличие уреазы определяют в растворе с мочевиной и индикатором феноловым красным. При наличии фермента среда приобретает красный цвет. Учесть демонстрацию.
3.Серологический метод. Учесть демонстрационную РНГА для определения напряженности антитоксического иммунитета при дифтерии.
4.Биопрепараты для диагностики, профилактики и лечения дифтерии.
дифтерийный анатоксин - АД (токсин, обезвреженный формалином, очищенный от балластных веществ и адсорбированный с целью повышения иммуногенности на гидроксиде алюминия). Применяется для проведения активной иммунизации против дифтерии, входит в состав АДС (адсорбированного дифтерийно-столбнячного) анатоксина или АКДС (адсорбированной коклюшно-дифтерийно-столбнячной) вакцины.
противодифтерийная антитоксическая сыворотка, получаемая яз крови лошадей ги-
периммунизированных дифтерийным анатоксином, очищенная и концентрированная методом Диаферм-3 (диализ и ферментирование - для снижения молекулярной массы и удаления балластных веществ). Применяют для профилактики и лечения дифтерии.
агглютинирующие противодифтерийные сыворотки (поливалентные и типовые).
Применяются в диагностических целях для дифференциации дифтерийных бактерий от дифтероидов и для установления типа.
Микробиологическая диагностика коклюша и паракоклюша
Методы, применяемые для лабораторной диагностики коклюша, представлены в схеме 14.
Схема 14. Микробиологическая диагностика коклюша
Бактериологический метод Материал для исследования: мокрота, слизь из носоглотки
1 день. Посев материала на среду КУА или Борде-Жангу. Культивирование в течение
48-72 часов при 370 С.
2 день. Учет характера роста колоний на средах КУА или Борде-Жангу. Рост в виде мелких, выпуклых, блестящих колоний (капельки ртути). Мазок в окраске по Граму, постановка РА с агглютинирующими коклюшыми сыворотками, определение биологических свойств.
3 день. Учет проб на токсигенность, цистиназу. Формулировка ответа. Пересевы с кровяного МПА на специальные среды с целью полной идентификации дифтерийной 62 палочки и ее дифференциации от сходных непатогенных коринебактерий.
4 день. Окончательный ответ.

Серологический метод - РА и РСК с парными сыворотками больных для констатации нарастания титра антител с целью ретроспективного подтверждения
коклюша и диагностики его атипичных форм.
Генодиагностика - ПЦР для обнаружения специфических фрагментов ДНК возбудителя коклюша.
Микроскопический метод для диагностики коклюша и паракоклюша не применяется. В качестве экспресс-метода можно использовать ИФМ.
Бактериологический метод является основным в лабораторной диагностике коклюша и паракоклюша. Материал для исследования берут с помощью стерильного носоглоточного ватного тампона, у маленьких детей – тампоном на тонкой эластичной проволоке, а также методом «кашлевых пластинок» (в момент приступа кашля открытую чашку Петри с питательной средой подносят ко рту ребенка и держат в течение 6-8 кашлевых толчков). Для посева чаще всего используют казеиново-угольный агар (КУА), а также кровяной или картофельно-глицериновый кровяной агар (среда Борде-Жангу), содержащие пенициллин для подавления роста сопутствующей микрофлоры. Бордетеллы вырастают при температуре 370 С через 48-72 часа в виде мелких (около 1 мм в диаметре), выпуклых, блестящих колоний, напоминая капельки ртути (рис. 17). Из колоний готовят мазки и окрашивают их по Граму. При наличии в препаратах мелких овоидных грамотрицательных палочек ставят реакцию агглютинации с коклюшной и паракоклюшной сыворотками и делают пересев для выделения чистой культуры. Чистую культуру идентифицируют на основании изучения комплекса биологических свойств (табл. 17). Bordetella pertussis не растет на простых питательных средах, не меняет цвета специальных сред. Серотипирование проводится с помощью РА на стекле с адсорбированным факторными сыворотками. Фактор (антиген) 7 является родовым, общим для всех бордетелл, фактор 1 спе-
цифичен для Bordetella pertussis, фактор 14 – для Bordetella parapertussis фактор 12 – для
Bordetella bronchiseptica.
Рис. 17. Колонии Bordetella pertussis на КУА (выпуклые, блестящие в виде капелек ртути)
Таблица 17. Биологические свойства некоторых представителей рода Bordetella
Свойства |
B. pertussis |
B. parapertussis |
B. bronchiseptica |
Рост на МПА |
- |
+ (коричневая окраска) |
+ |
Рост на МПА с тирозином |
- |
+ (коричневая окраска) |
+ |
63
Подвижность |
- |
- |
+ |
Цвет на кровяном МПА |
- |
Буро-коричневый |
- |
Цвет на КУА |
- |
Потемнение |
- |
Уреаза |
- |
+ |
+ |
Оксидаза |
+ |
- |
+ |
Утилизация цитрата |
- |
- |
+ |
Родовой антиген |
7 |
7 |
7 |
Видовой антиген |
1 |
14 |
12 |
Обозначения: (+)- наличие признака, (-) – отсутствие признака.
Серодиагностика. Применяется РА и РСК (как правило, с парными сыворотками больных для констатации нарастания титра антител) с целью ретроспективного подтверждения диагноза и диагностики атипичных форм коклюша. Диагностический титр 1:20.
Генодиагностика. Разработана ПЦР для обнаружения ДНК возбудителя коклюша.
Самостоятельная работа студентов
1.Изучить морфологические и тинкториальные свойства возбудителя коклюша
(Bordetella pertussis) в демонстрационных препаратах из чистой культуры
2.Бактериологический метод. Изучить культуральные свойства возбудителя коклюша культивируются на казеиново-угольном агаре КУА или на среде Борде-Жангу (картофельноглицериновый МПА с кровью) - демонстрация. Колонии Bordetella pertussis мелкие, выпуклые, блестящие в виде капелек ртути. При микроскопии обнаруживают мелкие овоидные грамотрицательные палочки. Изучение ферментативных и антигенных свойств палочки коклюша (демонстрация в соответствии с табл. 17).
3.Серологический метод. Учесть демонстрационные РА и РСК, поставленные с парными сыворотками крови детей (10 и 21 дни болезни) с диагнозом «подозрение на коклюш». Диагностический титр 1:20
4.Биопрепараты для диагностики, профилактики и лечения коклюша:
АКДС-вакцина (адсорбированная коклюшно-дифтерийно-столбнячная вакцина) содержит взвесь убитых коклюшных бактерий, дифтерийный и столбнячный анатоксины, адсорбированные на гидроокиси алюминия. Применяется для активной иммунизации детей против перечисленных инфекций;
Тетракокк – комбинированная вакцина для профилактики дифтерии, коклюша, столбняка
иполиомиелита производства фирмы Пастер Мерье Коннот (Франция).
агглютинирующие сыворотки - для серологической идентификации коклюшных бакте-
рий;
иммуноглобулин донорский. Получен из венозной крови человека, содержит антитела против ряда патогенных микроорганизмов (включая бордетеллы), применяется для профилактики и лечения коклюша, создает пассивный иммунитет;
агглютинирующие адсорбированные факторные сыворотки. Диагностические сыво-
ротки, подвергнутые адсорбции родственными микробами с целью удаления групповых антител. Применяются для постановки РА при антигенной идентификации бордетелл.
Педиатрические аспекты темы
1.Коклюш - заболевание детского возраста. Бактериологическая диагностика коклюша в ранний период заболевания основана на выделении чистой культуры возбудителя и ее идентификации. Для забора материала у детей используется метод кашлевых пластинок и применяются носоглоточные тампоны (у грудных детей). Серологическая диагностика коклюша, проводимая на 3 - 4 неделях заболевания (РСК) имеет эпидемиологическое значение. В настоящее время увеличился удельный вес заболеваний, вызванных Bordetella parapertussis, что обусловливает необходимость разграничения между этими микроорганизмами.
2.Пневмококки у детей могут вызвать сепсис, менингит. Дети первого года жизни не болеют крупозной пневмонией. Трудности при диагностике пневмонии у детей раннего возраста
64
связаны с отсутствием спонтанного отделения мокроты.
Микробиологическая диагностика гемофильной инфекции
Возбудитель гемофильной инфекции - Haemophilus influenzae, способен вызывать гнойный менингит, острое воспаление верхних дыхательных путей, бронхит, пневмонию, эмпиему, конъюнктивит, отит и другие оппортунистические заболевания. Уровень носительства гемофильной палочки среди здоровых лиц высокий (до 90 %). Гемофильная инфекция у детей в возрасте до 3 лет протекает исключительно тяжело, особенно в случае возникновения острого эпиглоттита (воспаления надгортанника).
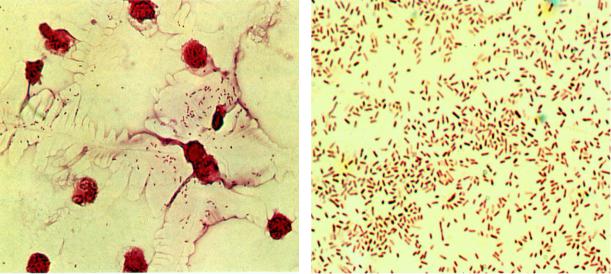
Бактериоскопический метод может быть использован при исследовании спинномозговой жидкости при подозрении на гнойный менингит (рис.18а).
а |
б |
Рис. 18. Гемофильная палочка |
- Haemophilus influenzae. а – мазок из спинно-мозговой жидко- |
сти, б - мазок из чистой культуры. Окраска по Граму. мелкие грамотрицательные палочки. х900
Бактериологический метод является основным в лабораторной диагностике гемофильной инфекции. Исследуемый материал (мокрота, кровь, спинномозговая жидкость, серозную жидкость) засевают на МПА с 6 - 10 % нативной крови или на «шоколадный» агар с прогретой или кипяченой кровью. Если возможности немедленно посеять материал на среды нет, используют транспортную полужидкую среду с активированным углем и ниацином.
Серозную и спинномозговую жидкости центрифугируют, осадок засевают бактериальной петлей на шоколадный агар (МПА с 5% дефибринированной крови человека, лошади или кролика выдерживают 2-3 минуты при температуре 800 С, повторно добавляют 5% крови и вновь выдерживают при той же температуре 2-3 минуты) или среду Филдса (МПА с добавлением пептического перевара крови лошади или барана). Параллельно делают посев на обычный МПА, на котором гемофильная палочка не растет.
Колонии Haemophilus influenzae мелкие, прозрачные или полупрозрачные, вырастают через 18-24 часа; в мазках из этих колоний обнаруживаются мелкие капсулообразующие или капсулонеобразующие грамотрицательные палочки (рис. 17б). Оставшуюся часть колонии пересевают на скошенный шоколадный МПА для выделения чистой культуры. Идентификацию гемофильных бактерий проводят на основании изучения биохимических (каталазная, оксидазная активность, ферментация углеводов, гемолитическая активность, питательные потребности) и антигенных (постановка РА на стекле с групповыми сыворотками а,b,с, d, e, f к капсульному антигену) свойств.
Для идентификации Haemophilus influenzae применяют также тест сателлитных колоний, для чего на поверхность шоколадного МПА наносят исследуемую культуру и в некоторые участки среды - штамм Staphylococcus aureus. Гемофильная палочка вырастает в виде мелких сателлит-
65
ных колоний, окружающих колонии S. aureus, так как стафилококк, гемолизируя кровь, высвобождает X и V факторы – стимуляторы роста Haemophilus influenzae.
Каталазу гемофильной палочки определяют по пенообразованию в капле 10% перекиси водорода на предметном стекле при внесении в нее исследуемой культуры. Оксидазу выявляют путем нанесения на диск фильтровальной бумаги, диаметром 5-7 см , 2-3 капель 1% раствора тетраметилпарафенилендиамина и исследуемой культуры, в результате чего через 10-15 сек. появляется фиолетовое окрашивание. Уреазу определяют общепринятым методом по
разложению мочевины с образованием щелочных продуктов в присутствии индикатора фенолового красного; при наличии уреазы среда приобретает ярко-малиновый цвет. Порфириновый тест выявляет способность Н. influence к синтезу -аминолевуленовой кислоты (АЛК) - потребности в факторе X. При внесении АЛК в среду только АЛК-независимые гемофильные бактерии синтезируют и секретируют порфобилиноген и порфирины (промежуточные соединения биосинтеза гема), тогда как АЛК-зависимые гемофильные палочки, нуждающиеся в факторе X, не способны к образованию указанных продуктов. Исследуемые бактерии засевают на шоколадный МПА, наносят на поверхность среды диски, пропитанные АЛК, и после 24-часовой выращивания в термостате при 370 С облучают УФ-лучами. При наличии Х-независимых микроорганизмов наблюдают кир- пично-красную флюоресценцию.
Для специфической профилактики гемофильной инфекции в России лицензирована полисахаридная вакцина, конъюгированная со столбнячным анатоксином (вакцина Act-HIB) фирмы Пастер Мерье Коннот, которая не содержит консервантов и антибиотиков.
МИКРОБИОЛОГИЧЕСКАЯ ДИАГНОСТИКА БАКТЕРИАЛЬНЫХ ПНЕВМОНИЙ И ОСТРЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ (ОРЗ)
Основным возбудителем (около 60%) бактериальных пневмоний в настоящее время явля-
ется пневмококк (Streptococcus pneumoniae), реже (30-40%) – клебсиеллы (Klebsiella pneumoniae), хламидии (Chlamydophila pneumoniae), микоплазмы (Mycoplasma pneumoniae), стафилококк (Staphylococcus aureus), гемофильные палочки (Haemophilus influenzae), легионеллы (Legionella pneumophila).
Подходы к лабораторной диагностике бактериальных пневмоний и ОРЗ, независимо от вида возбудителя, принципиально, одинаковы.
Материалом для исследования являются мокрота, отделяемое слизистой оболочки трахеи и бронхов, промывные воды бронхов, экссудат из плевральной полости, кровь, спинномозговая жидкость при менингите, отделяемое зева и носа при ОРЗ.
Микроскопический метод (микроскопия мазков из исследуемого материала, окрашенных по Граму) имеет ориентировочное значение. Наличие в препаратах значительного количества удлиненных ланцетовидных, грамположительных диплококков, окруженных капсулой (Streptococcus pneumoniae – рис. 19), скоплений грамположительных кокков в виде гроздьев (S.aureus) или грамотрицательных коккобактерий (H.influenzae) позволяет поставить предварительный диагноз бактериальной пневмонии и служить ориентиром для назначения антибактериальной терапии.
66
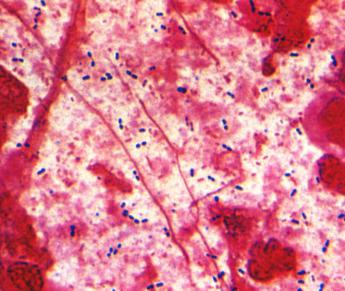
Рис. 19. Пневмококк (Streptococcus pneumoniae). Окраска по Граму. х 900 Бактериологическое исследование является ведущим методом диагностики пневмо-
ний и ОРЗ бактериальной этиологии, которое дает возможность не только выделить возбудителя инфекции, но и определить его чувствительность к антибиотикам.
Для выделения пневмококка (Streptococcus pneumoniae) осуществляют посев исследуемого материала на МПБ с глюкозой и на кровяной МПА. Посевы выращивают в термостате при 370 С в течение суток. Выросшие на кровяном МПА нежные колонии окружены зеленоватой зоной гемолиза. Из колоний готовят мазок, изучают морфологические и тинкториальные свойства, после чего остаток колонии пересевают на скошенный кровяной МПА или сахарный (или сывороточный) МПБ с целью выделения чистой культуры и ее идентификации на основании комплекса биологических свойств.
Дифференциация S.pneumoniae и S.pyogenes основывается на проверке чувствительности выделенной культуры к желчи и оптохину, а также способности ферментировать инулин.
Серотипирование пневмококка проводится с помощью РА на стекле с использованием типоспецифических пневмококковых сывороток (известно около 90 сероваров пневмококка, из которых 23 играют важную роль в патологии человека). Для серотипирования пневмококков может использоваться реакция Нейфельда (феномен набухания капсулы стрептококка в присутствии типоспецифической сыворотки).
Для изоляции клебсиелл выполняют посев исследуемого материала на МПА с пенициллином (для подавления сопутствующей микрофоры) в чашках Петри или на дифференциальнодиагностические среды с лактозой и индикатором бром-тимоловым синим, на которых спустя сутки культивирования при 370 С образуются блестящие выпуклые слизистые колонии (на дифференциально-диагностической среде колонии имеют желтый цвет в результате разложения лактозы). На 2 день колонии исследуют визуально и с помощью микроскопического метода (окраска по Граму и Гинсу-Бурри для выявления капсул), после чего пересевают типичные колонии на среду Ресселя или скошенный МПА для выделения чистой культуры возбудителя. На 3 день учитывают рост на указанных средах (окрашивание столбика и скошенной части среды Ресселя в желтый цвет с разрывами агара в результате расщепления глюкозы и лактозы с образованием газа) и проводят идентификацию культуры клебсиелл по основным биологическим свойствам (образование капсулы, отсутствие подвижности, биохимические и антигенные свойства).
Для выделения микоплазм производят посев на специальные питательные среды с добавлением сыворотки, на которых они не ранее чем через месяц после образуют характерные микроскопические колонии с ровными краями и зернистой структурой. Выделенную чистую культуру микоплазм идентифицируют по биохимическим и антигенным свойствам.
67
Выделение легионелл, являющихся медленно растущими микроорганизмами, осуществляют с применением селективных питательных сред сложного состава, содержащих дрожжевой экстракт и другие факторы роста, а также различные антибиотики для подавления роста сопутствующей микрофлоры. Легионеллы относятся к медленно растущим микроорганизмам, однако микроколонии, видимые под микроскопом, появляются на 2-е сутки роста, тогда как макроскопически видимые мелкие колонии (2-4 мм) правильной округлой формы, с ровными краями и блестящей поверхностью с характерным розовым или сине-зеленым ободком и опалесцирующим центром - через 3-5 суток. Идентификацию выделенной чистой культуры до уровня рода проводят на основании изучения биологических свойств. Для видовой идентификации разработаны ИФМ, газожидкостная хроматография, генодиагностика (рестрикционный анализ, метод ДНК-зондов).
Серологический метод диагностики пневмоний, вызванных пневмококками, микоплазмами, хламидиями и легионеллами при исследовании парных сывороток крови больных (в остром периоде и в стадию реконвалесценции) с помощью РСК, РНГА, ИФА не является клинически обязательным и имеет эпидемиологическое значение. Для определения антител к легионеллам используют, кроме того, непрямой ИФМ с антигеном из легионелл (диагностический титр
1:32 и более).
Экспресс-методы. Разработан иммуноферментный тест для определения в моче специфичного антигена легионелл, а также иммунохроматографический тест для выявления в моче пневмококкового антигена, однако широкое применение этих методов ограничено.
Генодиагностика. Предложена ПЦР для диагностики хламидиозов и микоплазмозов, однако метод широко в клинической практике не используется.
Биопроба. Исследуемый материал для выделения пневмококков вводят внутрибрюшинно белым мышам или морским свинкам. Культуру пневмококка выделяют из крови и органов погибшего или забитого животного, а также проводят бактериоскопию мазков-отпечатков, сделанных из его органов. В настоящее время метод практически не применяется.
Самостоятельная работа студентов
1.Микроскопия мазков из мокроты больного с подозрением на бактериальную пневмо-
нию и чистых культур Streptococcus pneumoniae и Klebsiella pneumoniae.
2.Знакомство с характером роста колоний S.pneumoniae на кровяном МПА и Klebsiella pneumoniae на обычном МПА (демонстрация).
3.Учет РСК с парными сыворотками крови больного с антигенами микоплазм и хламидий (демонстрация).
4.Знакомство с биопрепаратами для диагностики, профилактики и лечения ОРЗ и пневмоний бактериальной этиологии:
диагностические сыворотки для типирования пневмококков;
поливалентная полисахаридная пневмококковая вакцина из антигенов 23 наиболее распространенных сероваров S.pneumoniae;
диагностикумы клебсиеллезные для РСК и РНГА;
поливалентная полисахаридная клебсиеллезная вакцина из антигенов 24 наиболее распространенных сероваров K.pneumoniae;
диагностикум из микоплазм для постановки РСК и РНГА
полисахаридная вакцина Act-HIB фирмы Пастер Мерье Коннот против гемофильной инфекции, конъюгированная со столбнячным анатоксином.
После изучения темы студент должен знать: таксономию, морфологические и биологические свойства возбудителей дифтерии, коклюша, гемофильной и пневмококковой инфекции инфекции, а также патогенез, эпидемиологию, основные клинические проявления и иммунитет; основные методы диагностики, специфической профилактики и лечения этих инфекций.
Изучив тему, студент должен уметь: оценивать результаты микробиологических анализов при дифтерии, коклюше, гемофильной и пневмококковой инфекции.
68
Тема 9. ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ ВОЗДУШНО-КАПЕЛЬНЫХ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ: ТУБЕРКУЛЕЗА, МЕНИНГОКОКОВОЙ ИНФЕКЦИИ И АКТИНОМИКОЗА
Цель занятия: изучение биологических свойств основных возбудителей бактериальных воздушно-капельных инфекций – туберкулеза, менингококковой инфекции и актиномикоза, методов их лабораторной диагностики, профилактики и лечения.
Перечень конкретных учебно-целевых вопросов
1. Микобактерии. Таксономия. Экология.
2 . Воз б уди т ель т уб ерк улез а . Морфологические, культуральные, биохимические, антигенные и аллергенные свойства. Особенности химического состава и резистентность. Факторы патогенности. Патогенез туберкулеза, особенности иммунитета. Лабораторная диагностика. Специфическое лечение и профилактика.
3. Возбудители микобактериозов.
4 . Воз б уди т ель леп ры . Морфология, культивирование. Патогенез заболевания, иммунитет. Лабораторная диагностика. Антимикробные препараты.
5 . Мен и н гок окк и . Таксономия. Биологические свойства. Патогенез менингококковой инфекции. Микробиологическая диагностика. Препараты для специфической профилактики и этиотропного лечения.
6. Актиномицеты. Возбудитель актиномикоза. Экология. Резистентность. Морфологические и культуральные свойства. Патогенез заболевания. Иммунитет. Лабораторная диагностика. Антимикробные препараты. Иммунотерапия. Профилактика актиномикоза.
Лабораторная диагностика туберкулеза и микобактериозов
Легочные и внелегочные формы туберкулеза вызываются бактериями комплекса МТС (Mycobacterium tuberculosis complex), а также нетуберкулезными микобактериями комплекса MAC (M.avium complex, M.kansassii).Микобактерии комплекса МАС чаще поражают лиц с иммунодефицитами различной этиологии (прежде всего, больных СПИДом). Методы микробиологической диагностики туберкулеза представлены в схеме 15.
Схема 15. Микробиологическая диагностика туберкулеза
Материал для исследования: мокрота, промывные воды бронхов, желудка бронхоальвеолярная жидкость, плевральный эксудат, кровь, моча, испражнения, синовиальная жидкость, биоптаты различных тканей.
Микроскопический метод: люминесцентная микроскопия препаратов, окрашенных аурамином; мазки в окраске по Цилю-Нильсену
Бактериологический метод: посев на среду Левенштейна-Йенсена. Культивирование при температуре 370 С в течение 8 недель. Колонии М.tuberculosis крошкообразные или морщинистые, кремового цвета. Культивирование на кровяных средах по Прайсу в течение 7-14 дней, микроскопия микрокультур, окрашенных по Цилю-Нильсену. Идентификация выделенной культуры микобактерий д о вида по общепринятой схеме на основании изучения биологических свойств (типичной морфологии, характерных культуральных свойств, пигментообразования, продукции никотиновой кислоты - ниациновая проба, восстановления нитратов и теллурит калия,
гидролиза твина-80, уреазной, пиразинамидазной и каталазной активности и т.д.), а |
|
|||||
|
||||||
также с применением |
молекулярноСерологиче- ен тическихский метод(ДНК. РСК-гибридизация, РНГА др). идляхимическихопределения антител в сыворотке кро- |
|
|
|||
методов |
|
|
|
ви больных туберкулезом к микобактериям туберкулеза. Диагностического значе- |
|
|
|
|
|
|
ния метод не имеет. |
|
|
|
|
|
||||
|
|
|
|
|
|
|
АллеБиопргодиагноба на мостикарских свинках- внутрикожнаяили кроликахаллергическая. проба с туберкулином.
69
микориале улез-
Материалом для исследования является мокрота, промывные воды бронхов, желудка бронхоальвеолярная жидкость, плевральный эксудат, кровь, моча, испражнения, синовиальная жидкость, биоптаты различных тканей.
Первичная обработка материала заключается в его обработке с целью деконтаминации при наличии посторонней микрофлоры, а также разжижения, гомогенизации и флотации при исследовании мокроты, бронхоальвеолярной жидкости и т.д. Для этого материал обрабатывают муколитическими (N-ацетил-β-цистеин) и антибактериальными (1-2% NaOH) веществами, центрифугируют 20 мин при 3000 g и супернатант удаляют. Осадок ресуспендируют в небольшом количестве ИР.
Микроскопический метод заключается в микроскопическом исследовании мазков из исследуемого материала, окрашенных специальными методами с целью выявления кислотоустойчивых бактерий, что позволяет дать ориентировочное заключение. Отрицательный результат микроскопического исследования не является основанием для снятия диагноза «туберкулез». В настоящее время основным методом выявления микобактерий является люминесцентная микроскопия препаратов, окрашенных аурамином в концентрации 1:1000 в т ечение 15 минут с последующим обесцвечиванием 3% солянокислым спиртом в течение 30 сек, промывкой и докрашиванием мазка в течение 1 минуты водным раствором родамина 6ж в концентрации 1:5000. Микобактерии обладают ярким желтым свечением на темном фоне. Метод Циля-Нильсена применяется реже (рис. 20). Обычно по Цилю-Нильсену окрашивают мазки из чистых культур. Ограничением бактериоскопического метода является то, что он не позволяет дифференцировать микобактерии между собой и от других кислотоустойчивых микроорганизмов.
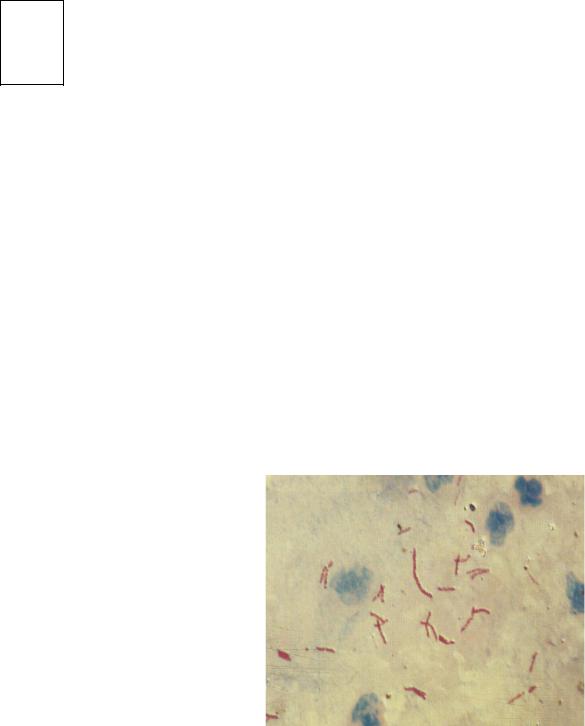
Рис. 20. Туберкулезная палочка (Mycobacterium tuberculosis) в мокроте больного. Окраска по Цилю-Нильсену. Рубиново-красные палочки (одиночные или скоплениями) на голубом фоне.
х 900
Бактериологический метод является основным методом диагностики туберкулеза, обладая высокой чувствительностью и специфичностью.
Для культивирования микобактерий наиболее часто применяют среду ЛевенштейнаЙенсена, содержащую суспензию свежих яиц, крахмал, глицерин, аспарагин, КН3РО4, сульфат
ицитрат магния, а также краситель малахитовый зеленый. Среду свертывают в наклонном положении при 850 С в течение 45 мин. Применяются также другие яичные среды (Финна, мордовского)
исинтетические жидкие питательные среды.Посевы инкубируют в термостате при температуре
70
