
Chastnaya_mikrobiologia
.pdfности глотки, миндалин, участков воспаления и налетов. Тампон помещают в пробирку (с транспортной средой или без нее) и в течение 2 часов доставляют в лабораторию.
Материал из носовой полости (отдельно из правой и левой ноздри, избегая контакта тампона с кожей носа) забирают сухим стерильным ватным тампоном, который вводят в глубь полости носа. Если при этом начинается чихание, тампон не удаляют до его окончания.
Материал из носоглотки берут стерильным заднеглоточным ватным тампоном, для чего его осторожно вводят через носовое отверстие в носоглотку. Если при этом начинается кашель, тампон не удаляют до его окончания. Для проведения анализов на дифтерию исследуют одновременно пленки и слизь из носа и глотки. Материал из носа и глотки берут разными тампонами. При подозрении на клебсиеллы, независимо от места локализации процесса, исследуют материал из носоглотки и обеих половин носовой полости.
Взятие материала из уха.
При поражении наружного уха проводят обработку стерильным физиологическим раствором, затем стерильный ватный тампон вводят в ушной канал и после пропитывания его секретом помещают в пробирку с транспортной средой. Исследуют также пунктаты их уха и материал, полученный во время оперативных вмешательств на ухе. Исследуемый материал собирают в стерильную пробирку или в пробирку с питательным бульоном.
Взятие отделяемого из ран, язв, брюшной полости
Взятие материала производит лечащий врач с соблюдением правил асептики. Кожу вокруг раны предварительно обрабатывают 70% спиртом или другим антисептиком, удаляя некротические массы, гной и детрит стерильной салфеткой. Материал берут двумя стерильными тампонами (один используют для приготовления мазка для микроскопии, др угой — для посева), осуществляя круговые вращательные движения от центра к периферии раны.
При наличии в ране дренажей для активной аспирации отделяемого его отсасывают шприцем и в количестве 1-2 мл помещают в стерильную пробирку. Кусочки тканей, гной, промывную жидкость из дренажа также берут в стерильные пробирки при соблюдении всех правил асептики.
Через 1 час после взятия материал должен быть доставлен в микробиологическую лабораторию для немедленного посева. При невозможности доставить материал в течение этого времени, он должен храниться в холодильнике не более двух часов.
Взятие материала из глаз.
Забор материала производит врач-окулист. Отделяемое конъюнктивы забирают предварительно прожженной в пламени спиртовки и остуженной платиновой петлей или стеклянными стерильными палочками. При наличии обильного гнойного отделяемого используют стерильные ватные тампоны, которыми берут гной с внутренней поверхности нижнего века движением к внутреннему углу глазной щели. При моргании ресницы не должны касаться тампона, для чего веки придерживают руками. Корочки гноя с краев век забирают пинцетом. Берут также материал из язвочек у основания ресниц.
Материал при исследовании роговицы после ее обезболивания отбирают платиновой петлей или другим подходящим инструментом. Если больной применяет контактные линзы, исследуют их внутреннюю поверхность. Взятый влажным тампоном материал наносят на поверхность предметного стекла, обезжиренного и прокаленного над пламенем горелки. Мазки высушивают, стекло маркируют и на его обратной стороне обводят границы мазка. В кабинете врача производят посев на сывороточный бульон и тиогликолевый бульон. Мазок и посевы затем доставляются в лабораторию для исследования.
Взятие материала из женских половых органов
Взятие материала для микробиологического исследования проводит врач акушергинеколог. Отделяемое вульвы и преддверия влагалища берут стерильным ватным тампоном. При воспалении бартолиниевых желез производят их пункцию, при вскрытии абсцесса железы гной берут стерильным ватным тампоном.
218
Материал из влагалища для посева должен быть взят до проведения мануального исследования с помощью стерильного ватного тампона из заднего свода или с патологически измененных участков слизистой оболочки после введения зеркала и подъемника.
Влагалищную часть шейки матки обнажают в зеркалах, тщательно обрабатывают ватным тампоном, смоченным стерильным физиологическим раствором или стерильной водой. Тонким ватным тампоном, осторожно введенным в цсрвикальный канал, берут материал для исследования, не касаясь стенок влагалища. Исследуется также соскоб слизистой оболочки шейки матки, полученный при диагностическом выскабливании стенок цервикального канала.
Грамотное взятие материала из матки может быть выполнено только при использовании специальных инструментов типа шприца-аспиратора, имеющего на зонде покрытие. После прохождения зондом цервикального канала в полости матки раскрывают наружную оболочку зонда и набирают в шприц содержимое матки, после чего закрывают наружную оболочку и зонд выводят из матки.
При воспалительном процессе в придатках матки получение материала из очага инфекции (гной, экссудат, кусочки органов) возможно только при оперативном вмешательстве или при проведении диагностической пункции опухолевидных образовании в малом тазу, проводимой через влагалищные своды.
Если очаг инфекции в придатках матки сообщается с полостью матки, ценную информацию дают повторные исследования отделяемого цервикального канала.
При подозрении на анаэробную инфекцию посев должен быть выполнен сразу же после взятия материала путем помещения тампона в пробирку с тиогликолевым полужидким агаром.
Параллельно с взятием материала на посев врач акушер-гинеколог готовит не менее 2 мазков для микроскопии, используя для этого стерильные тампоны или стерильные гинекологические инструменты. При изготовлении мазков материал распределяют на предметном стекле равномерно, мягкими движениями, избегая грубого втирания и резких штриховых движений инструментом или тампоном. Мазок высушивают при комнатной температуре, покрывают чистым предметным стеклом или помещают в чашку Петри и отправляют в лаборат о- рию. Хранение влажного мазка, сдавленного между двумя стеклами, не допускается.
Взятие материала при аутопсии
Основным условием для получения достоверных результатов микробиологического исследования и их грамотной интерпретации является раннее (не позднее 12 часов после смерти больного) взятие материала (даже при хранении трупа при пониженной температ у- ре). Материал для микробиологического исследования берет персонал морга (врач и его помощник) с соблюдением правил асептики. Пробы крови получают из левого желудочка сердца шприцем или пастеровской пипеткой. Пункцию и биопсию проводят после обработки исследуемого участка 3% перекисью водорода с последующим удалением антисептика стерильным физиологическим раствором. 2—3 кусочка органов или тканей, величиной по 0,5—1 см3 , помещают с соблюдением правил асептики в стерильные чашки Петри или в пробирки. Гной из вскрытых полостей, спинномозговую жидкость и т.д. отсасывают шприцем и в количестве 1-5 мл помещают в стерильные пробирки. Поверхностные секреты собирают бактериологическим тампоном.
Материал, взятый от трупа больного с гнойно-воспалительной патологией, вызванной условно-патогенными бактериями, должен быть доставлен в лабораторию в течение часа. В направлении дополнительно указывают дату и время смерти.
Взятие, условия хранения и доставки венозной крови для проведения ИФА и ПЦР.
Взятие венозной крови производится натощак, в утренние часы. Отбор производится в центрифужные одноразовые пробирки, для ПЦР - со специальными реагентами. Для ИФА берется 5 мл крови, для ПЦР - 2,5 мл. Пробирки с кровью должны быть промаркированы, упакованы, плотно закрыты и должны быть доставлены в лабораторию в течение 1 часа. Если доставка крови в лабораторию осуществляется в течение дня, то она хранится при температуре +4-+60
219
С, затем в специальных транспортных контейнерах (в ледяной бане) доставляется в лабораторию.
Взятие материала для ПЦР исследований при урогенитальных инфекциях.
Поскольку урогенитальные инфекции нередко вызываются внутриклеточными паразитами, размножающимися в клетках цилиндрического эпителия уретры или цервикального канала, в исследуемом материале должно быть значительное содержание этих клеток при минимальном количестве слизи и примеси крови. Неправильный отбор материала при этих инфекциях нередко приводит к ложноположительным и ложноотрицательным результатам.
Отбор осуществляется специальным зондом, который вводится в уретру (на глубину 1,0 1,5 см у женщин и на 3-4 см у мужчин) или в цервикальный канал (на глубину 0,5 -1,5 см) после удаления слизи. При наличии эрозии цервикального канала необходима его обработка стерильным физиологическим раствором. Материал берут на границе здоровой и измененной ткани. При введении и извлечении зонда необходимо полностью исключить его касание стенок влагалища.
Зонд опускают в пробирку с транспортной средой, где его несколько раз вращают, а затем удаляют из пробирки. Пробирку закрывают и маркируют. Транспортировку биологического материала для ПЦР производят только в сумке-холодильнике. Если пробирку с биологическим материалом невозможно доставить в лабораторию ПЦР в течение 2 часов, то ее следует заморозить при температуре -200 С. В замороженном виде проба для ПЦР может храниться не более 2 недель.
Приложение2
ПРАВИЛА ВЗЯТИЯ И ДОСТАВКИ БИОЛОГИЧЕСКИХ МАТЕРИАЛОВ ДЛЯ ВИРУСОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ
Любые пробы (в том числе нестерильные, например, фекалии) для вирусологического исследования берут, соблюдая правила асептики, с целью предотвращения его дополнительного загрязнения посторонней микрофлорой. Взятые для исследования материалы рекомендуется помещать в стеклянные флаконы или посуду из нетоксичной пластмассы с завинчивающейся пробкой. Пробы следует сохранять влажными и на холоду, не замораживая, поскольку ряд вирусов (в частности, возбудители респираторных вирусных инфекций) характеризуется низкой выживаемостью во внешней среде. Для сохранения жизнеспособности вирусов некоторые пробы (мазки из носоглотки, соскобы кожных поражений) погружают в стабилизирующую среду, состоящую из нейтрального изотонического раствора, белка и антибиотиков. Можно также пользоваться раствором Хенкса или средами для тканевых культур (гидролизат лактальбумина, среды 199, Игла и т.д., содержащие 10% прогретой сыворотки крупного рогатого скота или бычьего альбумина) с антибиотиками (200-1000 ЕД пенициллина, 200-1000 мг стрептомицина и 50-100 ЕД нистатина), подавляющими рост бактерий и грибов, которые приводят к аутолизу белков и разрушению вирусов.
КРОВЬ.
Для выделения вирусов и серологического исследования берут 10 мл крови. Сыворотку крови, взятую для серологических исследований, в случае ее возможной нестерильности, можно заморозить, что предотвращает бактериальный рост и сохраняет ранние макроглобулиновые антитела. Первую пробу крови для серологического исследования берут на 3-4 дни болезни, вторую – на 1015. Так как при некоторых вирусных инфекциях антитела накапливаются медленно, целесообразно взять третью пробу на 25-30-й день.
МАТЕРИАЛ ИЗ ВЕРХНИХ ДЫХАТЕЛЬНЫХ ПУТЕЙ.
Мазки из глотки берут ватным тампоном, не касаясь языка и щек, тщательно протирая заднюю стенку глотки, после чего опускают тампон в стабилизирующую среду. У детей в возрасте до 2 лет вирусы можно выделять из носоглоточного секрета. Из него делают также мазки для исследования методом иммунофлюоресценции.
СПИННОМОЗГОВАЯ ЖИДКОСТЬ.
Вирусы из спинномозговой жидкости выделяют при при менингитах, реже при энцефалитах.
220
ФЕКАЛИИ.
Кусочки кала, массой 4-8 г, помещают в сухой стерильный флакон. Можно также исследовать ректальные мазки, однако частота выделения вируса из них ниже, чем из кала.
СОСКОБЫ И МАЗКИ С КОНЪЮНКТИВЫ.
Соскоб с конъюнктивы снимают тонким стерильным шпателем после локальной легкой анестезии и делают мазок на предметном стекле. Для выделения вируса производят смыв с конъюнктивы стабилизирующей средой или берут пробу тампоном, помещая его затем во флакон со средой.
КОЖНЫЕ ПОРАЖЕНИЯ.
Исследованию подвергают поврежденные участки (везикулярная жидкость, корочки, кусочки опухоли и т.п.).
ТРУПНЫЙ МАТЕРИАЛ.
Желательно брать как можно скорее, так как содержание вируса в тканях после смерти резко снижается в результате их аутолиза, вызванного размножением бактерий. Образцы для выделения вируса берут, соблюдая правила асептики, одновременно помещая их в формалин для выполнения гистологических исследований.
ТРАНСПОРТИРОВКА.
Доставка проб в лабораторию должна осуществляться в максимально короткий срок, так как содержание вируса в отсутствие живых клеток быстро снижается. Повторное замораживание и оттаивание губительны для ряда вирусов (особенно возбудителей респираторных вирусных инфекций), поэтому при транспортировании образцы помещают в контейнеры с температурой 2-40 С. Если время доставки превышает 30-40 мин и пробы не могут быть тотчас исследованы, материал замораживают при -80°С в сухом льду или помещают в жидкий азот при –1800 С.
221
222
|
|
а |
б |
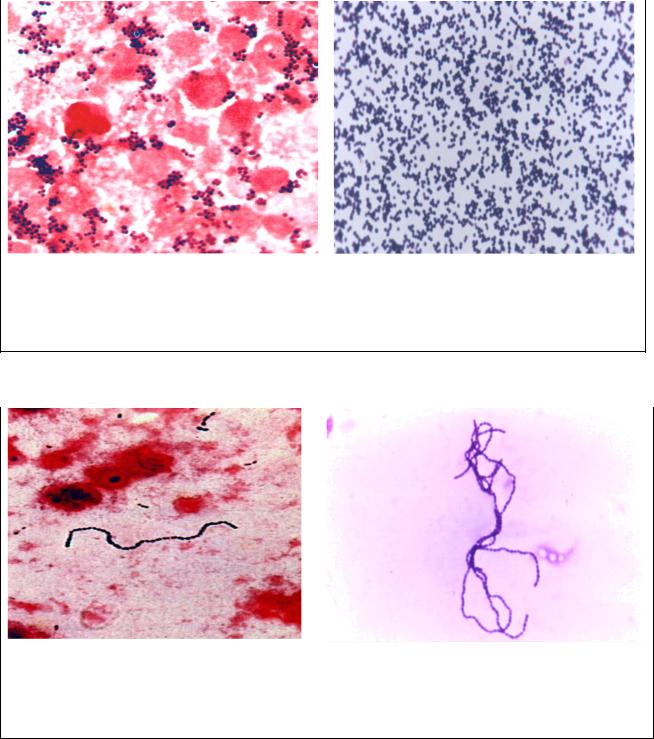
Рис. 1. Стафилококк - Staphylococcus aureus. а – мазок из исследуемого материала, б - мазок из чистой культуры. Окраска по Граму. Скопления кокков в виде гроздьев винограда.
х900
|
|
а |
б |
Рис. 2. Стрептококк (Streptococcus pyogenes). а – мазок из исследуемого материала, б - мазок из чистой культуры. Окраска по Граму. Грамположительные кокки, расположенные в виде цепочек. х900
224
225
Схема 3. Микробиологическая диагностика анаэробных инфекций
226
