
Chastnaya_mikrobiologia
.pdf1.Сыпной тиф у детей протекает значительно легче, чем у взрослых. Типична кратковременная лихорадка (до I недели), сыпи часто не бывает. В связи со стертой клинической картиной микробиологическая диагностика приобретает большое практическое значение.
2.Дети заражаются Ку-лихорадкой через некипяченое молоко и молочные продукты, при купании в водоемах, загрязненных больными животными. Возможно заражение Кy-лихорадкой через молоко больной матери.
3.Кy-лихорадка у детей протекает по типу тифо-паратифозного заболевания у 50% больных или сходно с гриппом (у 30%). Иногда этот риккетсиоз протекает в виде пневмонии или в стертой форме.
После изучения темы студент должен знать: таксономию, морфологические и биологические свойства возбудителей риккетсиозов, а также патогенез, эпидемиологию, основные клинические проявления и иммунитет; основные методы диагностики, специфической профилактики и лечения этих инфекций.
Изучив тему, студент должен уметь: ставить РА при риккетсиозах, оценивать результаты микробиологических анализов при риккетсиозах.
Тема 12. ОБЩАЯ ВИРУСОЛОГИЯ: МОРФОЛОГИЯ И УЛЬТРАСТРУКТУРА ВИРУСОВ, МЕТОДЫ ИХ КУЛЬТИВИРОВАНИЯ. ЭКСПРЕСС-ДИАГНОСТИКА ВИРУСНЫХ ИНФЕКЦИЙ.
Цель занятия: разбор теоретических основ общей вирусологии (классификация, биологические свойства вирусов), освоение методов культивирования вирусов и экспрессдиагностики вирусных инфекций.
Перечень конкретных учебно-целевых вопросов
1.Вирусология, ее цели и задачи. Периоды развития вирусологии.
2.Классификация вирусов человека. Природа и происхождение вирусов.
3.Морфология вирусов. Форма и размеры вирусов. Принципы структурной организации
вирусов. Понятие о простых и сложных вирусах.
4.Вирион и его компоненты. Нуклеиновая кислота, капсид, капсомеры, сердцевина, суперкапсидная оболочка, пепломеры. Типы симметрии нуклеокапсида.
5.Особенности биологии вирусов. Химический состав вирионов: нуклеиновые кислоты, белки, липиды, углеводы и их особенности. Ферменты вирусов.
6.Типы взаимодействия вирусов с клеткой: продуктивный, абортивный, интегративный. Вирогения.
7.Методы культивирования вирусов на клеточных культурах, эмбрионах птиц, в организме лабораторных животных.
МЕТОДЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ ВИРУСНЫХ ИНФЕКЦИЙ
Лабораторная диагностика вирусных инфекций базируется на 3 группах методов: Вирусологический метод - выделение вируса из исследуемого материала и его идентифика-
ция.
Серологический метод - определение в сыворотке крови больных специфических противовирусных антител с помощью разнообразных иммунологических реакций.
Генодиагностика - обнаружение в материале от больного специфичных для данного вируса фрагментов нуклеиновых кислот вирусов-возбудителей с помощью метода зондов (гибридизация НК) или ПЦР.
Прямое вирусоскопическое исследование мазков из клинического материала, окрашенных анилиновыми красителями, с целью выявления вирусов в настоящее время в практике работы вирусологических лабораторий проводится редко. Чаще применяются с целью поиска антигенов вируса ИФМ или микроскопический вариант ИФА как экспресс-методы диагностики вирусных инфекций.
Взятие и подготовка материала для вирусологической диагностики
91
Вирусологическому исследованию подвергают содержимое везикул, пустул, соскобы эпителия, спинномозговую жидкость, фекалии, мазки и смывы из верхних дыхательных путей, взятые у больного с соблюдением правил асептики в ранние стадии вирусной инфекции. Мазки из носоглотки и кожные соскобы помещают в ИРХН или раствор Хенкса с 10% сыворотки крупного рогатого скота и антибиотиками (для подавления сопутствующей микрофлоры). Исследуемый материал хранят и пересылают в вирусологическую лабораторию в специальных контейнерах с сухим льдом. Пробы можно сохранять в условиях глубокой заморозки (-700 С).
Вирусологический метод
Поскольку вирусы относятся к облигатным внутриклеточным паразитам и на искусственных питательных средах не растут, для их культивирования применяются живые системы (культуры клеток, развивающиеся куриные эмбрионы, чувствительные лабораторные животные).
Выделение вирусов на культурах клеток
В практике вирусологических лабораторий для выделения вирусов используют первичнотрипсинированные, полуперевиваемые (диплоидные) и перевиваемые клеточные культуры.
Первично-трипсинированные культуры клеток можно получить из любых органов и тканей человека, животных, насекомых, растений, однако наиболее часто используются эмбриональные ткани (фибробласты куриного эмбриона, человека, и др.), обладающие повышенной способностью к росту и размножению.
Для получения клеточной взвеси ткань отмывают от крови в растворе Хенкса, измельчают ножницами и несколько раз обрабатывают трипсином на магнитной мешалке или путем пипетирования. Затем взвесь клеток отмывают от трипсина раствором Хенкса путем центрифугирования при 600 об/мин в течение 5—10 мин, ресуспендируют в питательной среде и определяют концентрацию клеток в камере Горяева. Клеточную взвесь разводят питательной средой (обычно среда № 199 с добавлением сыворотки крупного рогатого скота) до концентрации 4-8х105 клеток в 1 мл, разливают в культуральные сосуды, закрывают резиновыми пробками. Пробирки укладывают под углом 50. Культивирование клеток осуществляют в термостате при 35-370 С 48-96 часов, в течение которых формируется монослой клеток, прикрепляющийся к поверхности стекла (или пластика).
С помощью версена (натриевая соль этилендиаминотетрауксусной кислоты - ЭДТА) (реже трипсина), клетки можно снять с поверхности культуральной емкости и перенести их в другую емкость (произвести пассаж). Для этого в сосуды с клетками после отсасывания питательной среды наливают 0,02% раствор версена или 0,25% трипсина и помещают их на 3-5 мин в термостат. Затем версен или трипсин удаляют, в культуральный сосуд добавляют небольшое количество питательной среды, в которой суспендируют клетки, подсчитывают их количество, доводят их до требуемой концентрации и разливают в новые флаконы. Однако первично-трипсинизированные клеточные культуры не выдерживают более 5-10 пассажей.
Перевиваемые клеточные культуры, в отличие от первично-трипсинированных, переносят неограниченное число пассажей, так как обычно их получают из опухолевых клеток, и меющих высокие способности к росту. Широкое распространение в вирусологии получили культуры клеток карциномы шейки матки (HeLa), раковой опухоли гортани (НЕр-2), костного мозга больного раком легких (Detroit-б) и т.д. Созданы «банки» перевиваемых клеточных культур, в которых хранятся клетки, замороженные жидким азотом.
Полуперевиваемые (диплоидные) культуры получают путем нескольких пассажей, в результате чего формируется популяция клеток, способных выдержать до 60 пассажей, быстро размножаться, быть высокочувствительными ко многим вирусам, сохраняя при этом исходный набор хромосом.
Для культивирования клеток используются специальные стерильные питательные среды (например, среды 199, Игла, гидролизат лактальбумина и др.) с рН 7,2-7,6, содержащие полный набор аминокислот, витамины, факторы роста и набор минеральных веществ, к которым добавляют от 2 до 30 % сыворотки крови животных (сыворотка крупного рогатого скота, эмбриональная телячья сыворотка и др.), а также антибиотики для предотвращения роста бактериальной флоры.
92
Среды содержат индикатор феноловый красный, который имеет оранжево-желтый цвет при кислой реакции среды и красно-малиновый цвет в щелочной среде. Поддерживающие среды либо не содержат сыворотки, либо содержат ее в небольшом количестве. Их применяют для сохранения выросших клеток после заражения их вирусами.
Для выделения вирусов питательную среду из пробирок с культурой клеток удаляют, промывают монослой клеток раствором Хенкса для удаления сывороточных антител и ингибиторов, после чего в пробирку вносят 0,1-0,2 мл обработанного вируссодержащего материала. Через 3060 мин после заражения материал из пробирки удаляют, вносят 1 мл поддерживающей среды и пробирки помещают в термостат при 370 С для культивирования.
Выделение вирусов на развивающихся куриных эмбрионах
Для культивирования вирусов используют 6-15-дневные куриные эмбрионы. Заражение осуществляют на хорион-аллантоисную оболочку (ХАО), в желточный мешок, полость амниона и аллантоиса.
При заражении на ХАО скорлупу обрабатывают спиртом, йодом и снова спиртом. Скорлупу прокалывают над воздушным мешком, а сбоку в скорлупе делают отверстие размером 7x2 мм. Не повреждая оболочку под скорлупой, короткой тонкой иглой шприца наносят на ХАО 0,1—0,2 мл вирусосодержащего материала. Заражение в полость аллантоиса осуществляют путем введения исследуемого материала шприцем на глубину 10—15 мм через боковое отверстие в скорлупе.
В полость амниона вирусосодержащий материал вводят через отверстие на тупом конце яйца, при этом игла шприца должна быть направлена к телу эмбриона.
Дефекты скорлупы заливают стерильным парафином и эмбрионы помещают в термостат.
Выделение вирусов на экспериментальных животных.
Экспериментальные животные в вирусологии применяются для диагностики вирусных инфекций, получения иммунных противовирусных сывороток и компонентов крови (эритроцитов, лейкоцитов, плазмы и т.д.), моделирования вирусных инфекций с научными целями для изучения патогенеза, иммунитета, патоморфологии и т.д., а также для разработки способов специфической и неспецифической профилактики и лечения вирусных инфекций.
В вирусологии в качестве экспериментальных животных наиболее часто используются белые мыши, морские свинки, кролики, хомячки, хлопковые крысы, обезьяны. Чувствительной моделью при ряде вирусных инфекций являются новорожденные грызуны.
Правила заражения и вскрытия экспериментальных животных при вирусных и бактериальных инфекциях идентичны.
Экспресс-диагностика вирусных инфекций
Экспресс-диагностика вирусных инфекций применяется для выявления вирусов или их антигенов в различных видах клинического материал с помощью методов, характеризующихся высокой специфичностью, чувствительностью, информативностью и быстротой исполнения.
Реакция иммунофлюоресценции (прямой и непрямой методы РИФ) применяется для выявления вируса в материале, полученном от больных, в инфицированных культурах клеток и в организме чувствительных животных.
Иммунная электронная микроскопия (ИЭМ) отличается возможностью одновременной концентрации вируса и его идентификации с помощью специфической противовирусной сыворотки. Для этого вируссодержащий материал обрабатывают противовирусной сывороткой, затем добавляют фосфорно-вольфрамовую кислоту или уранилацетат, смесь наносят на пленку (подложку) и высушивают. При электронной микроскопии при положительном результате находят скопления вирусных частиц. ИЭМ применяют для выявления в исследуемом материале полиовирусов, цитомегаловирусов, вирусов гепатита А и В, некультивируемых вирусов (аденовирусов в ткани миндалин, энтеро- и ротавирусов в фекалиях, вирусов оспы в оспенном детрите).
Встречный иммуноэлектрофорез обычно применяется для обнаружения в сыворотках крови больных вирусных антигенов (например, HBsAg у больных гепатитом В). Реакцию ставят на стеклянных пластинах в слое агаре, в котором вырезают два параллельных ряда лунок. Сыворотки крови, содержащие антигены помещают в лунки, расположенные ближе к катоду, а соответствующие противовирусные сыворотки (антитела) - в лунки, находящиеся ближе к аноду, после че-
93
го проводят электрофорез, при котором HBsAg, с отрицательным зарядом передвигается к аноду, а антитела — к катоду. Учет реакции осуществляется через 12-24 часа, положительные результаты реакции характеризуются образованием линий преципитации между определяемым антигеном (HBsAg) и специфическим антителом.
Реакция гемадсорбции на твердой основе (РгадТО). Лунки полистироловых планшетов обрабатывают иммуноглобулином или иммунной сывороткой (например, против ротавирусов), вносят в них исследуемый вируссодержащий материал, через 30-60 мин лунки промывают буферным раствором, после чего добавляют взвесь сенсибилизированных специфическим иммуноглобулином эритроцитов и спустя 30-60 мин производят учет по наличию гемагглютинации. Если в исследуемом материале содержится специфический вирусный антиген, он соединяется с антителами иммуноглобулина (или сыворотки), адсорбированными на поверхности лунок, а затем с иммуноглобулинами на поверхности эритроцитов, в результате чего происходит гемагглютинация. В описанной модификации реакция применяется для выявления антигенов ротавирусов и других вирусов в фекалиях больных.
Самостоятельная работа студентов
1.Изучение морфологии вирусов по электронограммам.
2.Освоение методов обработки материалов для вирусологического исследования,
взятых от больных (носоглоточные смывы, испражнения и т.д.). Обязательными этапами этой обработки являются эмульгирование материала в растворе Хэнкса с последующим центрифугированием, отсасыванием надосадочной жидкости и добавлением к ней различных антибиотиков (пенициллин, стрептомицин, нистатин) для угнетения сопутствующей микрофлоры.
3.Освоение этапов приготовления первично-трипсинизированной культуры ткани.
Изучить этапы приготовления однослойной. трипсинизированной культуры клеток фибробластов человека. Кусочки эмбриональной ткани измельчить ножницами, пропипетировать в растворе Хенкса, поместить в пробирку, профильтровать. К осадку добавить раствор Хэнкса с трипсином. Перемешать осевшие дезагрегированные клетки, перенести на предметное стекло, изучить морфологию живых клеток в препарате "раздавленная капля", подсчитать их количест-
во в камере Горяева и внести в пробирку со средой 199 для получения монослоя клеток. Пробирки помещаются в термостат при 370 С на сутки для выращивания.
Изучение клеточных культур производится микроскопическим методом. Для этого пробирка помещается на предметный столик микроскопа; монослой клеток должен быть обращен вверх. Микроскопия проводится с вогнутым зеркалом под малым увеличением микроскопа, конденсор опускается вниз. В пробирке виден сплошной рост одноядерннх клеток в виде одного слоя.
4.Освоение методов культивирования вирусов на развивающихся куриных эмбрио-
нах (РКЭ) - заражение РКЭ в амниотическую, аллантоисную полости, на хорион-аллантоисиую оболочку.
Заражение в хорион-аллантоисную полость. Над отмеченным при овоскопии воздушным мешком производят обработку скорлупы спиртом, водой, затем снова спиртом. При закрытом способе заражения в аллантоисную полость в скорлупе над воздушным мешком делают отверстие стерильной иглой. В него вводят иглу шприца, при этом прокалывается хорионаллантоисная оболочка и игла погружается в аллантоисную полость на I - 2 мм (от поверхности скорлупы расстояние около 1,5 см), после чего вводят 0,2 мл исследуемого материала. Отверстие в скорлупной оболочке закрывают стерильным парафином.
Заражение на хорион-аллантоисную оболочку. После дезинфекции скорлупы последняя отрезается по краю воздушного мешка, дно которого выстлано белой кожистой подскорлупной оболочкой. Ее удаляют стерильным пинцетом, соблюдая осторожность, т.к. под ней расположена прозрачная, влажная, с развитыми сосудами хорион-аллантоисная оболочка, на которую наносят исследуемый материал. Дефект в скорлупе закрывают стеклянным колпачком или пластинкой, края которых предварительно погружаются в расплавленный парафин.
После заражения обоими способами эмбрион маркируют и помещают в термостат.
5.Экспресс-диагностика вирусных инфекций (обнаружение вируса или его компонен-
94
тов в клиническом материале, взятом от больного – демонстрация).
исследование мазков-отпечатков с целью обнаружения внутриклеточных включений. Микроскопия мазков-отпечатков с поверхности герпетических язв (окраска по РомановскомуГимза). Обратить внимание на наличие гигантских многоядерных клеток с внутриклеточными включениями.
исследование мазков-отпечатков со слизистой оболочки верхних дыхательных путей у больного гриппом иммунофлюоресцентным методом. Обратить внимание на светящиеся частицы, располагающиеся внутри клеток.
обнаружение антигенов вируса герпеса в клиническом материале твердофазным иммуноферментным методом.
молекулярная гибридизация (выявление вирусов, не размножающихся в культуре клеток или персистирующих вирусов - цитомегаловирусов, вирусов герпеса, энтеровирусов, ротавирусов и т.д.). Реакция основана на гибридизации комплементарных нитей вирусов с формированием двунитчатых структур. Наличие комплементарных нитей выявляют с помощью зондов, которыми являются ДНК и РНК, меченые ферментом. При добавления субстрата к зонду с ферментом происходит цветная реакция.
После изучения темы студент должен знать: классификацию вирусов, их основные свойства, методы культивирования вирусов и экспресс-диагностики вирусных инфекций.
Изучив тему, студент должен уметь: заражать и вскрывать куриные эмбрионы, трактовать данные экспресс-диагностики вирусных инфекций.
Тема 13. ОБЩАЯ ВИРУСОЛОГИЯ: ДИАГНОСТИКА ВИРУСНЫХ ИНФЕКЦИЙ. ВИРУСОЛОГИЧЕСКИЙ МЕТОД ИССЛЕДОВАНИЯ. ИНДИКАЦИЯ И ИДЕНТИФИКАЦИЯ ВИРУСОВ. СЕРОЛОГИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ ВИРУСНЫХ ИНФЕКЦИЙ.
Цель занятия: разбор теоретических основ общей вирусологии (репродукция и генетика вирусов, особенности вирусных инфекций и противовирусного иммунитета); знакомство с методами индикации и идентификации вирусов, серологическими реакциями, применяемыми для диагностики вирусных инфекций.
Перечень конкретных учебно-целевых вопросов
1.Репродукция вирусов. Основные стадии взаимодействия вирусов с клеткой: адсорбция, характеристика вирусных лигандов и клеточных рецепторов; проникновение в клетку, механизмы; депротеинизация; синтез вирусных макромолекул; сборка вирионов; выход из клетки, пути выхода.
2.Интерференция. Дефектные интерферирующие частицы и их значение в развитии вирусной инфекции. Вирусы-сателлиты. Интегративная инфекция.
3.Генетика вирусов. Значение вирусологии в развитии генетики. Организация генетического аппарата вирусов. ДНК и РНК – носители генетической информации.
4.Генетическая изменчивость вирусов: мутации и рекомбинации. Мутации, причины возникновения. Фенотипические проявления. Генетические взаимодействия между вирусами. Рекомбинация. Генетическая реактивация. Модификационная изменчивость вирусов: комплементация и фенотипическое смешивание.
5.Патогенетические особенности вирусных инфекций. Инфекционность вирусных нуклеиновых кислот. Острая и персистирующая вирусная инфекция.
6.Индикация вирусов на биологических моделях. Характеристика цитопатогенного действия вирусов в культурах клеток. Вирусные включения. Бляшкообразование под агаровым покрытием. Гемадсорбция.
7.Идентификация вирусов с помощью реакций иммунитета – РН, РСК, РТГА, РП, ИФА, РИА, РИФ и др.
8.Методы лабораторной диагностики вирусных инфекций: микроскопический, вирусологический, серологический, молекулярно-генетические (ПЦР, молекулярная гибридизация).
9.Особенности противовирусного иммунитета.
95

Методы выявления (индикация) и идентификации вирусов
Перед выявлением вируса в клетках его обычно отделяют от клеток хозяина путем их разрушения с помощью многократного замораживания и оттаивания или растирания со стерильным песком. Полученный вирусосодержащий материал центрифугируют или пропускают через бактериальный фильтр, обрабатывают антибиотиками для деконтаминации и предотвращения бактериального загрязнения.
Индикация вирусов
Для выявления (индикации) вирусов применяются следующие методы.
Индикация вирусов в культуре клеток осуществляется, прежде всего, по цитопатическому действию (ЦПД) вирусов, сроки и характер которого зависят от свойств вируса, проявляясь дегенеративными изменениями клеток с последующей их гибелью и отслаиванием от стекла (рис. 29).
Полная дегенерация клеток сопровождается значительными изменениями в виде пикноза ядра и цитоплазмы, отслаиванием клеточного монослоя от стекла. Частичная дегенерация культур клеток может протекать по следующим типам:
гроздеобразования (округление, увеличение и слияние клеток с образованием гроздевидных скоплений, типично для аденовирусов),
очаговой деструкции (очаги пораженных клеток на фоне в целом сохранившегося монослоя), характерной для вирусов гриппа;
симпластообразования (слияние клеток с образованием гигантских многоядерных клеток в виде симпластов или синцитиев, характерных для вирусов кори, паротита, парагриппа, респира- торно-синцитиального, герпеса, иммунодефицита человека).
Пролиферативный тип ЦПД с трансформацией клеток в злокачественные, обладающие неограниченными потенциями к росту, способны вызывать онкогенные вирусы.
Сроки, в течение которых наступает ЦПД, вариабельны (например, 1-2 дня у полиовирусов, 7-14 суток у аденовирусов).
Если в инфицированных культурах клеток ЦПД отсутствует или слабо выражено, проводят «слепые пассажи», т.е. заражают культуральной жидкостью новые культуры клеток.
а б
Рис. 29. Культура клеток почек обезьян (а – незараженная, б – цитопатическое действие вируса)
х200
Индикация вирусов с помощью реакции гемадсорбции (РГад). Сущность этой реакции за-
ключается в способности эритроцитов человека или животных адсорбироваться на поверхности
96
клеток, инфицированных рядом вирусов (например, орто и парамиксовирусов и др.) в ранние сроки их репродукции (до развития ЦПД) в результате действия гемагглютининов – гликопротеидов, входящих в состав суперкапсида вируса. Для постановки РГад в культуру клеток добавляют 0,2 мл 0,5%-й взвеси эритроцитов, выдерживают 15-20 мин при температуре 40, 200 или 370 С в зависимости от свойств вируса, после чего взвесь эритроцитов удаляют и производят учет реакции под малым увеличением микроскопа по скоплению эритроцитов на отдельных клетках или на всем монослое.
Индикация вирусов по цветной пробе. Принцип метода основан на определении кислых продуктов метаболизма, накаливающихся в клетке в процессе ее жизнедеятельности с помощью индикатора фенолового красного, меняющего свой цвет с красного в щелочной среде на оранжево-желтый в кислой среде. При заражении культуры клеток вирусами, вызывающими ЦПД (например, аденовирусы, энтеровирусы и др.), метаболизм клеток подавляется, рН среды не меняется и она остается окрашенной в красный цвет.
Индикация вирусов по внутриклеточным включениям. Репродукция некоторых вирусов
(оспы, герпеса, бешенства) приводит к образованию внутриклеточных включений, локализующихся в цитоплазме или в ядре клеток и представляющих собой скопления вируса (или его антигенов). Включения выявляют путем световой микроскопии культур клеток, окрашенных по Романовскому- Гимзе или другими методами, а также с помощью прямого флюорохромирования (например акридиновым оранжевым) с последующей микроскопией препаратов в люминесцентном микроскопе.
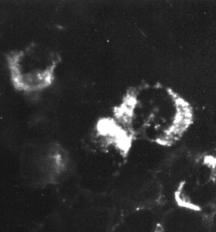
Индикация вирусов с помощью прямой РИФ – выявление вирусных антигенов, находя-
щихся в инфицированной клетке культуры ткани, с помощью антител диагностической иммунной сыворотки, специфических иммуноглобулинов или моноклональных антител, меченых флюорохромом, обычно флюоресцеином (рис. 30).
Индикация вирусов с помощью электронно-микроскопического метода (ЭММ) применя-
ется, в основном, в научных исследованиях. Материал для ЭММ концентрируют различными методами (ультрацентрифугирование, хроматография на колонках, адсорбцией с помощью специальных сорбентов или антител – для метода иммунной электронной микроскопии). ЭММ позволяет обнаружить в ядре или цитоплазме клеток отдельные вирионы, а также их скопления. В практических целях ЭММ может быть полезен для индикации и идентификации вирусов с типичной морфологией (оспенные вирусы, ротавирусы, коронавирусы, ВИЧ и т.д.).
Рис. 30. Реакция иммунофлюоресценции (РИФ) – выявление вирус-специфических антигенов. х900
Индикация вирусов по образованию бляшек - очагов разрушенных вирусом монослоя культуры клеток под агаровым покрытием. Количество бляшек отражает инфекционную активность вируса.
Для постановки этой пробы вирусную суспензию в разных разведениях вносят в культуры ткани, находящиеся в плоских сосудах, после чего монослой клеток заливают гелем (слой агара или бентонита с индикатором нейтральным красным). Время бляшкообразования для большин-
97
ства вирусов, обладающих ЦПД, варьирует от 36 до 48 ч. Бляшки выглядят в виде неокрашенных светлых пятен на розово-красном фоне окрашенного монослоя. В бентонитовом методе монослой клеток молочного цвета, бляшки прозрачные.
Индикация вирусов в куриных эмбрионах. Зараженные РКЭ инкубируют в термостате при 35370 С в течение 48 -72 ч., после чего производят их вскрытие, амниотическую и аллантоисную жидкость отсасывают шприцем, а оболочки и эмбрион извлекают и помещают в стерильные чашки Петри.
При репродукции некоторых вирусов (натуральной оспы, осповакцины, простого герпеса) на ХАО куриных эмбрионах появляются характерные бляшки - беловатые пятна диаметром 1-2 мм, количество которых соответствует числу инфекционных частиц.
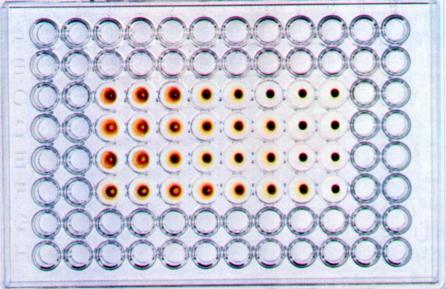
В аллантоисной и амниотической жидкости зараженных эмбрионов ряд вирусов (например, ортомиксовирусы, парамиксовирусы, аденовирусы и т.д.) может быть выявлен с помощью реакция гемагглютинации (РГА). Принцип реакции состоит в способности гемагглютининов - поверхностных вирусных структур гликопротеидной природы этих вирусов склеивать (агглютинировать) эритроциты определенных видов животных, птиц или человека. РГА не относится к иммунологическим реакциям, поскольку в ее основе отсутствует взаимодействие АГ и AT.
РГА ставят обычно в пробирках или в специальных полистироловых планшетах. Для этого готовят двукратные разведения вирусосодержащего материала на ФР в объеме 0,5 мл. Во все пробирки добавляют 0,5 мл 1% взвеси эритроцитов. В контроле к 0,5 мл ФР добавляют аналогичный объем взвеси эритроцитов. Пробы учитывают через 30-60 мин инкубации при комнатной температуре, в термостате при 370 С или в холодильнике при 40 С. Положительная реакция характеризуется выпадением осадка эритроцитов в виде «зонтика» с фестончатыми краями; при отрицательном результате эритроциты оседают в виде компактного осадка («пуговки» - рис. 31). Гемагглютинационный титр (максимальное разведение вирусосодержащей жидкости, вызывающее агглютинацию эритроцитов - одна гемагглютинирующая единица вируса,1 ГЕ) соответствует концентрации вируса. Агглютинацию эритроцитов могут вызывать также некоторые бактерии (стафилококки, эшерихии, сальмонеллы, шигеллы, холерный вибрион Эль-Тор), что необходимо учитывать при трактовке результатов РГА при исследовании вирус-содержащего материала, загрязненного бактериальной микрофлорой.
Определение титра вирусов можно проводить также на хорионаллантоисной оболочке. Для этого в лунки стерильных полистироловых пластин помещают кусочки скорлупы 11-12-дневного куриного эмбриона с неповрежденной ХАО, добавляют вирусосодержащую жидкость в десятикратных разведениях на буфере, накрывают пластины фольгой и инкубируют при 35-37 0 С в течение 2472 часов. После этого скорлупу удаляют, добавляют 0,5% взвесь куриных эритроцитов и производят учет реакции по эффекту гемагглютинации, который свидетельствует о репродукции вируса.
98
Рис. 31. Реакция гемагглютинации для выявления вируса гриппа в хорион-аллантоисной жидкости куриного эмбриона.
Индикация вирусов в организме лабораторных животных находится в зависимости от ви-
руса и вида чувствительного лабораторного животного, будет описана в лабораторной диагностике конкретных вирусных инфекций.
Идентификация вирусов
Проводится с помощью следующих методов.
Учет вирусиндуцированных патологических изменений в чувствительных живых системах.
Изучение антигенных свойств вирусов в серологических реакциях с противовирусными сы-
воротками является основным методом идентификации вирусов. Для этого используют ряд иммунологических реакций.
Реакция нейтрализации основана на способности антител нейтрализовать инфекционную активность вирусов в культурах ткани, РКЭ, чувствительных лабораторных животных. Из вируссодержащего материала готовят десятикратные разведения и добавляют к ним специфическую сыворотку в разведении в соответствии с титром, указанным на этикетке ампулы. Смеси вируссыворотка инкубируют 30 — 60 мин при 37 °С для обеспечения связывания антигенов с антителами, после чего смесью заражают культуру ткани, куриные эмбрионы или лабораторных животных. Контролем является чувствительная биосистема, зараженная вирусом без сыворотки.
Реакция считается положительной в случае нейтрализации ЦПД в культуре клеток, а также при отсутствии патологических изменений в куриных эмбрионах или в организме животных. По результатам РН высчитывается индекс нейтрализации (ИН - отношение титра вируса в контроле к титру вируса в опыте). При ИН менее 10 реакция расценивается как отрицательная, от 11 до 49
— сомнительная, от 50 и выше — положительная.
РН может быть поставлена в наиболее чувствительном варианте - подавления вирусного бляшкообразования под действием вирусспецифической антисыворотки. Для этого к вируссодержащему материалу добавляют соответствующую искомому вирусу антисыворотку и после инкубации в термостате при 370 С течение 30-60 мин смесь вносят в культуру чувствительных клеток. Бляшкообразование выявляют в слое агара или бентонита. Идентичность вируса антителам сыворотки проявляется подавлением бляшкообразования.
Другим вариантом РН является цветная проба. Положительный результат пробы в случае соответствия вируса противовирусным антителам проявляется блокадой репродукции вируса, клетка при этом остается жизнеспособной, вырабатывая кислые продукты метаболизма, под влиянием которых цвет индикатора (фенолового красного) меняется с красного на желтый. Для постановки пробы в пробирки вносят по 0,25 мл рабочего разведения вируса и соответствующую антисыворотку. Смесь выдерживают при комнатной температуре 30-60 мин, добавляют в каждую пробирку по 0,25 мл клеточной суспензии и закрывают их резиновыми пробками. Пробирки инкубируют в термостате при 370 С 6-8 дней, результаты реакции учитывают по изменению цвета индикатора (красный цвет индикатора соответствует щелочному характеру рН - 7,4 указывая на репродукцию вируса и подавление метаболизма клеток; желтый цвет свидетельствует о кислом рН - ниже 7,2 в результате нейтрализации вируса антителами и активном метаболизме клеток с выработкой кислых продуктов обмена).
Реакция торможения гемаггяютинации (РТГА) является одним из вариантов РН и основана на нейтрализации гемагглютинирующих свойств вирусов специфическими антителами, что проявляется отсутствием агглютинации чувствительных эритроцитов с формированием на дне пробирки или лунки полистиролового планшета компактного осадка вместо «зонтика». РТГА используется как для определения антител в качестве метода серологической диагностики, так и для идентификации вирусов, обладающих гемагглютининами. Феномен РТГА проявляется в образовании компактного осадка эритроцитов вместо «зонтика» гемагглютинации. Перед постановкой РТГА сыворотки обрабатывают периодатом калия, каолином, бентонитом, ацетоном или другими веществами для удаления неспецифических ингибиторов гемагглютинации. После этого к дву-
99
кратным разведениям сыворотки добавляют равное количество вируссодержащей жидкости с активностью 4 ГЕ, смесь инкубируют 30-60 мин при оптимальной для данного вируса температуре (40, 200, 370 С), а затем добавляют равный объем 0,5-1,0% взвеси эритроцитов. Смесь снова инкубируют 30-45 мин и производят учет результатов реакции. Титром сыворотки считают ее наибольшее разведение, которое вызывает торможение гемагглютинации.
Реакция торможения гемадсорбции (РТГадс) основана на нейтрализации эффекта адсорбции эритроцитов на поверхности клеток, инфицированных вирусами, способными вызывать гемадсорбцию. Для постановки реакции по 0,2 мл специфической сыворотки, разведенной 1:5, вносят в пробирки, инкубируют 30-60 мин в термостате при оптимальной для данного вируса температуре, затем добавляют по 0,2 мл 0,5% взвеси эритроцитов. Контрольные пробы содержат неиммунную сыворотку и эритроциты. Пробирки снова инкубируют 20-30 мин, после чего производят учет реакции. Идентификация вируса основывается на признаке отсутствия адсорбции эритроцитов на клетках в присутствии иммунной сыворотки при наличии гемадсорбции в контрольных пробирках.
Для антигенной идентификации вирусов в клетках культур тканей используются также РПГ, РСК, РИФ, РОПГА ИФА, РИА со специфическими иммунными противовирусными сыворотками или моноклональными AT.
выявление вирусной НК методами генодиагностики с помощью метода молекуляр-
ной гибридизации и ПЦР;
электронно-микроскопическое изучение вирусов (см. выше).
Серологический метод диагностики вирусных инфекций
Основан на определении в крови больного противовирусных антител в серологических реакциях с использованием специфических вирусных антигенов - диагностикумов или специальных тест-систем. Серологические реакции при вирусных инфекциях ставят в жидкой среде (РСК, РТГА, РНГА, РОНГА, РТОНГА, РИА), в геле (РПГ, РРГ, РВИЭФ) или на твердофазном носителе (например, на стенках лунки полистиролового планшета с фиксацией на них одного из компонентов иммунной реакции – антигена или антитела). Известны такие твердофазные методы как ИФА, ИЭМ, РГадсТО, РИФ, РГадс, РТГадс.
Нередко, вследствие наличия в крови большинства здоровых людей естественных противовирусных антител, серологическая диагностика вирусных инфекций основывается на исследовании парных сывороток, взятых в начале и в разгаре болезни или в периоде реконвалесценции с целью определения нарастания титра антител. Диагностически значимым считается нарастание титра антител в четыре раза и более.
Повышение чувствительности серологических методов достигается адсорбцией антигенов или антител на эритроцитах (РНГА, РОНГА, РТОНГА, РГадсТО, РРГ), меткой ферментами (ИФА), радиоактивными изотопами (РИА, РПГ) или флюорохромами (РИФ), Используется также принцип лизиса эритроцитов (как индикаторной системы) при взаимодействии антигенов и антител в присутствии комплемента (РСК, РРГ).
Реакция связывания комплемента (РСК) в виде варианта связывания комплемента на холоде (в течение ночи при температуре +40 С) часто применяется в вирусологии для ретроспективной диагностики ряда вирусных инфекций и для определения вирус-специфических антигенов в материалах от больных.
Реакция радиального гемолиза (РРГ) в агарозном геле основана на явлении гемолиза эритроцитов, сенсибилизированных антигеном, под влиянием вирусспецифических антител в присутствии комплемента и применяется для серологической диагностики гриппа, ОРВИ, краснухи, паротита, тогавирусных инфекций.
Для постановки реакции к бараньим эритроцитам (0,3 мл 10%-й суспензии) добавляют 0,1 мл неразведенного вирусного антигена и смесь выдерживают 10 мин при комнатной температуре. К 1,2% агарозе при температуре 420 С добавляют 0,3 мл сенсибилизированных эритроцитов и 0,1 мл комплемента, смесь разливают на предметные стекла или в лунки полистироловых планшетов, в застывшем геле агарозы с помощью пробойника вырезают отверстия и заполняют их исследуемыми и контрольной сыворотками. Стекла или панели закрывают крышкой и помещают
100
