
Chastnaya_mikrobiologia
.pdf
Перечень конкретных учебно-целевых вопросов
1 . Ши геллы . Биологические свойства. Патогенез дизентерии. Роль факторов инвазии, распространение, токсины шигелл. Иммунитет. Методы микробиологической диагностики. Проблема специфической профилактики. Этиотропная терапия.
2.Семейство Vibrionaceae. Таксономия. Характеристика основных свойств.
3.Холерные вибрионы, биологические свойства, биовары. Классификация вибрионов по Хейбергу. Факторы патогенности. Токсины и их характеристика. Патогенез и иммунитет при холере. Роль экосистемного механизма в распространении холеры. Вибрионосительство. Методы микробиологической диагностики. Специфическая профилактика и терапия холеры.
4.Биологические свойства палочки ботулизма. Характеристика экзотоксина. Лабораторная диагностика ботулизма. Принципы профилактики и лечения ботулизма.
5.Пищевые интоксикации стафилококковой этиологии и их лабораторная диагностика.
Лабораторная диагностика бактериальной дизентерии.
Дизентерия — антропонозное инфекционное заболевание, вызываемое бактериями рода Shigella, характеризующееся язвенным поражением толстого кишечника и общей интоксикацией организма. Классификация возбудителей дизентерии (шигелл) представлена в таблице 12, методы микробиологической диагностики в схеме 13.
|
|
Таблица 13. Классификация шигелл |
|
Виды шигелл |
|
Серовары шигелл |
|
Shigella dysenteriae |
|
1-12 |
|
Shigella flexneri |
|
1a, 1b, 2a, 2b, 3a, 3b, 4a, 4b, 5,6, var X, var Y |
|
Shigella boydii |
|
1-18 |
|
Shigella sonnei |
|
- |
|
|
Схема 12. Микробиологическая диагностика дизентерии |
||
Материал для исследования: испражнения больных, реконвалесцентов, носителей, рвотные массы, промывные воды желудка и кишечника, а также смывы с рук и с объектов внешней среды, пищевые продукты (особенно молоко).
Бактериологический метод
1 день. Посев материала на среды Плоскирева, Эндо и на селенитовую среду накопления. Культивирование в течение суток при 370 С.
2 день. Учет характера роста на средах Плоскирева и Эндо (бесцветные лактозоотрицательные гладкие колонии). Пересев типичной лактозоотрицательной колонии шигелл на среду Олькеницкого или Ресселя для выделения чистой культуры.
3-й день. Учет характера роста на средах Ресселя или Олькеницкого (пожелтение столбика среды в результате ферментации глюкозы в анаэробных условиях; скошенная часть среды без измененийотсутствие ферментации лактозы) Проверка чистоты выделенной культуры, определение вида и серовара по антигенной структуре с помощью ОРА. Пересев в среды «пестрого» ряда для изучения биохимических свойств, посевы для определения фаголизабильности, фаговара, колициновара, устойчивости к антибиотикам. .
4-й день. Учет результатов развернутой РА, изменений в средах «пестрого» ряда, фаголизабильности, фаговара, колициновара. Формулировка ответа
Экспресс-методы (индикация патогенной E.coli или ее продуктов в исследуемом материале) ДНК-зонды или ПЦР для выявления специфического фрагмента ДНК шигелл, РИФ
Серологический метод. Постановка РА, РНГА с целью выявления антител к шигеллам и их динамики (исследование парных сывороток) в процессе инфекции.
51
Микроскопический метод при дизентерии не применяется ввиду морфологического сходства шигелл с другими энтеробактериями.
Бактериологический метод является основным методом лабораторной диагностики дизентерии. Исследуемый материал засевают на среды Плоскирева и Эндо в чашках Петри, а также на селенитовую среду для накопления, с которой через 16— 18 ч делают пересев на указанные плотные питательные среды. Посевы выращивают в термостате при 370 С 18 — 24 часов.
На второй день изучают характер колоний. Бесцветные лактозоотрицательные гладкие колонии шигелл пересевают на одну из полиуглеводных сред (Олькеницкого, Ресселя, Клиглера) для накопления чистой культуры. На 3-й день учитывают характер роста на полиуглеводной среде, а также пересевают материал на дифференциальные среды (Гисса и др.) для биохимической идентификации выделенной культуры. Определяют антигенную структуру выделенной культуры с помощью ОРА с целью ее идентификации до уровней вида и серовара. На 4-й день учитывают результаты биохимической активности (табл. 14).
Таблица 14. Биохимические свойства шигелл
Виды шигелл |
|
|
Ферментация |
|
|
индол |
|
|
Глюкозы |
лактозы |
маннита |
дульцита |
ксилозы |
орнитина |
|
S. |
К |
- |
- |
- |
- |
- |
- |
dysenteriae |
|
|
|
|
|
|
|
S. flexneri |
К |
- |
к |
- |
- |
- |
- |
S. boydii |
К |
- |
к |
- |
± |
- |
- |
S. sonnei |
К |
± |
к |
к + |
± |
к |
+ |
Обозначения: «к» – ферментация субстрата с образованием кислоты, «+» - наличие признака, «-« - отсутствие признака, «±» - непостоянный признак.
Шигеллы, в отличие от эшерихий, являются неподвижными микроорганизмами, они не ферментируют лактозу, глюкозу разлагают без образования газа, не декарбоксилируют лизин. Для серотипирования сначала ставят РА на стекле со смесью сывороток против преобладающих в данной местности видов и вариантов шигелл, а затем РА на стекле с монорецепторными видовыми сыворотками. Определяют также чувствительность выделенной культуры к поливалентному дизентерийному бактериофагу и антибиотикам. С эпидемиологической целью определяют фаговар и колициновар выделенных шигелл. Одним из свойств шигелл является их способность вызывать кератит у морских свинок (кератоконъюнктивальная проба)
Серологический метод. Для определения антител в крови больных дизентерией (обычно хронической формой) применяют РНГА с эритроцитарными шигеллезными диагностикумами. Диагностические титры: к шигеллам Флекснера у взрослых - 1:400, у детей до 3 лет - 1:100, у детей старше 3 лет - 1:200, к остальным шигеллам - 1:200. Реакцию ставят, как правило, повторно с сывороткой крови, взятой не менее чем через 7 дней; диагностическое значение имеет нарастание титра антител в четыре и более раз.
Экспресс-методы при дизентерии - прямая и непрямая РИФ, реакция ко-агглютинации, ИФА, РНГА с антительными эритроцитарными диагностикумами для быстрого обнаружения шигелл в исследуемом материале (обычно в фекалиях), а также ПЦР.
Самостоятельная работа студентов
1.Изучить основные этапы выделения чистой культуры шигелл. Учесть посевы на среды Плоскирева, Левина, Олькеницкого (демонстрация). Отметить наличие лактозоотрицательных бесцветных колоний на средах Плоскирева, Левина.
2.Провести контроль чистоты выделенной культуры шигелл. Со среды Олькеницко-
го приготовить мазок, окрасить его по Граму и промикроскопировать. Промикроскопировать и зарисовать демонстрационные препараты возбудителей дизентерии Sh.dysenteriae, Sh.flexneri, Sh.sonnei - грамотрицательные палочки с закругленными краями;
3.Идентификация выделенной культуры шигелл:
52
по антигенным свойствам – постановка и учет РА на стекле со смесью видовых агг-
лютинирующих сывороток Sh.dysenteriae, Sh.flexneri, Sh.boydii, Sh. sonnei и культурой, выде-
ленной на среде Олькенипкого. Учет РА на стекле с видовыми дизентерийными сыворотками;
по ферментативным свойствам - учет биохимической активности и фаголизабельности выделенной культуры шигелл, (демонстрация).
4.Колициногенотипирование. Учесть пробу по определению колициногенотипа выделенной культуры (демонстрация). Техника постановки описана в разделе «Генетика микроорганизмов».
5.Определение чувствительности выделенной культуры к антибиотикам методом бумажных дисков (демонстрация).
6.Изучить биопрепараты, используемые для диагностики, лечения и профилактики бактериальной дизентерии и холеры:
агглютинирующие адсорбированные сыворотки к шигеллам Sh.dysenteriae, Sh.flexneri, Sh.boydii, Sh.sonnei. Используются для постановки реакции агглютинации при идентификации шигелл.
дизентерийный бактериофаг таблетированный. Используется для профилактики и лечения дизентерии.
диагностикумы эритроцитарные из шигелл Флекснера и Зонне. Используются для постановки РНГА при серодиагностике дизентерии.
вакцина дизентерийная ШИГЕЛЛВАК, из липополисахарида шигелл Зонне.
Микробиологическая диагностика холеры
Холера — особо опасное, карантинное инфекционное заболевание, вызываемое Vibrio cholerae биоваров cholerae и eltor, проявляющееся в виде острого гастроэнтерита с выраженной интоксикацией и обезвоживанием (эксикозом) в результате нарушения водно-электролитного обмена, cвязанного с выработкой вибрионами холерного энтеротоксина (холерогена).
Основной метод лабораторной диагностики холеры – бактериологический.
При выполнении исследований на холеру необходимо строго соблюдать требования противоэпидемического режима. Материал для исследования на холеру собирают в стерильную посуду, не содержащую следов дезинфицирующих растворов, упаковывают и доставляют в лабораторию. Банки, пробирки должны быть герметично закрыты водонепроницаемыми пробками, которые заливают парафином, посуду обвязывают двойным слоем вощеной бумаги и обрабатывают дезинфицирующим раствором. В направлении указывают фамилию, инициалы, возраст больного, его домашний и служебный адрес, диагноз, даты начала болезни и госпитализации, дату и час взятия материала, а также фамилию и инициалы лица, направившего анализ. Банки и пробирки с материалом для исследования перекладывают ватой, помещают, в металлическую коробку, а затем в деревянный ящик, который пломбируют, надписывают «Верх, осторожно» и на служебном транспорте с сопровождающим лицом пересылают в лабораторию в течение 2 часов после взятия проб.
Исследования на холеру проводятся круглосуточно в специальной лаборатории медицинскими работниками, прошедшими подготовку по особо-опасным инфекциям. Методы, применяемые для микробиологической диагностики холеры, представлены в схеме 13.
Микроскопический метод (микроскопия окрашенных мазков и препаратов «висячей капли» из материала от больного) при холере в настоящее время не применяется в связи с низкой его информативностью. Разработаны методы экспресс-диагностики холеры (РИФ).
Бактериологический метод состоит из нескольких этапов.
Первый этап. Исследуемый материал засевают на щелочные (элективные) плотные питательные среды (щелочной агар Монсура – МПА с триптиказой, хлоридом натрия, таурохолатом натрия, карбонатом натрия; TCBS - тиосульфат-цитрат-бромтимол-сахарозный агар; щелочной МПА) и жидкие среды обогащения (1% щелочная пептонная вода).
Второй этап проводится через 6 —8 ч от начала анализа. Выполняют пересев из верхней части 1-й среды накопления на плотные элективные питательные среды и на 2-ю среду накопления. При наличии на 1-й пептонной воде нежной голубоватой пленки из нее готовят мазок в ок-
53

раске по Граму, в котором обнаруживают грамотрицательные изогнутые в виде «запятой» вибрионы, проверяют подвижность, ставят ОРА с холерными сыворотками О-1, О-139 и RO, а также специфическую иммунофлюоресценцию.
Третий этап выполняется через 12— 14 ч от начала анализа. Производится пересев из верхней части 2-й среды накопления на плотные элективные питательные среды. Изучают и отбирают для исследования типичные для холерного вибриона колонии на плотных средах, засеянных нативным материалом.
Схема 13. Микробиологическая диагностика холеры
Материал для исследования: испражнения, рвотные массы, желчь, трупный материал (отрезки кишечника, желчного пузыря), пищевые продукты, вода
Бактериологический метод
1этап. Посев материала на щелочные среды (Монсура, TCBS, щелочной МПА, 1% щелочная пептонная вода -ПВ). Культивирование при 370 С.
2этап (через 6 —8 ч от начала анализа). Учет характера роста на ПВ (нежная голубоватая пленка), микроскопия мазков в окраске по Граму, проверка подвижности, РИФ. Пересев на плотные элективные питательные среды и на 2-ю среду накопления.
3этап (через 12— 14 ч от начала анализа). Пересев из 2-й среды накопления на плотные элективные питательные среды. Изучение, отбор и пересев на селективные среды типичных для холерного вибриона колоний (прозрачные, круглые, диаметром 1—2 мм, гладкие, плоские, гомогенные, с ровными краями колонии, голубоватого цвета; на агаре TCBS ярко-желтые колонии на зеленом фоне среды; на среде Монсура — полупрозрачные бесцветные с темным центром) с плотных сред, засеянных нативным материалом.
4этап. (через 18 —24 ч от начала анализа). Изучение и отбор типичных колоний на всех плотных средах, тест на оксидазу, ОРА с холерными сыворотками О-1, О-139 и RO,РИФ; пересев на щелочной МПА, среду Ресселя (или Олькеницкого) для выделения чистой культуры. Предварительный положительный ответ при наличии положительной РА или РИФ в сочетании с типичными морфологическими, тинкториальными и культуральными свойствами выделенной культуры.
5этап (через 24 —36 ч от начала анализа). Изучение характера роста на щелочном МПА, среде Ресселя (Олькеницкого) - расщепление сахарозы (покраснением среды в стоСерологическийлбике без образованияметод: Пгазаостановка), отсутствиеРА, РНГАферментации, теста иммобилизациилактозы. Микросковибрионовпия мазсковцельюв окраскевыявленияпо Грамуантител, тесткнахолерномоксидазу, ОРАвибрионус холери нымиих динамикисыворотками(исследование(О-1, RO,
|
парных сывороток) в процессе инфекции. |
|
|
Экспрес |
|
Огава, Инаба, при отрицательном результате - с сывороткой О-139). При положительном |
|
|
|
|
результате ОРА с одной из сывороток - ответ о выделении холерного вибриона. Пере- |
|
|
цитарны |
|
сев с целью окончательной идентификации оксидазопопожительных культур по сокра- |
|
|
ми сыво |
|
щенной или полной схемам. |
|
|
|
|
|
|
|
|
|
6 этап (через 36-48 ч от начала анализа) - окончательная идентификация выделенных |
|
|
|
|
культур, определение их чувствительности к антибиотикам, формулировка окончатель- |
|
|
|
|
ного ответа |
|
|
|
|
|
|
|
|
Четвертый этап. (через 18-24 ч от начала анализа). Изучают и отбирают с помощью стереомикроскопа типичные для холерного вибриона колонии на всех плотных средах. Холерный вибрион образует прозрачные, круглые, диаметром 1-2 мм, гладкие, плоские, гомогенные, с ровными краями колонии, имеющие голубоватый оттенок и маслянистую консистенцию. На агаре TCBS колонии холерного вибриона ярко-желтые на зеленом фоне среды, на среде Монсура — полупрозрачные бесцветные с темным центром. Колонии проверяют на наличие оксидазы (холерные вибрионы оксидазоположительны), ставят РА на стекле с холерными сыворотками О-1, О-139 и RO, а также специфическую иммунофлюоресценцию.
Положительная РА или ИФМ в сочетании с типичными морфологическими, тинкториальными и культуральными свойствами выделенной культуры позволяет выдать предварительный положительный ответ.
54
Пятый этап проводится через 24 —36 ч от начала исследования. На этом этапе изучают и отбирают характерные для холерного вибриона культуры на среде Ресселя, на которой холерный вибрион расщепляет сахарозу, что сопровождается покраснением среды в столбике без образования газа, но не ферментирует лактозу (отсутствие изменений скошенной части среды). Со среды Ресселя готовят мазки в окраске по Граму с целью обнаружения характерных по морфологическим свойствам вибрионов, проверяют наличие подвижности и оксидазы, ставят РА с холерными сыворотками (О-1, RO, Огава, Инаба, при отрицательном результате - с сывороткой О-139) и при наличии положительных результатов выдают ответ о выделении соответствующего холерного вибриона.
Окончательную идентификацию оксидазопопожительных культур проводят, используя сокращенную или полную схемы (табл. 15).
Таблица 15. |
Дифференциация холерных вибрионов |
||||
Тесты |
|
V.cholerae |
V.cholerae |
НАГ |
|
|
|
asiaticae |
el-tor |
|
|
Агглютинация О-сывороткой |
|
+ |
+ |
- |
|
Агглютинация сыворотками Инаба и Огава |
|
+ |
+ |
- |
|
Лизис фагами: |
|
|
|
|
|
Холерный фаг С (фаг IV) |
|
+ |
- |
+ |
|
Фаг Эль-Тор |
|
- |
+ |
+ |
|
Агглютинация куриных эритроцитов |
|
- |
+ |
+ |
|
Гемолиз эритроцитов барана |
|
- |
+ |
+ |
|
Рост на среде с полимиксином |
|
- |
+ |
+ |
|
Гексаминовый тест |
|
- |
+ |
+ |
|
Реакция Фогес-Проскауэра |
|
|
|
|
|
(образование ацетилметилкарбинола) |
|
- |
+ |
+ |
|
Сокращенная схема предполагает постановку развернутой РА с сыворотками Инаба и Огава, пробы с диагностическими холерными фагами, определение ферментативной группы по Хейбергу. Полная схема дополнительно включает тесты для дифференциации биоваров холерного вибриона (классического и Эль-Тор), в частности, определение гемагглютинирующих и гемолитических свойств, чувствительности к полимиксину, способности давать положительную реакцию ФогесПроскауэра (образование ацетилметилкарбинола - ацетоина из глюкозы). Ацетоин определяют добавлением в культуру, выращенную на глюкозо-фосфатном бульоне Кларка, 5% α-нафтола и 40%-го гидроксида калия; при встряхивании пробирок среда окрашивается в розовый или руби- ново-красный цвет.
Для ускоренной биохимической идентификации холерных вибрионов и их дифференциации от холероподобных и нехолероподобных вибрионов используют систему индикаторных бумажных дисков (СИБ), в состав которой входят тесты на оксидазу, индол, ферментацию лактозы, глюкозы, сахарозы, маннозы, арабинозы, маннита, инозита, аргинина, лизина и орнитина.
Шестой этап (выполняется через 36-48 ч от начала анализа) - окончательная идентификация выделенных культур, определение их чувствительности к антибиотикам, формулировка окончательного ответа о выделении холерного вибриона с указанием биовара, серогруппы (серовара) и эпидемической значимости по косвенным биологическим признакам (гемолитической активности, группе Хейберга и др.). Типичные культуры Vibrio cholerae представляют собой грамотрицательные изогнутые в виде запятой или прямые полиморфные активно подвижные палочки, обладающие оксидазой, разлагающие глюкозу с образованием кислоты без газа, декарбоксилирующие лизин и орнитин, но не ферментирующие аргинин, принадлежащие к 1-й (реже 2-й) группе Хейберга, агглютинирующиеся холерными сыворотками и лизирующиеся диагностическими фагами. Если выделенная культура не агглютинируется сыворотками к О1 и О139, ее относят к группе НАГ-вибрионов, а при наличии соответствующих сывороток определяют ее принадлежность к другой серогруппе. Токсигенные штаммы холерных вибрионов серогрупп О и О139 обычно не
55
лизируют бараньи эритроциты, относятся к 1-й группе Хейберга (ферментируют маннозу и сахарозу, но не арабинозу), лизируются определенными фагами в комплексном методе с применением ХДФ.
Вирулентность холерных вибрионов определяют в специализированных лабораториях путем внутрикишечного заражения кроликов-сосунков, а также методами генодиагностики (ПЦР или ДНК-ДНК-гибридизация с целью определения гена, ответственного за выработку токсина).
Серодиагностика является дополнительным методом лабораторной диагностики холеры. Исследуют парные сыворотки крови больных, взятые с интервалом в 6-8 дней, с целью выявления агглютининов с помощью РА (диагностический титр 1:40 и выше), антитоксинов с помощью РНГА с эритроцитарным холерным энтеротоксическим диагностикумом (диагностический титр - 1: 160) и вибриоцидных антител с помощью реакции иммобилизации вибрионов (диагностический титр1:1000). Учитывается также нарастание титра антител (не менее чем в 4 раза) в процессе инфекции.
Экспресс-диагностика - прямая и непрямая РИФ с использованием специфических О- холерных сывороток серогрупп 01 и 0139, меченых изотиоцианатом флюоресцеина; РНГА со специфическими иммуноглобулиновыми эритроцитарными диагностикумами. Ставят также реакцию иммобилизации вибрионов с теми же сыворотками (2 капли материала наносят на предметное стекло, в одну из них вносят каплю сыворотки О1 или О139 в разведении 1: 100, в другую каплю ФР - контроль). Готовят препараты «раздавленной» капли, которые исследуют с помощью темнопольного, фазово-контрастного или обычного микроскопа с опущенным конденсором при увеличении 400 - 600. Положительная реакция характеризуется потерей подвижности вибрионов и их склеиванием.
Самостоятельная работа студентов
1.Микроскопический метод. Промикроскопировать и зарисовать демонстрационный микропрепарат холерного вибриона V.cholerae, окрашенный по Граму. Холерный вибрион - грамотрицательная изогнутая палочка.
2.Бактериологический метод. Ознакомиться с основными биологическими свойствами классического биовара холерного вибриона и биовара Эль-Тор:
фаголизабельность. Классический холерный вибрион лизируется фагом С и нечувствителен к действию фага Эль-Тор II. Вибрион Эль-Тор лизируется фагом Эль-Тop и нечувствителен к фагу С (демонстрация);
чувствительность к полимиксину. Учесть рост классического холерного вибриона и вибриона Зль-Тор на среде с добавлением полимиксина. Вибрион Эль-Тор к полимиксину не чувствителен, классический холерный вибрион – чувствителен;
гемолитические свойства. Вибрион Эль-Тор лизирует эритроциты; классический холерный вибрион, как правило, нет (демонстрация);
определение серовара холерного вибриона. Учесть развернутую реакцию агглютина-
ции c сыворотками Инаба и Огава (демонстрация).
3.Изучить биопрепараты, используемые для диагностики, лечения и профилактики бактериальной дизентерии и холеры:
люминесцирующая холерная сыворотка для постановки реакции иммунофлюоресценции с целью выявления вибрионов;
агглютинирующие холерные сыворотки Инаба и Огава (для постановки реакции агглютинации при идентификации холерного вибриона);
холерные фаги: классический (фаг С) и Эль-Тор. Используются для фагодиагностики;
поливалентный холерный бактериофаг для лечения и профилактики;
холерная вакцина. Создано 3 вакцины против холеры (убитая Эль-Тор; холерогенана- токсин, обогащенный О-антигеном холерного вибриона для подкожных инъекций; холерогенанатоксин, обогащенный О-антигеном холерного вибриона таблетированный). Используются для специфической профилактики холеры.
56
ПИЩЕВЫЕ ИНТОКСИКАЦИИ БАКТЕРИАЛЬНОЙ ПРИРОДЫ Лабораторная диагностика ботулизма
Ботулизм - острая пищевая интоксикация, протекающая с преимущественным поражением центральной и вегетативной нервной системы ботулиническим токсином - сильнейшим биологическим ядом, вырабатываемым палочкой ботулизма (Clostridium botulinum) и относящемся к особо опасным патогенным биологическим агентам. Ботулизм может быть связан также с вегетацией возбудителя в ране или кишечнике.
Материалом для исследования являются кровь, моча, испражнения, промывные воды желудка, остатки пищи (мясные, рыбные, фруктовые, овощные, грибные консервы, колбасы и др.). Обычно у больного с подозрением на ботулизм исследуют на наличие токсина кровь, а на наличие возбудителя - испражнения.
Биопроба. Проводится реакция нейтрализации на белых мышах с целью обнаружения ботулотоксина в исследуемом материале. Обнаружение токсина палочки ботулизма и его типа имеет важное значение для назначения пациенту антитоксической противоботулинистической сыворотки - единственного эффективного средства специфической терапии и экстренной профилактики ботулизма. Реакцию ставят со смесью антитоксических противоботулинистических сывороток, а также с моновалентными сыворотками типов А, В, Е. При наличии в исследуемом материале ботулотоксина мыши контрольной группы погибают с явлениями параличей (парез конечностей, осиная талия и т.д.). При нейтрализации токсина антитоксической сывороткой мыши остаются живыми.
Экспресс-диагностика ботулизма проводится с помощью РНГА с антительными эритроцитарными диагностикумами для обнаружения ботулотоксина в исследуемом материале.
Бактериологический метод. Исследуемый материал засевают в 4 флакона со средой Китта
–Тароцци; один флакон прогревают при температуре 600 С в течение 15 мин (для селекции С. botulinum типа Е), другой - при 800 С в течение 20 мин. Накопление культур клостридий ботулизма типов Е и F происходит при 28 °С, а клостридий типа А и В - при 35 °С в течение 48 ч. Для активации токсина Е к питательной среде добавляют трипсин.
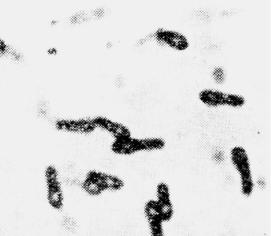
Через 24 — 48 ч инкубирования учитывают характер роста посевов (помутнение и газообразование), готовят мазки в окраске по Граму. При наличии типичных бактерий в виде «теннисных ракеток» со спорами (рис.15) делают пересев на кровяной сахарный МПА, на котором С. botulinum образует колонии неправильной формы с гладкой или шероховатой поверхностью и зоной гемолиза. В глубине столбика сахарного МПА колонии палочки ботулизма имеют вид пушинок или чечевичек.
Рис. 15. Палочка ботулизма - Clostridium botulinum. Окраска по Граму. Грамположительные спорообразующие палочки в виде «теннисной» ракетки. х900
Идентификация чистой культуры проводится на основании изучения биохимических свойств (посев в среды «пестрого» ряда), изучают другие дифференциальные признаки (см.
57

табл.). Антигенные свойства культуры изучают с помощью РА с типовыми сыворотками. Выявляют также ботулинический токсин в фильтрате бульонной культуры и его тип с помощью реакции нейтрализации на белых мышах.
Самостоятельная работа студентов
1.Изучить морфологические свойства С. botulinum в демонстрационном микропрепа-
рате, окрашенном по Граму. Возбудитель ботулизма представляет собой крупную палочку со спорами, расположенными субтерминально (вид «теннисной ракетки»).
2.Бактериологический метод. Изучить культуральные свойства ферментативную активность возбудителя ботулизма (демонстрация).
3.Экспресс-метод. Ознакомиться с выявлением ботулотоксина в сыворотке крови больного: РНГА с эритроцитами, нагруженными антителами моновалентных антитоксических противоботулинистических сывороток типов А, В, Е.
4.Биопроба. Обнаружение ботулотоксина в пище, послужившей причиной пищевого отравления: реакция нейтрализации на белых мышах. Одну группу мышей (контроль) заражают подкожным введением фильтрата пищи, послужившей причиной отравления. Другой мыши (опыт) вводят смесь исследуемого материала и типовых противоботулинических сывороток. При наличии ботулотоксина мыши контрольной группы погибают с явлениями параличей (осиная талия и т.д.), животные в контрольной группе выживают.
5.Изучить биопрепараты, используемые для диагностики, лечения и профилактики ботулизма:
- противоботулинистические сыворотки типов А, В, Е, F, полученные из сыворотки крови гипериммунизированных ботулинистическим анатоксином лошадей; применяются для лечения и постановки реакции нейтрализации на животных при диагностике ботулизма;
- ботулинистический трианатоксин адсорбированный, очищенный. Получают обез-
вреживанием ботулинистического токсина формалином, применяют для активной иммунизации.
Лабораторная диагностика пищевых интоксикаций стафилококковой этиологии
Материалом для исследования служат рвотные массы, промывные воды желудка, пищевые продукты, послужившие причиной отравления.
Экспресс-методы предназначены для обнаружения энтеротоксина стафилококка в исследуемом материале с помощью РП в геле, латекс-агглютинации, ИФА с сыворотками против энтеротоксинов стафилококка.
Бактериологический метод направлен на выделение чистой культуры стафилококка с последующей постановкой проб на наличие энтеротоксина.
Биопроба. Ставится путем скармливания исследуемого материала или выделенной культуры стафилококка котятам-сосункам, у которых стафилококковый энтеротоксин вызывает через 30-60 минут рвоту и понос.
Пищевые интоксикации бактериальной этиологии способны также вызывать:
C.perfringens типаА, Bacillus cereus, Proteus vulgaris и другие виды бактерий
Для лабораторной диагностики этих интоксикаций используются методы экспрессдиагностики (ИФА) с целью поиска бактериальных токсинов, а также бактериологические методы
Педиатрические аспекты темы.
I. При диагностике дизентерии у детей большое значение имеет серологическое исследование. Используется реакция агглютинации по типу реакции Видаля. При постановке реакции агглютинации с целью диагностики дизентерии у детей следует учитывать, что процент положительных реакций агглютинации изменяется в зависимости от возраста. У детей
58
от 0 до 6 месяцев – 45%, а у детей от 6 месяцев до 2 лет и старше – 84%. Следует иметь в виду, что у детей при острой дизентерии агглютинины появляются уже в первые пять дней болезни и достигают своего максимума l 15 дав. Диагностическим титром в реакции агглютинации является разведение сыворотки при дизентерии Флекснера у детей 1:100, у взрослых - 1:200; дом дизентерии Зонне у детей 1:50, у взрослых 1:100.
После изучения темы студент должен знать: таксономию, морфологические и биологические свойства возбудителей дизентерии, холеры, пищевых интоксикаций бактериальной природы, а также патогенез, эпидемиологию, основные клинические проявления и иммунитет; основные методы диагностики, специфической профилактики и лечения этих инфекций.
Изучив тему, студент должен уметь: ставить РА на стекле для идентификации шигелл, оценивать результаты микробиологических анализов при дизентерии, холере, пищевых интоксикациях бактериальной природы
Тема 8. ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ ВОЗДУШНО-КАПЕЛЬНЫХ ИНФЕКЦИЙ: ДИФТЕРИИ, КОКЛЮША, ГЕМОФИЛЬНОЙ И ПНЕВМОКОККОВОЙ ИНФЕКЦИИ
Цель занятия: изучение биологических свойств основных возбудителей бактериальных воздушно-капельных инфекций - дифтерии, коклюша, гемофильной инфекции, методов их лабораторной диагностики, профилактики и лечения.
Перечень конкретных учебно-целевых вопросов
1.Коринебактерии.Таксономия. Экология.
2.Возбудитель дифтерии. Морфологические, культуральные, биохимические и антигенные свойства. Резистентность. Биовары. Дифференциация возбудителя дифтерии и условнопатогенных коринебактерий. Факторы патогенности, дифтерийный токсин. Патогенез дифтерии. Антитоксический иммунитет. Бактерионосительство. Лабораторная диагностика. Специфическое лечение и профилактика.
3.Бордетеллы. Таксономия. Характеристика основных свойств бордетелл.
4.Возбудитель коклюша. Морфологические, культуральные, антигенные свойства. Патогенность для человека и локализация в организме. Патогенез заболевания у человека. Иммунитет. Лабораторная диагностика. Дифференциация возбудителей коклюша, паракоклюша и бронхосептикоза. Специфическая профилактика. Этиотропная терапия.
5.Гемофильная палочка. Таксономия. Биологические свойства. Роль в патологии человека. Микробиологическая диагностика.
6.Биологические свойства возбудителей пневмоний и ОРЗ. Факторы патогенности, экология. Особенности инфекции, эпидемиология бактериальных пневмоний и ОРЗ.
7.Лабораторная диагностика бактериальных пневмоний и ОРЗ.
8.Легионеллы. Таксономия. Характеристика основных свойств легионелл. Экология. Распространение легионелл во внешней среде. Возбудитель болезни легионеров. Морфологические, культуральные, биохимические признаки. Антигенное строение. Патогенность для человека. Патогенез заболевания. Микробиологическая диагностика. Профилактика. Лечение. Диагностические, профилактические и лечебные препараты.
Лабораторная диагностика дифтерии
Дифтерия - острое инфекционное заболевание, вызываемое дифтерийной палочкой (Corynebacterium diphtheriae), характеризующееся местным фибринозным поражением слизистых оболочек рото- и носоглотки (diphthera – пленка), а также тяжелой интоксикацией с поражением сердечно-сосудистой, нервной системы и надпочечников. Лабораторная диагностика дифтерии осуществляется в соответствии со схемой 14.
59
Схема 14. Микробиологическая диагностика дифтерии
Материал для исследования: отделяемое со слизистой оболочки зева и носа, пленки с поверхности миндалин.
Бактериологический метод
1 день. Посев материала на среду Клауберга. Культивирование в течение суток при
370 С.
2 день. Учет характера роста колоний на среде Клауберга (серовато-черного цвета колонии с радиальной исчерченностью в виде цветка маргаритки или розетки - биовар gravis; черные, круглые, выпуклые колонии за счет восстановления теллурита - биовар mitis). В мазке из типичной для дифтерийной палочки колонии (окраска по Нейссеру) палочки булавовидной формы, расположенные в виде римских цифр V или Х, содержащие зерна волютина. Пересев оставшейся части колонии на кровяной МПА для выделения чистой культуры; посев на сывороточный
МПА для определенияСерологическийтокс генностиметод , постановка пробы на цистиназу.
3 день. Учет Постановкапроб на токсигенностьРА, РНГА, цистиназуцелью .выявленияФормулировкаантителответак дифтерийной. Пересевы с палочке и ее кровяного МПАтоксинуна специальн, такжеыединамикисреды с цельюантителполной(исследованиеидентификациипарныхдифтерийнойсывороток) в процессе палочки и ее дифференинфекциициации. от сходных непатогенных коринебактерий.
4 день. Окончательный ответ.
Микроскопический метод в настоящее время фактически не применяется из-за его низкой информативности в связи с субъективизмом учета и выполняется только по требованию лечащего врача. Микроскопии подвергают мазки, окрашенные по Граму, метиленовым синим, по Нейссеру (для выявления включений волютина). Дифтерийные палочки (Corynebacterium diphtheriae) при окраске по Нейссеру содержат полярно расположенные темно-синие, почти черные, включения волютина и располагаются в виде римских цифр V или Х, тогда как сходные с ними дифтероиды и ложнодифтерийные бактерии (Corynebacterium pseudodiphtheriae) зерен волютина не имеют и располагаются в виде частокола. Разработан также метод прямого флюорохромирования дифтерийных палочек корифосфином, окрашивающим включения волютина в красно-коричневый цвет, а цитоплазму в зеленый или желтый цвет, что позволяет повысить эффективность бактериоскопического метода.
Бактериологический метод - основной метод диагностики дифтерии. Исследуемый материал засевают на одну из специальных питательных сред для культивирования дифт е- рийных палочек, наиболее часто на среду Клауберга (МПА с глицерином, дефибринированной кровью и теллуритом натрия, задерживающим рост сопутствующей непатогенной микрофлоры). На среде Клауберга Corynebacterium diphtheriae образует 2 типа колоний:
а) серовато-черного цвета с радиальной исчерченностью поверхности, напоминающие цветок маргаритки или розетку (биовар gravis);
б) черные, круглые, выпуклые колонии колонии за счет восстановления теллурита (биовар mitis).
В мазке из типичной для дифтерийной палочки колонии обнаруживают грамположительные палочки булавовидной формы, расположенные в виде римских цифр V или Х, содержащие зерна волютина (рис. 16). Оставшуюся часть колонии пересевают на кровяной МПА для выделения чистой культуры.
60
