
Chastnaya_mikrobiologia
.pdf
3. Возбудитель туляремии. Биологические свойства. Патогенез, иммунитет, методы микробиологической диагностики и специфической профилактики туляремии.
4. Возбудитель сибирской язвы. Морфологические, культуральные, биохимические и антигенные свойства. Резистентность. Патогенность для человека и животных. Факторы патогенности, токсины. Патогенез заболевания у человека, иммунитет. Микробиологическая диагностика. Специфическое лечение и профилактика сибирской язвы.
Микробиологическая диагностика чумы.
Возбудитель чумы – Yersinia pestis относится к высокопатогенным микроорганизмам (1 группы патогенности). Взятие, доставка материала при подозрении на чуму и работа с ним производятся в специализированных лабораториях с соблюдением особых правил предосторожности (в противочумном костюме, с применением специальных средств и устройств, предотвращающих попадание микроорганизма на кожу, слизистые оболочки и в дыхательные пути медицинского персонала, а также на различные объекты внешней среды).
В зависимости от способа заражения различают бубонную, легочную, кишечную формы, реже возникает септическая и кожная формы. Материал, подлежащий исследованию на чуму (см. схему 4), помещают в банки, которые герметично закрывают, обрабатывают снаружи 5% раствором лизола, наклеивают этикетку с указанием вида материала, даты и места его взятия, фамилии и инициалов больного, а также диагноза. Банки плотно укладывают в герметичную тару, на крышке которой указывают «Верх»; в банку вкладывают опись направляемых на исследование материалов. Материалы подлежат немедленной отправке в лабораторию на специальном транспорте с сопровождающим лицом. Перед исследованием тара с материалом и другие потенциально зараженные предметы обрабатываются дезинфицирующим раствором.
Лица, контактировавшие с материалом, подозрительным на содержание возбудителя чумы, подвергаются полной санитарной обработке.
Принципы микробиологической диагностики чумы отражены в схеме 4. Бактериоскопический метод. Мазки, приготовленные из исследуемого материала, фик-
сируют в смеси Никифорова, окрашивают по Граму и метиленовым синим. С целью экспрессдиагностики мазки обрабатывают также меченой люминесцирующей сывороткой к Y. pestis (прямой ИФМ). Предварительный положительный ответ выдается в случае обнаружения в мазках биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой (рис.7), дающих специфическое свечение в РИФ.
В качестве других методов экспресс-диагностики чумы применяют РНГА с иммуноглобулиновым чумным диагностикумом, ИФА для индикации антигенов возбудителя.
Методы ускоренной и экспресс-диагностики дают возможность дать предварительный ответ через 4 ч от начала исследования, окончательный - через 18-20 ч.
Бактериологическое исследование. Кровь при подозрении на чуму засевают на МПБ во флаконах; содержимое бубона, отделяемое язвы, мокроту и другой материал — на МПА с
цельной или гемолизированной кровью кролика или лошади |
в чашках Петри |
с антифаговой |
сывороткой для нейтрализации чумного фага, раствором |
генцианового |
фиолетового и |
сульфита натрия для подавления роста посторонней микрофлоры, находящейся в исследуемом материале. Применяют также селективную среду с антибиотиками — агар CIN. Посевы инкубируют при 25—28 °С. Через 16—20 ч на чашках под малым увеличением микроскопа обнаруживают рост колоний в виде скоплений осколков битого стекла, которые к 48 ч приобретают вид R-формы с компактным приподнятым центром и ажурной полупрозрачной периферией («кружевные платочки» - рис. 8). На поверхности МПБ через 24 ч образуется рыхлая пленка, от которой спускаются тяжи, напоминающие сталактиты.
Схема 4. Микробиологическая диагностика чумы Материал: пунктат из бубона, мокрота, кровь, испражнения
21

Микроскопический метод
Микроскопия окрашенных по Граму и метиленовым синим мазков из материала от больного с целью обнаружения биполярно окрашенных грамотрицательных овоидных бактерий, окруженных нежной капсулой и дающих специфическое свечение оболочки в РИФ
Серологический метод
Постановка РНГА, ИФА, РИФ, РНАг с целью определения анти-
тел в крови больного
Генодиагностика
Биопроба
Постановка ПЦР Подкожное, внутрибрюшинное,
накожное или скарификационное заражение материалом от больного морских свинок или белых мышей. Микроскопическое и бактериологическое исследование трупов павших животных
Бактериологический метод.
1. день. Посев на МПБ, кровяной МПА с антифаговой сывороткой, раствором генцианового фиолетового и сульфита натрия, селективную среду с антибиотиками (агар CIN). Инкубация посевов при 25-280 С.
2 день Учет характера роста под малым увеличением микроскопа (рост колоний в виде скопления осколков битого стекла; через 48 часов появление R-форм в виде «кружевных платочков»; в жидких средах рост, напоминающий сталактиты). Микроскопическое исследование типичной колонии, ее пересев на скошенный МПА для накопеления чистой культуры.
3 день. Проверка чистоты выделенной культуры, пересев на среды «пестрого» ряда для определения ферментативных свойств, постановка проб на фаголизабельность и чувствительность к антибиотикам. Идентификация культуры по антигенным свойствам (выявление капсульного и соматического антигенов).
4 день. Заключение о виде выделенной культуры на основании ее идентификации по морфологическим, культуральным, ферментативным, антигенным свойствам и фаголизабельности.
а |
б |
Рис. 7. Возбудитель чумы (Yersinia pestis). |
а - чистая культура, окраска метиленовым синим. |
Палочки овоидной формы, окрашенные биполярно.х 630. б – мазок из материала от больного, окраска по Граму. Грамотрицательные, биполярно окрашенные, капсулообразующие палочки овоидной формы. х1350
Типичные колонии пересевают на скошенный МПА, чистую культуру чумных бактерий идентифицируют по морфологическим, культуральным, ферментативным, антигенным свойствам (РА с использованием диагностических сывороток против высокоспецифичного капсульного и соматического антигенов), фаголизабельности, определяют ее чувствительность к антибиотикам. Возбудитель чумы восстанавливает нитраты в нитриты, ферментирует глюкозу, ксилозу, маннит с образованием кислоты (без газа). В отличие от многих других представителей семейства энтеробактерий имеет более низкий температурный оптимум роста и физиологической активности - 28 °С. В процессе идентификации возбудитель чумы необходимо дифференцировать с другими иерсиниями (табл. 6).
22
Биологическое исследование. Заражают морских свинок или мышей подкожно, внутрибрюшинно или накожно, материалом от трупов – методом скарификации.
Животные погибают на 2—7-е сутки. Одно из зараженных животных умерщвляют на 2— 3-й день с целью выделения культуры иерсиний из крови и внутренних органов. В мазках из внутренних органов, крови, экссудата погибших животных обнаруживают большое количество грамотрицательных, биполярно окрашенных бактерий. После исследования трупы животных погружают в 5% лизол, а затем сжигают.
Рис. 8. Колонии возбудителя чумы (Yersinia pestis). х56
Таблица 6. Биологические свойства иерсиний
Свойства |
Y. pestis |
Y. pseudotuberculosis |
Y. enterocolitica |
Подвижность при: 250 С |
- |
+ |
+ |
28-370 С |
- |
- |
- |
Ферментация: |
|
|
|
рамнозы |
- |
+ |
- |
раффинозы |
- |
+ |
- |
инозита |
- |
- |
+ |
мочевины |
- |
+ |
+ |
сахарозы |
- |
- |
+ |
уреаза |
- |
- |
+ |
орнитиндекарбоксилаза |
- |
- |
- |
Фракция 1 |
+ |
- |
- |
Мышиный токсин |
+ |
- |
- |
Пестицин 1 |
+ |
- |
- |
Плазмокоагулаза |
+ |
- |
- |
Фибринолизин |
+ |
- |
- |
Чувствительность к чумному фагу |
+ |
- |
- |
Вирулентная форма колоний |
R |
S |
S |
Серологическое исследование проводится с целью ретроспективной диагностики чумы. Ставят РНГА с эритроцитами, на которых адсорбирован капсульный антиген возбудителя чумы, реакцию нейтрализации антигена (РНАг), ИФА и непрямую РИФ. Диагностический титр
1:40 и выше.
Генодиагностика. Разработана ПЦР для экспресс-диагностики чумы.
Самостоятельная работа студентов
1.Изучение правил пользования противочумным костюмом.
2.Изучение морфологии Yersinia pestis (мазки из содержимого бубона больного чумой – демонстрация);
3.Знакомство с методами лабораторной диагностики чумы. Используется наглядный материал (таблицы, схемы, слайды).
Бактериоскопический метод (обратить внимание на типичную морфологию возбуди-
теля).
23

Бактериологический метод (обратить внимание на характер роста; биохимическую активность - чумная палочка разлагает с образованием кислоты левулёзу, арабинозу, глюкозу, мальтозу, маннит; антигенные свойства; фаголизабельность).
4. Знакомство с препаратом для специфической профилактики чумы - живой атте-
нуированной вакциной из штамма EV.
Микробиологическая диагностика туляремии
Резервуаром возбудителя туляремии (Francisella tularensis) являются грызуны, человек заражается от них всеми известными способами (при прямом и непрямом контакте, алиментарным, аэрогенным, трансмиссивным путем). По клиническим проявлениям тулерямия напоминает чуму, однако летальность при этой инфекции не высока (1-2%). Выделяют язвенножелезистую (бубонную), глазо-бубонную, ангинозно-буббонную, кишечную и легочную формы туляремии.
Методы микробиологической диагностики туляремии отражены в схеме 5. Для лабораторной диагностики туляремии широко используются иммунологические методы (серологическая диагностика, аллергические пробы), осуществляемые в обычных клинических условиях. Биопробы с выделением чистой культуры возбудителя проводятся в специализированных лабораториях особо-опасных инфекций.
Серологический метод. В сыворотке крови больных специфические антитела появляются с 10-12 дня болезни. В диагностических целях используют развернутую РА (диагностический титр 1:100 и выше), РНГА (диагностический титр 1:1280 и выше), ИФА.
Аллергическая проба. Выпускается 2 вида аллергена – тулярина для постановки соответственно накожной и внутрикожной аллергической пробы – раннего (положительная реакция ГЗТ с 5 дня болезни) и специфического метода диагностики туляремии. Наличие инфильтрата и гиперемии диаметром 1 см и более через 24-48 часов после введения тулярина расценивается как положительная реакция.
Биологический и бактериологический методы. Выделить культуры возбудителя от больного путем непосредственного посева материала на питательные среды не удается. Для выделения чистой культуры возбудителя туляремии применяется биопроба. С этой целью исследуемый материал (см. схему 5) вводят мышам или морским свинкам подкожно, накожно, внутрибрюшинно и/или через рот. Если экспериментальные животные в течение 7-15 дней не погибают, их умерщвляют и трупы подвергают бактериоскопическому и бактериологическому исследованию. Для этого готовят мазки-отпечатки из внутренних органов и окрашивают их по Рома- новскому-Гимзе. Возбудитель туляремии - мелкие (0,2-0,7 мкм) кокковидные и палочковидные бактерии, располагающиеся в мазках-отпечатках из органов внутриклеточно и в виде скоплений с образованием нежной капсулы (рис. 8). Применяют также методы экспрессдиагностики (обнаружение возбудителя в материале с помощью ИФМ и ИФА). Параллельно с микроскопическим исследованием кровь, костный мозг, участки внутренних органов и лимфатических узлов трупа животного засевают на одну из плотных питательных сред (желточная среда, среда МакКоя, глюкозо-цистиновый агар с кроличьей кровью и антибиотиками), которую культивируют при 370 С. Рост туляремийного микроба в виде нежных мелких колоний (рис. 10) появляется на 3-5-20 день, иногда позже. Возбудитель туляремии хорошо размножается также в желточном мешке 12-дневного куриного эмбриона.
Выделенную чистую культуру идентифицируют по морфологическим, антигенным (РА с туляремийной агглютинирующей сывороткой) и биологическим свойствам, определяют ее чувствительность к антибиотикам. В биохимическом отношении возбудитель туляремии мало активен (ферментация глюкозы, продукция сероводорода).
Схема 5. Микробиологическая диагностика туляремии
Материал: кровь, пунктат из бубона, соскоб из язвы, отделяемое конъюнктивы, налет из зева, мокрота и др., органы павших и больных животных, переносчики (слепни, клещи, комары), объекты внешней среды (вода, пищевые продукты, воздух).
24

Серологический метод
Постановка РНГА, РА, ИФА, с целью определения антител в крови больного
Аллергодиагностика
Постановка внутрикожной аллергической пробы с тулярином. Учет через 24-48 часов.
Биопроба
Подкожное, внутрибрюшинное, или пероральное заражение материалом от больного морских свинок или белых мышей. Микроскопическое и бактериологическое исследование трупов павших животных
Биологический и бактериологический метод.
Выделить чистую культуру возбудителя туляремии удается только методом биопробы. 1. день. Заражение морских свинок или белых мышей.
7-15 дни. Бактериоскопическое и бактериологическое исследование трупа животного. Маз- ки-отпечатки из внутренних органов, окраска по Романовскому-Гимзе, РИФ. Посев на глю- козо-цистиновый агар с кроличьей кровью и антибиотиками (на желточную среду или на среду МакКоя). Культивирование посевов при 370 С в течение 3-20 дней.
10-30 дни. Учет характера роста (нежные мелкие колонии). Микроскопическое исследование типичной колонии, ее пересев на скошенный глюкозо-цистиновый агар для выделения чистой культуры.
12-33 дни. Проверка чистоты выделенной культуры, пересев на среды «пестрого» ряда для определения ферментативных свойств, постановка проб на фаголизабельность и чувствительность к антибиотикам. Идентификация культуры по антигенным свойствам (выявление специфический антигенов с помощью РА и РИФ, ИФА).
14-35 дни. Заключение о виде выделенной культуры на основании ее идентификации по морфологическим, культуральным, ферментативным, антигенным свойствам и фаголизабельности.
Геноди
25

а б
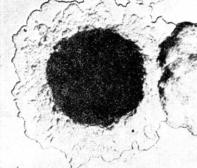
Рис. 9. Возбудитель туляремии (Francisella tularensis) в мазках из чистой культуры (а) и в мазках-отпечатках органов белой мыши (б), погибшей в результате биопробы. х630.
Рис. 10. Колонии возбудителя туляремии на глюкозо-цистеиновом агаре. х56
Генодиагностика. Для обнаружения ДНК возбудителя туляремии разработана ПЦР.
Самостоятельная работа студентов
1.Микроскопия демонстрационных микропрепаратов Francisella tularensis (окраска по Граму). Возбудитель туляремии представляет собой полиморфные мелкие бактерии кокковидной или палочковидной формы. Препараты зарисовать.
2.Серологический метод диагностики туляремии.
РА с сывороткой крови больного туляремией и туляремийным диагностикумом (демонстрация, диагностический титр 1:100).
РНГА с сывороткой крови больного туляремией и эритроцитарным туляремийным диагностикумом (демонстрация, диагностический титр 1:1280).
ИФА с сывороткой крови больного туляремией (демонстрация, диагностический титр
1:100).
3.Специфическая профилактика туляремии: живая вакцина (высушенная живая куль-
тура вакцинного штамма туляремии).
Микробиологическая диагностика сибирской язвы
Основным источником инфекции являются больные травоядные животные, от которых человек заражается при непосредственном контакте, алиментарным, аэрогенным или трансмиссивным путями. Чаще всего возникает кожная форма инфекции с образованием характерного сибиреязвенного карбункула в виде уголька (anthrax), реже – кишечная, легочная, септическая формы. Методы микробиологической диагностики сибирской язвы отражены в схеме 6.
Схема 6. Микробиологическая диагностика сибирской язвы
Материал: отделяемое карбункула или язвы, испражнения, моча, мокрота, кровь
26
|
Микроскопический метод. |
|
|
Бактериологический метод. |
|
|
|||||
|
Микроскопия |
окрашенных |
по |
|
1. день. Посев на кровяной |
МПА или PLET- |
|||||
|
Граму и Романовскому-Гимзе маз- |
|
агар. Культивирование посевов при 370 С. |
|
|||||||
|
ков из материала от |
больного с |
|
2 день Учет характера роста (шероховатые ко- |
|||||||
|
целью обнаружения крупных грам- |
|
лонии в виде «головы медузы»). |
Микроскопи- |
|||||||
|
положительных |
капсулообразую- |
|
ческое исследование типичной колонии, ее пе- |
|||||||
|
щих бацилл в виде цепочек, |
даю- |
|
ресев на скошенный МПА для выделения чис- |
|||||||
|
щих специфическое свечение обо- |
|
той культуры. |
|
|
|
|
||||
|
лочки в РИФ |
|
|
|
|
3 день. Проверка чистоты выделенной культу- |
|||||
|
|
|
|
|
|
ры, пересев на среды «пестрого» ряда для оп- |
|||||
|
|
|
|
|
|
ределения ферментативных свойств; постанов- |
|||||
|
|
|
|
|
|||||||
|
|
|
|
|
|
ка проб на фаголизабельность и |
чувствитель- |
||||
|
Серологический метод |
|
|
||||||||
|
|
|
ность к антибиотикам. Биопроба. |
|
|
||||||
|
Постановка РНГА, РА с целью оп- |
|
|
|
|||||||
|
|
4 день. |
Заключение |
о |
виде |
выделенной |
|||||
|
ределения антител в крови больно- |
|
|||||||||
|
|
культуры на основании ее идентификации по |
|||||||||
|
го |
|
|
|
|
||||||
|
|
|
|
|
морфологическим, |
|
культуральным, |
||||
|
Аллергодиагностика |
|
|
|
|
||||||
|
|
|
|
ферментативным, антигенным свойствам и |
|||||||
|
Постановка внутрикожной аллер- |
|
фаголизабельности. |
Микроскопическое и |
|||||||
|
гической пробы с тулярином. Учет |
|
бактериологическое |
исследование |
трупа |
||||||
|
через 24-48 часов. |
|
|
|
Бживотногоопроба , павшего в результате биопробы |
||||||
|
Выявление сибиреязвенного ан- |
|
Заражение |
материалом от |
больного |
белых |
|||||
|
тигена |
|
|
|
|
||||||
|
|
|
|
|
мышей. Микроскопическое и бактериологиче- |
||||||
|
Постановка реакции |
термопреци- |
|
||||||||
|
|
ское исследование трупов павших животных |
|||||||||
|
|
|
|
|
|
||||||
|
питации Асколи с преципитирую- |
|
Генодиагностика. ПЦР |
|
|
|
|||||
|
|
|
|
|
|
|
|
||||
|
щей противосибириязвенной |
сы- |
|
|
|
|
|
|
|
||
|
Микроскопический метод. Мазки из исследуемого материала окрашивают по Граму, Рома- |
||||||||||
|
вороткой |
|
|
|
|
|
|
|
|
|
|
новскому-Гимзе, Ребитеру (капсула), а также люминесцирующей сибиреязвенной сывороткой. |
|||||||||||
Обнаружение в препаратах окруженных капсулой крупных грамположительных бацилл в виде цепочек дает возможность поставить предварительный диагноз сибирской язвы (рис.11 а). В качестве экспресс-метода диагностики применяется РИФ, с помощью которой выявляют характерные сибиреязвенные бациллы в виде палочек со светящимся желто-зеленым ободком (рис. 11 б.).
Бактериологический метод - посев исследуемого материала на МПА, кровяной агар в чашках Петри или PLET-arap с полимиксином В, лизоцимом, этилен-диаминотетраацетатом (ЭДТА) и ацетатом таллия. Контаминированный материал из внешней среды, от животных, из старых трупов предварительно прогревают при 63 °С в течение 15 мин с целью уничтожения вегетативных форм микроорганизмов. Посевы помещают в термостат на сутки. Через 20 —24 ч инкубации посевов при 370 С на МПА обнаруживают характерные шероховатые колонии в виде «головы медузы», края которых при малом увеличении микроскопа имеют вид вьющихся локонов или «львиной гривы» - рис. 12. В бульоне характерен придонный рост, напоминающий комочек ваты, при этом среда остается прозрачной. Из осадка делают мазок и препарат висячей капли. В мазке обнаруживают бескапсульные грамположительные стрептобациллы (расположение в виде длинных цепочек в виде «бамбу-
ковой палки»). В отличие от других почвенных бацилл возбудитель сибирской язвы непод-
вижен. Для выделения чистой культуры типичные колонии пересевают на скошенный МПА. Капсулообразование можно выявить путем биопробы или при посевах в бульон Хоттинге-
ра, на специальную среду, содержащую раствор Хенкса и 40 % стерильной сыворотки крупного рогатого скота, МПА с 0,7 % бикарбоната натрия, среду Буза (3% голодный агар с 15% дефибринированной крови барана), а также в дефибринированную лошадиную кровь. Посевы выращивают в течение 18-24 часов при температуре 370 С в атмосфере 5-7% СО2.
27

а
б
Рис. 11. Возбудитель сибирской язвы (Bacillus anthracis). а - окраска по Граму, б – РИФ. х630
Рис. 12. Колония Bacillus anthracis. х56
Идентификацию выделенной культуры Bacillus anthracis (3-й день исследования) и ее дифференциацию от сходных непатогенных бацилл проводят путем посева уколом в желатину (разжижение в виде елочки, перевернутой вершиной вниз), изучения биохимических свойств, фаголизабельности и заражения животных. Определяют также чувствительность культуры к антибиотикам.
Одним из характерных признаков возбудителя сибирской язвы является тест «жемчужного ожерелья». На поверхность МПА в чашке Петри с 0,5 и 0,05 ЕД/мл пенициллина засевают 3-ча- совую бульонную культуру выделенного микроорганизма, через 3 ч инкубирования при 370 С готовят мазки, в которых при микроскопии находят «жемчужные ожерелья» в виде округлившихся стрептобацилл сибирской язвы. Почвенные бациллы сохраняют форму палочек, расположенных цепочками.
Биологические свойства возбудителя сибирской язвы и сходных с ним бацилл отражены в табл. 7.
Наличие сибиреязвенного антигена в разложившемся трупе животного, коже (свежей, сухой, выделанной) и изделиях из нее, шкурках, мехе, шерсти определяют с помощью реакции термопреципитации по Асколи. Исследуемый материал измельчают, заливают 10 —20-кратным объемом физиологического раствора, кипятят в течение 10-45 мин., после чего фильтруют. Полученный экстракт осторожно наслаивают на преципитирующую сибиреязвенную сыворотку в узкой преципитационной пробирке. На границе экстракта и преципитирующей сыворотки в течение 1- 5 мин в случае положительной реакции появляется кольцо белого цвета (преципитат). Контроли включают постановку реакций с заведомо положительной и отрицательной сывороткой, нормальной сывороткой и т.д.
28
Биопроба. Исследуемым материалом подкожно заражают двух белых мышей., которые погибают через 24-48 ч после заражения. В мазках из внутренних органов и крови обнаруживают типичные капсульные бациллы. Проводится бактериологическое исследование трупа белой мыши с целью выделения чистой культуры сибиреязвенных бацилл.
Таблица 7. Дифференциально-диагностические признаки сибиреязвенной и других
бацилл
Признак |
|
Вид микроорганизмов |
|
|||
|
|
|
|
|
|
|
|
Bacillus anthracis |
Bacillus cereus |
Bacillus mycoides |
Bacillus thuringiensis |
Bacillus subtilis |
Bacillus Megaterium |
|
|
|
|
|
|
|
Капсула |
+ |
- |
- |
- |
- |
- |
Подвижность |
- |
+ |
- |
+ |
+ |
+ |
Гемолиз |
- |
+ |
- |
+ |
- |
+ |
Рост в анаэробных условиях |
+ |
+ |
+ |
+ |
- |
- |
Лецитиназа |
+ |
+ |
+ |
+ |
- |
- |
Аргининдегидролаза |
- |
V |
V |
+ |
- |
- |
Нитpaтpeдyктaзa |
+ |
+ |
+ |
+ |
+ |
- |
Патогенность для мышей |
+ |
- |
- |
- |
- |
- |
Ферментация до кислоты: |
|
|
|
|
|
|
глицерина |
- |
V |
+ |
+ |
+ |
+ |
маннита |
- |
- |
- |
- |
+ |
+ |
салицина |
- |
V |
+ |
+ |
+ |
+ |
Обозначения: «-« - отрицательная; «+» - положительная; «V» - вариабельная реакции.
Серологический метод выполняется в тех случаях, когда не удается обнаружить возбудителя в материале. Для определения антител в сыворотке крови больного используют реакции латексагглютинации и РНГА с протективным сибиреязвенным антигеном.
Аллергический метод – постановка внутрикожной аллергической пробы с аллергеном сибиреязвенной бациллы - антраксином. Результаты учитывают через 24 ч. Пробу считают положительной при наличии гиперемии и инфильтрата диаметром более 15 мм.
Самостоятельная работа студентов
1.Микроскопия демонстрационных микропрепаратов возбудителя сибирской язвы
(Bacillus anthracis, окраска по Граму). Бациллы сибирской язвы - крупные спорообразующие, капсульные грамположительные палочки, располагающиеся цепочками, напоминая бамбуковую палку.
2.Бактериологический метод. Изучить характер роста на МПА и МПБ культуры B.cereus, имитирующей рост Bacillus anthracis. На жидкой питательной среде (бульон Хоттингера) рост бацилл напоминает комочек ваты, на плотной питательной среде (МПА, сывороточный МПА для выявления капсулообразования) - «гриву льва», или «голову медузы». Сибиреязвенная палочка разжижает желатин в виде елочки верхушкой вверх. Под действием пенициллина сибиреязвенные палочки образуют сферопласты в виде жемчужин, что используется для дифференциации Bacillus anthracis от непатогенных бацилл. Отразить в рабочей тетради биологические свойства Bacillus anthracis и сходных с ней бацилл, пользуясь таблицей7.
Для оценки загрязненности сырья (шерсть, шкуры животных) возбудителем сибирской язвы используется реакция кольцепреципатации по Асколи. Поставить реакцию по Асколи. Ингредиенты: преципитирующая сибиреязвенная сыворотка, термостабильный антиген из исследуемого материала, физиологический раствор. Схема постановки реакции Асколи: в препипта-
29
ционную пробирку наливают 0,5 мл преципитирующей сыворотки, пастеровской пипеткой сверху осторожно наслаивают антиген. В положительном случае на границе сыворотки и антигена появляется преципитат в виде кольца. В контрольную пробирку вместо антигена вносят физиологический раствор.
3.Серологическая диагностика сибирской язвы. Учесть реакцию непрямой гемагглю-
тинации с сывороткой крови больного и эритроцитарным сибиреязвенным диагностикумом.
4.Аллергический метод диагностики сибирской язвы. Для постановки кожной аллер-
гической пробы у больных сибирской язвой используется сибиреязвенный аллерген - антраксин (белково-полисахаридно-нуклеиновый комплекс, полученный при гидролизе бацилл сибирской язвы).
5.Специфическая профилактика сибирской язвы: живая вакцина СТИ (высушенная взвесь живых спор вакцинного штамма - варианта сибиреязвенных бацилл, названа в честь Са- нитарно-технического института, в котором она была разработана).
6.Специфическое лечение сибирской язвы: противосибиреязвенный иммуноглобулин (гамма-глобулиновая фракция сыворотки крови лошадей, гипериммунизированных живой вакциной и вирулентным штаммом В.anthracis).
После изучения темы студент должен знать: таксономию, морфологические и биологические свойства возбудителей основных бактериальных зоонозных инфекций (чумы, туляремии, сибирской язвы), а также патогенез, эпидемиологию, основные клинические проявления и иммунитет; основные методы диагностики, специфической профилактики и лечения этих инфекций.
Изучив тему, студент должен уметь: уметь ставить серологические реакции при туляремии, трактовать результаты микробиологических анализов при чуме,туляремии, сибирской язве.
Педиатрические аспекты темы
1.Дети в возрасте от 1 до 2 лет прививаются противочумной вакциной только при неблагоприятной эпидемической ситуации, при этом дети до 7 лет прививаются накожно, а с 7 лет - накожно и подкожно.
2.В неблагополучной по туляремии местности прививкам живой вакциной подвергают все население с 7-летнего возраста. По эпидемическим показаниям вакцинируют детей старше 2 лет.
Тема 4. ВОЗБУДИТЕЛИ БАКТЕРИАЛЬНЫХ ЗООНОЗНЫХ ИНФЕКЦИЙ: БРУ-
ЦЕЛЛЕЗА, ЛЕПТОСПИРОЗА, БОРРЕЛИОЗОВ, ЛИСТЕРИОЗА Цель занятия: изучение биологических свойств возбудителей бактериальных зоонозных
инфекций - бруцеллеза, лептоспироза, клещевого боррелиоза, листериоза и методов их лабораторной диагностики, профилактики и лечения.
Перечень конкретных учебно-целевых вопросов
1.Бруцеллы. Таксономия. Характеристика основных свойств. Морфологические, культуральные, биохимические признаки. Антигенное строение. Дифференциация бруцелл. Патогенность для человека и животных. Факторы патогенности. Патогенез и иммунитет при бруцеллезе. Методы микробиологической диагностики. Препараты для специфической профилактики и терапии.
2.Лептоспиры. Таксономия. Характеристика и дифференциация основных свойств.
3.Возбудители лептоспироза. Морфологические, культуральные свойства. Серовары лептоспир. Патогенность для человека и животных. Патогенез лептоспирозов. Иммунитет. Микробиологическая диагностика. Специфическая профилактика. Лечение.
3.Листерии. Таксономия. Экология. Морфологические, культуральные, биохимические и антигенные свойства. Резистентность. Патогенность для животных. Токсинообразование. Патогенез заболеваний у человека. Иммунитет. Микробиологическая диагностика. Профилактика и лечение заболевания.
4.Боррелии. Возбудители эпидемического и эндемического возвратных тифов, клещевой боррелиоз. Морфологические и культуральные свойства. Патогенез и иммунитет. Микро-
30
