
- •Связь химической структуры спиртов и фармакологического действия:
- •Физические свойства
- •Химические свойства
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Специфические примеси
- •Количественное определение
- •Определение спирта в препаратах
- •Хранение
- •Применение
- •Получение
- •Описание
- •Подлинность
- •Чистота
- •Количественное определение
- •Нефармакопейные методы
- •Получение
- •Описание
- •Чистота
- •Подлинность
- •Хранение
- •Применение
- •Препараты сложных эфиров
- •Подлинность
- •Чистота
- •Хроматограмма исследуемого раствора нитроглицерина
- •Применение
Количественное определение
Перйодатный метод (ФС). Способ титрования – обратный.
Основан на окислительном разложении глицерола (глицерина) как многоатомного спирта со смежными гидроксильными группами йодной кислотой до формальдегида и кислоты муравьиной. Остаток йодной кислоты и образующуюся в эквивалентном количестве по отношению к глицеролу йодноватую кислоту определяют йодометрически в кислой среде H2SO4.
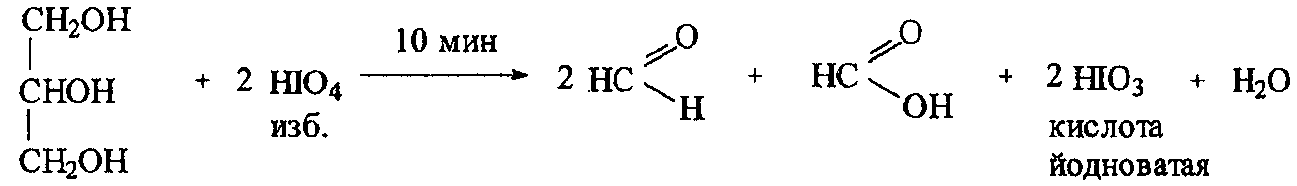
H2C–OH
 │+7
O
+5
│+7
O
+5
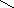 HC
– OH + 2HIO4
→ H – C + HCOOH + H2O
+ 2HIO3
HC
– OH + 2HIO4
→ H – C + HCOOH + H2O
+ 2HIO3
│ H
H2C–OH
2 HIO4 + 14KI + 7H2SO4 → 8I2 + 7K2SO4 + 8H2O
2HIO3 + 10KI + 5H2SO4 → 6I2 + 5K2SO4+ 6H2O
I2 + 2Na2SO3 →2NaI + Na2S4O6
fэкв (глицерина) = ¼
Параллельно проводят контрольный опыт.
Содержание глицерина должно быть от 84% до 88%.
По МФ Выделившуюся в эквивалентном количестве по отношению к глицеролу кислоту муравьиную оттитровывают раствором натрия гидроксида. Параллельно проводят контрольный опыт
НСООН + NaOH → HCOONa + H2O
fэкв (глицерина) = 1
Нефармакопейные методы
1. По плотности растворов
2. Рефрактометрически
3.Метод ацетилирования – косвенный способ алкалиметрии по реакции этерификации. Основан на образовании сложных эфиров с уксусным ангидридом и выделением эквивалентного количества кислоты уксусной, которую оттитровывают щелочью
3CH3COOH+3NaOH→ 3CH3COONa+ 3H2O
Кстех = 1/3; Раствор гидроксида натрия РЧ (1)
fэкв = Кстех· РЧ= 1/3· 1 = 1/3;
Параллельно проводят контрольный опыт, данные которого учитывают при расчете:

Применение
используют как средство для приготовления, как растворитель для некоторых ЛВ.
В виде 84 – 88 % смеси с водой при наружном применении оказывает смягчающее (дерматопротективное) действие и входит в состав основ для приготовления наружных ЛФ мазей и растворов (натрия тетраборат), слабительное в составе ректальных ЛФ.
Простые алифатические эфиры
Простые эфиры – производные спиртов, в молекулах которых атом водорода гидроксильной группы замещён на радикал с общей формулой
R – O – R1.
По физическим свойствам – это летучие инертные вещества нейтрального запаха.
В химическом отношении устойчивы и мало реакционно способны:
легко окисляются, даже кислородом воздуха до пероксидов
образуют оксониевые соли с конц. кислотами (часто окрашены-димедрол),
атом кислорода простого эфира имеет 2 пары свободных электронов, которые притягивают к себе протон кислот.
R−O−R1 + H2SO4 → (R− O +−R1) HSO−4
│
Н
Оксониевые соли неустойчивы и легко разлагаются под действием воды.
Из простых эфиров в медицине применяются диэтиловый эфир:
С2Н5-О-С2Н5
ФП Эфир медицинский
Aether medicinalis Diethyl ether (МНН)
ФП Эфир для наркоза
Aether pro narcosi
