
Строение клетки протистов
.pdf
4.2. ЦИТОСКЕЛЕТ
ки, подстилающие пелликулу грегарины, которые выполняют стабилизирующую функцию и возвращают форму тела в прежнее положение при расслаблении пучков микрофиламентов (см. также стр. 226). У инфузорий метаболическое движение выражается в форме изгибаний, складывания и скручивания тела. Это достигается за счет сокращения продольных пучков микрофиламентов, а стабилизирующими элементами выступа - ют продольные ленты микротрубочек кортекса.
Скользящее движение
Скользящее движение встречается среди протистов достат оч- но широко. Прежде всего, это диатомовые водоросли, лабирин - тулы, грегарины и спорозоиты кокцидий. Этот тип движения используют также десмидиевые водоросли, моноспоры и спер - мации красных водорослей. Помимо одноклеточных форм могут скользить по субстрату и нитчатые формы. Особенно шир о- ко оно растространено среди цианобактерий. Скользящее
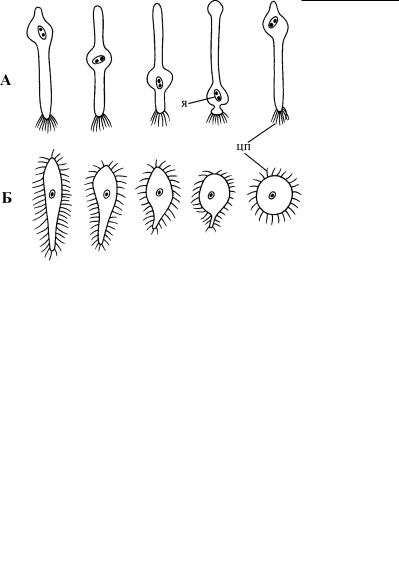
Рис. 4.66. Компьютерная модель метаболирующего движения эвгленовых. (По: Suzaki, Williamson, 1986.)
Верхний ряд (1–7) – цикл конформационных изменений одной полоски, соответствующий этапам последовательного изме нения формы всей клетки (нижний ряд: 1–7) в процессе метаболии.
221
ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
движение было описано Адамсоном еще в 1767 году (Adamson, 1767 – цит. по: Hader, Hoiczek, 1992), но до сих пор его механизм во многих случаях неизвестен. Механизмы его, по-види- мому, различны, однако внешне оно выглядит одинаково: клет - ка (или группа клеток) скользит по субстрату без каких-либ о внешних причин и без изменения формы тела.
Поверхность грегарин покрыта продольными гребнями (рис. 4.69). Клетки выделяют обильную слизь и, вероятно, проталкивают ее назад при помощи волнообразных движений про - дольных гребней. Такое предположение было основано на изу- чении ультратонкого строения, т.к. продольные гребни всегда находятся в разном положении на теле клетки. Однако при на - блюдении за живыми грегаринами в хорошую оптику эти гребни также видны, и они не изгибаются во время движения. Поэтому можно предположить, что скольжение грегарин, возможно, обусловлено только выделением слизи.
Предполагается, что спорозоиты кокцидий используют другой механизм скольжения. Пока, правда, не найдены какие-
Рис. 4.67. Формы метаболирующего движения у моноцистид (Eugregarinida). (По: Фролов, 1991.) А – Monocystis lumbrici, Á – Rhynchocystis pilosa. цп – цитопили, я – ядро.
222

4.2. ЦИТОСКЕЛЕТ
Рис. 4.68. Изменение расположения гребней на поверхности грегарины Nematocystis magna в результате сокращения тела клетки. (По: Фролов, 1991.)
вм – мембраны внутреннего мембранного комплекса, м – митохондрия, мт – микротрубочки, мф – сократившийся пучок микрофиламентов, пл – плазмалемма.
либо органеллы, ответственные за передвижение этих клето к. Принципиально возможно предположение, что на поверхностной мембране клетки есть специальные участки (сайты), которые могут контактировать с субстратом. С ними связаны м икрофиламенты, обеспечивающие постоянное движение (поток) клеточной мембраны спереди назад. Такая модель (что-то похожее на гусеницу трактора) может объяснить любой тип ско льжения клетки по субстрату при отсутствии выделяемой слиз и и сложных покровов (клеточной оболочки).
Внешне похожее скольжение клеток диатомовых водорослей основано, по-видимому, на выделении ими слизи. Скольжение веретеновидных клеток лабиринтул объяснить труднее. Они передвигаются по внеклеточной эктоплазматической сети. Теоретически они могут осуществлять передвижение за счет конт акта поверхности клетки с мембраной эктоплазматической се ти, но какие механизмы задействованы при этом, сказать трудно.
Клетки десмидиевых скользят по субстрату также за счет вы - деления слизи сквозь специальные поры в клеточной стенке . Причем обычно «мотором» является старая половина клетки ,
223
ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
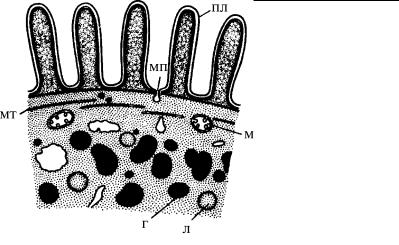
Рис. 4.69. Попереч- ный срез (схема) через тело грегарины
Lecudina pelucida. (По: Фролов, 1991.) г – гликоген, л –
липиды, м – митохондрии, мп – микропора, мт – микротрубочки, пл – плазмалемма гребней на поверхности клетки.
тогда как молодая ее часть находится спереди и несколько приподнята над субстратом. Однако при необходимости направл е- ние движения может меняться на противоположное, и тогда д вижителем становится молодая половина клетки.
4.2.10. Сокращение клетки
Способность к сокращению описана для многих клеток инфузорий и жгутиконосцев. Процесс этот протекает по-разно- му. Иногда это мгновенное сокращение всей клетки (в течени е миллисекунд) и сравнительно медленное возвращение в исхо д- ное положение (инфузории), в других случаях реакция в форме сокращения на какое-либо воздействие продолжается дес ятки минут и завершается еще более длительным периодом восстановления.
Процесс быстрого сокращения тела клетки описан для гетеротрих (Ciliata). Оказалось, что главная роль в этом принадлежит фибриллярному тяжу (мионема), который ассоциирован с постцилиарным корешком из микротрубочек, направленному к заднему концу тела клетки. Постцилиарные корешки у инфузорий длиннее, чем расстояние между кинетидами, поэтому они перекрываются друг с другом и образуют единую корти-
224

4.2. ЦИТОСКЕЛЕТ
кальную систему. Мионемы обычно проходят под корешками
èв нормальном состоянии образованы пучками микрофиламентов по 4 нм толщиной. Эти мионемы всегда окружены каналами ЭПР. Во время сокращения клетки микрофиламенты мионемы становятся толще (10–12 нм) и короче. Это изменение не требует АТФ, а вызывается влиянием ионов кальция. Предполагается, что ионы кальция доставляются к мионемам благ о- даря окружающим их каналам ЭПР, что напоминает работу саркоплазматического ретикулума в поперечно-полосатой мускулатуре у позвоночных.
Микротрубочки же, по-видимому, играют активную роль в расслаблении клетки. Во время сокращения их ленты пассивно скользят относительно друг друга, а при расслаблении о ни могут активно скользить в обратном направлении, используя для этого фибриллярные мостики из динеина. Такие мостики были действительно обнаружены в расслабляющейся после с о- кращения клетке, и отсутствуют в сократившейся особи.
Еще одной системой сокращения клетки является стебелек, имеющийся у сидячих инфузорий. Наиболее хорошо известен пример с Vorticella (рис. 4.61). Одиночные особи Vorticella прикрепляются к субстрату длинным стебельком. И стебелек
èсама клетка находятся в прозрачной оболочке. Под плазма - леммой стебелька находится мионема (спазманема), состоящая из микрофиламентов толщиной 2-3 нм, канал ЭПР и митохондрии. В пространстве между плазмалеммой и оболочкой стебелька находятся стабилизирующие палочки и фибрилля р- ный материал.
При механическом раздражении клетки стебелек быстро скручивается в спираль, при этом сильно укорачиваясь. Показано, что это АТФ-независимое сокращение, но идет только в присутствии ионов кальция. Канал ЭПР может служить депо кальция, а стабилизирующие палочки возвращают стебелек в исходное положение при расслаблении мионемы. Таким образом, сокращение стебелька инфузорий может обеспечивать тот же механизм, что и сокращение тела у гетеротрих.
Некоторые инфузории (Lacrimaria, Homalozoon) могут легко изменять форму тела: изгибаться, складываться пополам,
225

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
скручиваться вдоль продольной оси, наклонять вытянутую переднюю часть клетки и т.д. У таких организмов на попереч- ных срезах клетки обнаруживается кольцевой слой микрофи - ламентов, залегающий под кортикальной зоной цитоплазмы. С внутренней стороны к микрофиламентозному слою прилегае т большое количество митохондрий, а снаружи – множество мел - ких пузырьков. Можно предположить, что у таких инфузорий имеет место тот же механизм сокращения, однако не обнаружена антагонистическая система, позволяющая возвращать ся клетке в исходное состояние. Возможно, это происходит за с чет естественного тургора клетки.
Очень сходно устроена сократительная система внутри кле - ток некоторых грегарин (рис. 4.68). Их кольцевые фибриллы имеют поперечную исчерченность и могут сокращаться, формируя перистальтические волны вдоль клетки (см. стр. 222). Между фибриллами и пелликулой грегарин проходят микротрубочки, которые могут служить антагонистами и возвраща ть исходную форму клетке после расслабления фибрилл.
Процесс медленного сокращения характерен для поперечноисчерченных корешков, состоящих из белка центрина, которы й также относится к семейству кальций-зависимых белков. Такие корешки описаны у празинофитовых, криптофитовых и некото - рыхинфузорий.Ониобычносвязываюткинетосомыжгутикови ли ресничек с какими-либо структурами клетки (поверхностная мембрана, хлоропласт), или сами кинетосомы между собой. Процес с сокращения занимает около часа. При этом корешок укорачив а- ется, увеличивается в толщину, а период его исчерченности уменьшается. Восстановление исходного состояния корешка (расс лабление) занимает еще больше времени. У инфузорий такие исчерченные фибриллы обычно не связаны с кинетосомами. Он и залегают в филаментозном слое между кортексом и эндоплазмой и, возможно, принимают участие в изгибаниях клетки.
У инфузорий встречаются также и корешки с поперечной ис- черченностью, которые, однако, не способны сокращаться.
Мощная сократительная система мионем (миофриски) отме- чена у акантарий (рис. 4.57). Мионемы соединяют поверхность иглы с пограничным фибриллярным слоем, разделяющим экто-
226
4.3.МИТОХОНДРИИ И ДРУГИЕ ЭНЕРГОДАЮЩИЕ ОРГАНЕЛЛЫ
èэндоплазму клетки. При сокращениях миофрисков с одной стороны иглы и одновременном расслаблении с другой, игла отклоняется в ту или иную сторону. Таким образом обеспечивается подвижность игл акантарий. При одновременном сокращении миофрисков цитоплазма клетки как бы натягивается н а иглы, и общий объем клетки увеличивается. При расслаблени и, наоборот, цитоплазма сокращается и объем клетки уменьшается (см. стр. 209–210).
4.3.Митохондрии и другие энергодающие
органеллы
Митохондрии присутствуют в клетках большинства протистов. Их строение значительно разнообразнее, чем у клеток м ногоклеточных животных и растений (рис. 4.70). Для многих одноклеточных протистов показано, что в клетке находится ли шь одна, иногда сильно ветвящаяся, митохондрия. Общеизвестно , что на мембранах митохондрий осуществляются процессы ок ислительного фосфорилирования, завершающиеся образованием аденозинтрифосфата (АТФ). Внутренняя мембрана образует впячивания внутрь митохондрии, называемые кристами. Кристы различаются по форме, вариации которой можно описать тремя основными морфотипами: трубчатые, пузырьковидные и пластинчатые (Серавин, 1993).
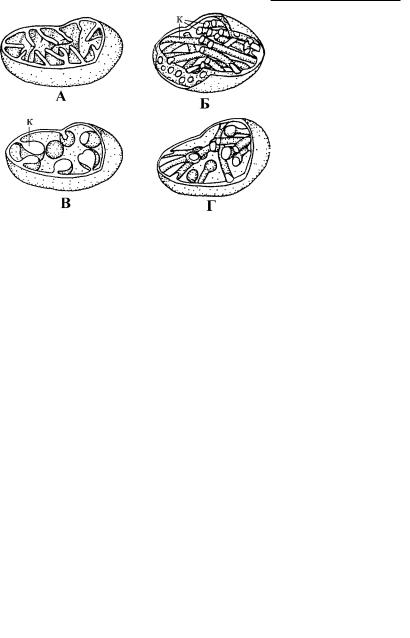
Рис. 4.70. Различные типы крист (к) митохондрий. (По: Кусакин, Дроздов, 1994.)
А – пластинчатые, или гребневидные, Б – трубчатые, В – пузырьковидные, Г – ампуловидные.
227

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
Внутри каждого морфотипа имеются варианты. Например, ампуловидные кристы являются вариантом трубчатых (рис. 4.70). Форма крист митохондрий, как правило, однообразна в преде - лах крупных таксонов и используется в настоящее время в т аксономии. У большинства протистов кристы трубчатой формы.
Внутреннее пространство (матрикс) митохондрии обычно за - полнено аморфным материалом, в котором иногда встречаютс я кристаллические включения или фибриллярные образования . Внутри трубчатых крист некоторых гетероконтов обнаружи ваются тонкие осевые нити. Природа этих включений и филамен - тов неизвестна, хотя можно предположить, что фибриллярные структуры в матриксе митохондрий как раз и представляют с о- бой митохондриальную ДНК.
Помимо собственной ДНК митохондрии содержат и свою систему синтеза белка. Эти клеточные органеллы близки по мн о- гим признакам к прокариотам группы протеобактерий, от которых, как предполагают, они и произошли. Считается, что в процессе длительного симбиоза митохондрии делегировали большую часть своих генов в ядро и в настоящее время белко - вый синтез в митохондриях протистов обычно на 80% зависит от ядра и только 20% белков синтезируется за счет генов, расположенных в митохондриальной ДНК.
Большое значение придается в настоящее время изучению нуклеотидных последовательностей митохондриальной ДНК , что позволяет прояснить родственные связи между таксонами.
Исследование особенностей строения и биохимии митохонд - рий в тех или иных группах показало, что наиболее своеобра з- ными являются митохондрии кинетопластид. В клетках этих организмов, независимо от того, являются они паразитическ и- ми или свободноживущими, имеется всего одна митохондрия с особым вздутием – кинетопластом, – в котором сосредоточен а вся митохондриальная ДНК. Обычно ее называют кинетопластная ДНК (кДНК). Эта кДНК имеет очень сложное строение: она состоит из макси- и мини-колец ДНК, количество которых может достигать сотен и тысяч. Биологический смысл такой организации генома пока неясен.
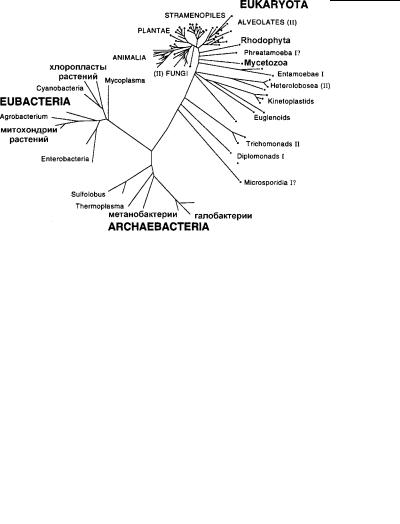
Многие виды паразитических и свободноживущих протистов, обитающих в условиях дефицита кислорода, обладают ан а-
228
4.3. МИТОХОНДРИИ И ДРУГИЕ ЭНЕРГОДАЮЩИЕ ОРГАНЕЛЛЫ
эробным обменом и поэтому не имеют митохондрий (амитохон - дриальные протисты). Это – парабазалии, дипломонады, оксимонады, некоторые инфузории, грибы и амебы (рис. 4.71). Они полностью лишены каких-либо биохимических следов митохо н- дрий: у них отсутствуют ферменты цикла Кребса (трикарбоно - вых кислот), система транспорта электронов, связанного с ц и- тохромами, и реакции окислительного фосфорилирования. В отличие от протистов, имеющих митохондрии, они окисляют пируваты не пируват-дегидрогеназным комплексом, а пирува т- ферредоксин оксиредуктазой – ферментом, который имеется только у прокариот и амитохондриальных эукариот. Большинство этих организмов использует примитивный способ полу че- ния энергии за счет гликолиза. При этом гликолитический ц икл идет непосредственно в цитоплазме и не связан с какими-ли бо структурами. Такой тип энергетического обмена характерен, например, для дипломонад и Entamoeba histolytica.
Рис. 4.71. Распределение безмитохондриальных эукариот, бактерий и органелл на филогенетическом древе организмо в (показано точками) по данным сиквенсов генов16S-подобных рРНК. (По: Mьller, 1998.) Длина линий и порядок ветвления не отражают реального положения группировок эукариот на др еве. Римские цифры I и II означают наличие соответствующего типа анаэробного обмена (см. текст).
229

ГЛАВА 4. СТРОЕНИЕ КЛЕТКИ ПРОТИСТОВ
Таблица 4. Особенности строения митохондрий и иных энергетиячыеских центров у протистов
Таксон |
трубчатые |
пузырьковидн ые |
пластинчатые |
|
ветвящиеся |
неопределенн ойформы |
другие особенности митохондрий |
иные энергетически центрые |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Microsporidia |
- |
- |
|
- |
- |
- |
нет митохондрий |
использование АТФ клетки- |
|
|
|
|
|
|
|
|
хозяина |
Chytridiomycota |
- |
- |
|
+ |
- |
- |
нет митохондрий у |
гидрогеносомы - производные |
|
|
|
|
|
|
|
анаэробов |
митохондрий |
Myxozoa |
- |
+ |
|
+ |
- |
- |
- |
- |
Chlorophyta |
- |
- |
|
+ |
- |
- |
- |
- |
Rhodophyta |
- |
- |
|
+ |
- |
- |
- |
- |
Glaucophyta |
- |
- |
|
+ |
- |
- |
- |
- |
Chrysophyceae |
+ |
+ |
|
- |
- |
- |
- |
- |
Xanthophyceae |
+ |
+ |
|
- |
- |
- |
- |
- |
Apicomplexa |
+ |
- |
|
- |
- |
- |
- |
- |
Ciliophora |
+ |
- |
|
- |
- |
- |
нет митохондрий у |
гидрогеносомы - производные |
|
|
|
|
|
|
|
анаэробов |
митохондрий |
Dinophyta |
+ |
- |
|
- |
- |
- |
- |
- |
Opalinata |
+ |
- |
|
- |
- |
- |
- |
- |
Labyrinthomorpha |
+ |
- |
|
- |
- |
- |
îí |
- |
Choanomonada |
- |
- |
|
+ |
- |
- |
редко дисковидные |
- |
Kinetoplastidea |
+ |
- |
|
+ |
- |
- |
кинетопласт, |
гликосомы у паразитических |
|
|
|
|
|
|
|
дисковидные |
|
Euglenoidea |
- |
- |
|
+ |
- |
- |
- |
- |
Cercomonadida |
- |
+ |
|
- |
- |
- |
- |
- |
Spongomonadida |
- |
+ |
|
- |
- |
- |
- |
хемотрофные симбиотические |
|
|
|
|
|
|
|
|
бактерии |
Apusomonadida |
- |
+ |
|
- |
- |
- |
- |
- |
Thaumatomonadida |
- |
+ |
|
- |
- |
- |
- |
- |
Diplomonadea |
- |
- |
|
- |
- |
- |
нет митохондрий |
гликолиз I |
Oxymonadea |
- |
- |
|
- |
- |
- |
нет митохондрий |
гликолиз I |
Parabasalea |
- |
- |
|
- |
- |
- |
нет митохондрий |
Гидрогеносомыпроизводные |
|
|
|
|
|
|
|
|
митохондрий |
Pedinellophyceae |
- |
+ |
|
- |
- |
- |
- |
- |
Heliozoa |
- |
- |
|
+ |
- |
- |
- |
- |
Acantharia |
- |
+ |
|
- |
- |
- |
- |
- |
Polycystinea |
- |
+ |
|
- |
- |
- |
- |
- |
Phaeodaria |
- |
+ |
|
- |
- |
- |
- |
- |
Lobosea |
- |
+ |
|
- |
+ |
- |
- |
- |
Filosea |
- |
+ |
|
- |
+ |
- |
- |
- |
Chlorarachnidea |
- |
+ |
|
- |
- |
- |
- |
- |
Foraminifera |
- |
+ |
|
- |
- |
- |
- |
- |
Heterolobosea |
- |
- |
|
+ |
+ |
+ |
- |
- |
Cryptophyta |
- |
- |
|
+ |
- |
- |
- |
- |
Bacillariophyceae |
+ |
- |
|
- |
- |
- |
- |
- |
Raphidophyceae |
+ |
- |
|
- |
- |
- |
îí |
- |
Phaeophyceae |
+ |
- |
|
- |
- |
- |
- |
- |
Oomycetes |
+ |
- |
|
- |
- |
- |
- |
- |
Hyphochytridea |
- |
+ |
|
- |
- |
- |
- |
- |
Plasmodiophora |
+ |
- |
|
- |
- |
- |
- |
- |
Pelomyxa |
- |
- |
|
- |
- |
- |
нет митохондрий |
гидрогеносомы |
Обозначения: "-" - нет, "+" – есть, он - в кристах осевая нить
230
