
- •Оптические спектры
- •Законы поглощения света
- •Способы изображения спектров поглощения
- •1. Электронная спектроскопия связь электронных спектров поглощения со строением органических соединений
- •Связывающие орбитали: σ, π;
- •Несвязывающая орбиталь: n;
- •Разрыхляющие орбитали: π*, σ*
- •Энергия орбиталей повышается снизу вверх
- •Электронные спектры поглощения отдельных классов органических соединений
- •Растворители, применяемые при измерении электронных спектров поглощения
- •2. Инфракрасная спектроскопия
- •Спектры комбинационного рассеяния
- •3. Ядерный магнитный резонанс
- •Основы метода
- •Химический сдвиг
- •Соотношения между химическим сдвигом и молекулярной структурой
- •Непрямое спин-спиновое взаимодействие ядер
- •Интегрирование сигналов
- •Пример расшифровки спектра 1н ямр
- •4. Масс-спектрометрия
- •Методы ионизации
- •Список литературы
Методы ионизации
В целом методы ионизации можно разделить на три большие группы - ионизация в газовой фазе, ионизация при десорбции и ионизация при испарении.
Методы ионизации в газовой фазе
В масс-спектрометрии самыми старыми и наиболее популярными являются методы ионизации в газовой фазе. Они применимы к соединениям, имеющим минимальное давление паров около 1·10-6 мм рт. ст. при температуре, при которой соединение сохраняет устойчивость; этому критерию отвечает большинство неионных органических молекул с молекулярной массой менее 1000.
Ионизация электронным ударом
Электронный удар (ЭУ, electron impact, E1) - наиболее распространенный метод ионизации в масс - спектрометрии. Молекула вещества пробы в газовой фазе подвергается бомбардировке пучком электронов с высокой энергией (обычно 70 эВ) и выбрасывает электрон, образуя катион-радикал, называемый молекулярным ионом. Потенциал ионизации молекулы органического соединения обычно ниже 15 эВ, поэтому бомбардировка электронами с энергией 50 эВ и выше сообщает избыточную внутреннюю энергию возникающему молекулярному иону. Эта энергия частично рассеивается за счет разрыва ковалентных связей, энергия которых находится в пределах от 3 до 10 эВ. Обычно такой распад происходит избирательно и охватывает широкий круг связей, является воспроизводимым и характеристическим для одного соединения. Более того, процессы фрагментации предсказуемы, и именно они обусловливают широкие возможности масс-спектрометрии для структурного анализа. Часто избыточная энергия молекулярного иона слишком велика, что приводит к исчезновению его пика в масс-спектре (причина этого может заключаться и в нестабильности молекулярного иона). Понижение энергии электронного пучка является общепринятым приемом получения молекулярного иона, при этом степень фрагментации значительно уменьшается. Недостаток этого приема состоит в том, что спектр изменяется и его сравнение со «стандартным» литературным спектром становится невозможным.
Для многих масс-спектрометрия с ЭУ является синонимом масс-спектрометрии вообще. Эта точка зрения понятна по двум причинам. Во-первых, исторически первым, до того как были разработаны другие методы ионизации, был ЭУ. Большинство ранних работ по масс-спектрометрии было выполнено с ЭУ. Во-вторых, основные библиотеки и базы масс- спектрометрических данных, на которые так часто ссылаются, получены на приборах с ЭУ. Некоторые из общедоступных баз данных содержат спектры ЭУ более 390 000 соединений, которые легко найти с помощью поисковых алгоритмов. Уникальность масс-спектра для данного органического соединения, даже для стереоизомеров, почти несомненна. Эта уникальность соединяется с большой чувствительностью метода, что делает ГХ-МС таким мощным и популярным аналитическим методом.
Химическая ионизация
Ионизация электронным ударом часто приводит к такой глубокой фрагментации, что молекулярный ион не наблюдается. Решить эту проблему можно, применяя методы «мягкой ионизации», из которых важнейшим является химическая ионизация (ХИ, chemical ionization, CI). При использовании ХИ молекулы исследуемого вещества в паровой фазе не подвергаются бомбардировке электронами с высокой энергией. Газ- реагент (обычно используют метан, изобутан, аммиак и др.) вводится в источник и ионизируется. Молекулы исследуемого вещества сталкиваются с ионизированными молекулами газа-реагента (СН5+, С4Н9+ и т. д.) при относительно высоком давлении в камере химической ионизации и подвергаются вторичной ионизации путем переноса протона с образованием ионов [М+1]+ и электрофильного присоединения с образованием [М+15]+, [М+29]+, [М+41]4, [М+18]+ (в случае NH4+). Ион [М]+ редко образуется за счет переноса заряда. Из-за гидридного переноса в спектрах с ХИ иногда наблюдаются заметные сигналы квазимолекулярных ионов [М-1]+. Так возникают ионы с четным числом электронов. Избыточная энергия, которая переносится на молекулы образца во время ионизации, мала, обычно менее 5 эВ, что гораздо ниже энергии фрагментации. Как следствие, фрагментация оказывается незначительной, а чувствительность повышенной, потому что общий ионный ток определяется лишь несколькими ионами. Однако информации о структуре молекул из спектров ХИ получается меньше. Обычно квазимолекулярные ионы довольно устойчивы и легко детектируются. При ХИ часто образуются только один или два фрагментных иона, а иногда и ни одного.
Например, в масс-спектре с ЭУ 3,4-диметоксиацетофенона (рис.18) кроме пика молекулярного иона с m/z 180 наблюдаются многочисленные фрагментные пики с m/z в интервале 15-167; в этот интервал попадает доминирующий пик с m/z 165 и заметные пики с m/z 137 и m/z 77. В спектре с ХИ (газ-реагент-метан, СН4) наблюдается доминирующий пик (100%) иона ([М+1]+, m/z 181), а из других пиков (каждый интенсивностью всего несколько процентов) только пик молекулярного иона m/z 180, пик m/z 209 ([М+29]+ или М+С2Н5+) и пик m/z 221 ([М+41]+ или М+С3Н5). Эти последние два пика возникают в результате электрофильного присоединения карбо-катионов и очень полезны для идентификации пика молекулярного иона. Первичные ионы СН4+ и СН3+ образуются при ионизации электронным ударом избытка газа-носителя метана. Они реагируют с избытком метана и дают вторичные ионы.
СH3+ + СН4 → С2Н5+ + Н2
СН4 + С2Н5+ → С3Н5+ + 2Н2
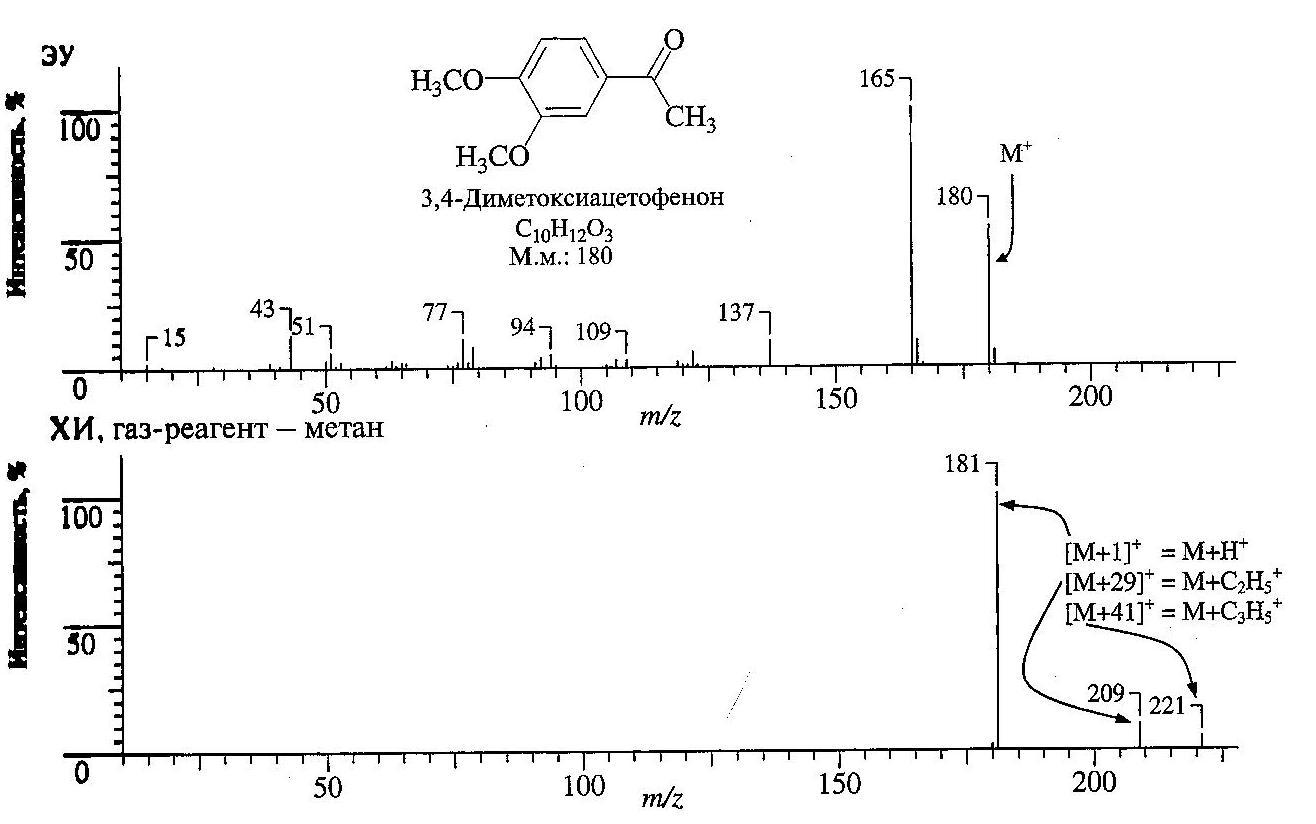
Рис.18. Масс-спектры с ионизацией ЭУ и химической ионизацией 3,4-диметоксиацетофенона [1].
Энергонасыщенность различных вторичных ионов (соответственно из метана, изобутана и аммиака) уменьшается в ряду СН5+ > t-C4H9+ > NH4+. Выбирая газ-реагент, можно направлять процессы при ХИ от преимущественного образования иона [М+1]+ к фрагментам. Например, в масс-спектре диоктилфталата при использовании метана в качестве газа-реагента доминирует пик ([М+1]+ c m/z 391); более важными являются фрагментные пики (например, с m/z 113 и 140) с интенсивностями 30-60% от интенсивности основного пика. При использовании изобутана в качестве газа-реагента пик [М+1]+ остается основным, и интенсивности фрагментных пиков составляют ~5%.
Масс-спектры, полученные с использованием ХИ, не пригодны ни для поиска (ручного или компьютерного) в спектроскопических базах данных, ни для определения структуры. В основном они используются для определения молекулярных ионов и определения молекулярных масс.
Методы десорбционной ионизации
Методы десорбционной ионизации основаны на том, что ионизированные молекулы пробы десорбируются непосредственно из конденсированной фазы в газовую. Первоначально метод применяли для больших молекул нелетучих или ионных соединений. У данного приема имеются значительные неудобства. Для обычных образцов десорбционные методы в общем не эффективны. Часто такие спектры несут ограниченную информацию. В случае неизвестных соединений методы десорбции используют в первую очередь для определения молекулярной массы, иногда с высокой точностью. Однако даже для этих целей метод нужно использовать с осторожностью, так как идентификация молекулярного или квазимолекулярного иона может являться ненадежной. Получающийся спектр часто бывает усложнен ионами вещества матрицы.
Полевая десорбция
В методе полевой десорбции (ПД, field desorbtion, FD) проба помещается на металлический эмиттер, на поверхность которого нанесены тонкие углеродные микроиглы. Эти микроиглы активируют поверхность, на которую подается ускоряющий потенциал и которая функционирует как анод. Очень высокий градиент потенциала на концах игл ионизирует молекулу пробы, и возникший катион выталкивается с поверхности эмиттера. Такие ионы имеют небольшую избыточную энергию, фрагментация происходит в минимальной степени, т. е. обычно наблюдается только вес молекулярного иона. Например, в возбуждаемых методами ЭУ и ХИ спектрах стероида холест-5-ен- 3,16,22,26-тетрола пик молекулярного иона невидим. Однако в масс-спектре с ПД (рис. 19) доминирует пик молекулярного иона и фактически не наблюдается фрагментация.
Полевая десорбция отошла на второй план с появлением метода ББА (бомбардировка быстрыми атомами). Несмотря на то, что метод ПД для неполярных соединений часто полезнее, чем ББА, и в нем отсутствует влияние уровня фона, который возникает при разложении вещества матрицы, он не стал таким распространенным, как ББА; вероятно, из-за того, что производители оборудования активно внедряют именно ББА.
Бомбардировка быстрыми атомами
При ионизации в процессе бомбардировки быстрыми атомами (ББА, fast atom bombardment, FAB) ксенона и аргона с высокой энергией (6-10 кэВ) облучают пробу в виде раствора в жидкости с низким давлением паров (например, в глицерине). Матрица защищает пробу от избыточного радиационного разрушения. Близкий метод ионизации — жидкостная вторичная ионизация или вторично-ионная масс-спектрометрия (ВИМС, liquid secondary ionization mass spectrometry, LSIMS) - отличается использованием ионов цезия с более высокой энергией (10-30 кэВ).
В обоих методах в результате присоединения катионов образуются положительные ионы [М+1]+ или [М+23, Na]+ и отрицательные ионы, возникающие при депротонировании [М-1]+; ионы обоих типов обычно имеют единичный заряд. Главным образом ББА применяют при исследовании больших нелетучих молекул, особенно для определения молекулярной массы. Для большинства классов соединений часть спектра в области низких масс менее информативна, из-за того что там могут проявиться ионы вещества матрицы. Однако для соединений некоторых классов с молекулами, составлеными из «строительных блоков» (таких как полисахариды и полипептиды), фрагментация обычно происходит по гликозидным и пептидным связям соответственно, что дает возможность определять структурные последовательности в этих соединениях.
Верхний предел массы для ББА (и ВИМС) находится между 10 и 20 кДа, однако ББА наиболее полезен до 6 кДа. Самая сложная проблема, возникающая при использовании ББА, заключается в высоком уровне сигналов ионов вещества матрицы, что ограничивает чувствительность и скрывает важные фрагментные ионы.

Рис.19. Масс-спектры с электронным ударом (ЭУ), химической ионизацией (ХИ) и полевой десорбцией (ПД) холест-5-ен-3,16,22,26-тетрола [1].
Методы ионизации при испарении
Существуют два важных метода, которые основаны на том, что ионы или (реже) нейтральные молекулы, находящиеся в растворе (растворитель часто содержит муравьиную кислоту), при испарении растворителя одновременно подвергаются ионизации и последующему анализу. В сочетании с жидкостной хроматографией эти методы стали чрезвычайно популярны.
Масс-спектрометрия с термораспылением
В масс-спектрометрии с термораспылением (thermospray) раствор пробы вводится в спектрометр посредством нагретого капилляра. При распылении и частичном испарении растворителя образуется поток мелких капель, которые попадают в ионный источник. После полного испарения растворителя ионы пробы попадают в анализатор. В этом методе используют большие скорости потока исследуемого раствора и буферного газа; на ранних этапах развития такие масс-спектрометры объединяли с жидкостными хроматографами. В дальнейшем метод в значительной степени был вытеснен электрораспылением.
Масс-спектрометрия с электрораспылением
Источник ионов с электрораспылением (electrospray, ES, ЭР), схема которого показана на рис. 20, работает при атмосферном давлении, а метод называется ионизацией при атмосферном давлении (atmospheric pressure ionization, API). Раствор пробы (обычно в полярном летучем растворителе) попадает в ионный
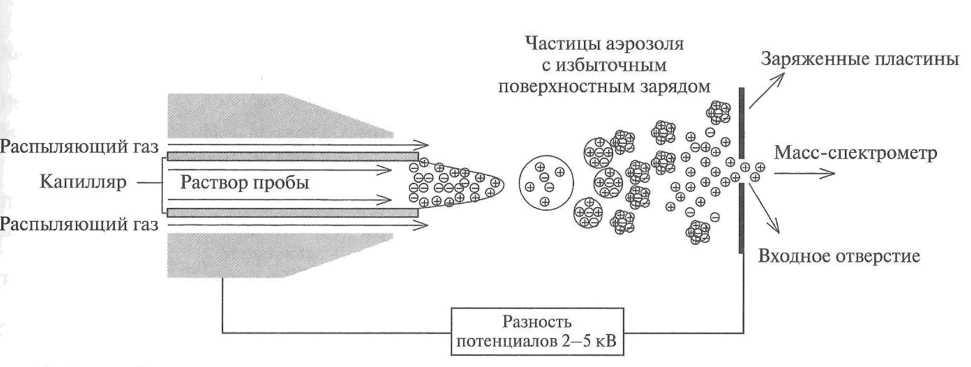
Рис. 20. Схема образования ионов при испарении растворителя в методе электрораспыления
источник через капилляр из нержавеющей стали, который окружен коаксиальным потоком распыляющего газа-азота. На наконечник капилляра подается высокий потенциал (относительно вспомогательного электрода), создающий неоднородное электрическое поле с градиентом до 5 кВ/см. При выходе из капилляра раствор превращается в аэрозоль из заряженных капелек. Поток распыляющего газа направляет аэрозоль в масс-спектрометр.
По мере испарения растворителя капельки аэрозоля сжимаются, а концентрация ионов пробы увеличивается. При достижении критического размера капель силы поверхностного натяжения становятся меньше сил кулоновского отталкивания. Происходит так называемый «кулоновский взрыв», приводящий к ионизации вещества пробы. После фокусировки сепараторами ионы попадают в анализатор масс- спектрометра.
В 90-е гг. XX в. началось быстрое развитие масс- спектрометрии с электрораспылением главным образом в применении к соединениям, молекулы которых могут нести несколько зарядов в разных местах. Например, на больших молекулах белков может находиться до 40 или более зарядов. В этом случае в масс-спектре появляется ряд пиков с увеличивающимися массами, которые отвечают псевдомолекулярным ионам, имеющим меньшее число протонов и, соответственно, меньшие заряды.
Для определения фактической массы иона нужно знать его заряд. Если можно идентифицировать два пика, которые различаются на один заряд, то вычисление сводится к простой алгебре. Простая программа позволяет выполнять такой расчет для каждого пика в спектре и непосредственно вычислять массы молекул.

Рис. 21. Масс-спектры с ионизацией ЭУ и электрораспылением лактозы [1].

Рис. 22. Масс-спектр с электрораспылением тетрапептида, структура которого показана на рисунке [1] .
Многие производители выпускают недорогие масс-спектрометры с электрораспылением по двум причинам. Во-первых, применение этого метода очень успешно и в то же время он продолжает оставаться довольно простым в использовании. Во-вторых, возросло значение анализа макробелков и пептидов, и лучшим методом для этого является электрораспыление.
На рис. 21 сравнивается масс-спектр ЭУ спектр лактозы (в нижней части рисунка) со спектром, полученным с использованием ЭР (верхняя часть рисунка).
Масс-спектр с ЭУ совершенно бесполезен, поскольку у лактозы низкое давление паров, она термически неустойчива, и в ее спектре нет характеристических пиков. В масс-спектре с ЭР наблюдается слабый пик молекулярного иона при m/z 342 и характерный пик [М+23]+ (молекулярный пик плюс натрий). Появление повсеместно распространенных ионов натрия в водном растворе носит общий характер.
На рис.22 показан масс-спектр с ЭР тетрапептида, состоящего из валина, глицина, серина и глутаминовой кислоты (Вал-Гли-Сер-Глу). Основной пик [М+1]+ проявляется при m/z 391, 90% от его интенсивности составляет пик [М+23]+, обусловленный присутствием натрия. Кроме этого полезную дополнительную информацию дает характерная для каждой из аминокислот фрагментация. Для малых пептидов нет ничего необычного в такой фрагментации, но для макромолекул белков этот процесс менее вероятен.
Методы ионизации обобщены в табл.8.
Таблица 8. Методы ионизации

Анализаторы масс
Анализатор масс, который разделяет смесь возникающих в процессе ионизации ионов по величинам m/z, что приводит к образованию спектра, является сердцем любого масс-спектрометра.
Для детектирования движущихся по криволинейной траектории ионов в магнитном секторном масс-спектрометре используется магнитное поле (рис. 23). В них разделение ионов основано на том, что при данной величине заряда в отношении масса/заряд, более легкие ионы отклоняются сильнее, чем тяжелые. При изменении величины магнитного поля в область щели детектора попадают ионы с последовательно изменяющимся соотношением m/z.

Рис.23. Схема простого масс-спектрометра с магнитным 180-градусным секторным анализатором.
Интерпретация масс-спектров с ионизацией электронным ударом.
Дальнейшее обсуждение масс спектров ограничивается масс-спектрометрией с ионизацией электронным ударом. Фрагментация в этом случае несет богатую информацию о структуре.
Масс –спектры обычно получают при энергии электронного пучка 70 эВ. В простейшем случае молекула в газовой фазе под действием электронного удара теряет один электрон, что приводит к образованию молекулярного иона, который представляет собой катион-радикал. Например, метанол образует молекулярный ион, как показано на схеме 1. Одна точка означает оставшийся нечетный электрон; когда заряд локализуется на отдельном атоме, знак заряда указывается на этом атоме.

Схема 1.
Многие из этих молекулярных ионов распадаются за время от 10-10 до 10-3 с и дают в простейшем случае положительно заряженный осколок и радикал. Так образуется ряд осколочных ионов, каждый из которых может распасться на еще более мелкие фрагменты. Возможные пути распада для метанола показаны на схеме 2.
CH3OH·+ → CH2OH+ (m/z 31) + H·
CH3OH·+ → CH3+ (m/z 15) + ·OH
CH2OH+ → CHO+ (m/z 29) + H2
Схема 2.
Если некоторые из молекулярных ионов имеют достаточно большое время жизни, то они достигают детектора и регистрируются в виде пика молекулярного иона. Распознать эти пики очень важно, так как они дают молекулярную массу изучаемого соединения.
Масс-спектр – это представление относительных концентраций положительно заряженных осколков (включая молекулярный ион) в зависимости от их масс. Высота наиболее интенсивного в спектре пика, называемого максимальным (основным), принимается за 100%, а интенсивности (высота, умноженная на коэффициент чувствительности) других ионов, включая пик молекулярного иона, выражаются в процентах от максимального пика. Конечно, иногда максимальным пиком может быть и пик молекулярного иона. На рис. 17 пик молекулярного иона имеет величину m/z 121, а максимальный пик m/z 77. Пик молекулярного иона обычно является пиком с наибольшим массовым числом, за исключением пиков изотопных ионов.
Идентификация пика молекулярного иона.
Распознавание пика молекулярного иона (М)+ в спектрах с ионизацией электронным ударом довольно часто представляется проблематичным. Этот пик может оказаться очень слабым или не появиться совсем. Часто лучшее решение состоит в регистрации масс-спектра с химической ионизацией; при этом получается спектр с интенсивным пиком (М+1)+ при незначительной фрагментации. Многие пики можно исключить из числа возможных пиков молекулярных ионов на основе разумных структурных ограничений. Часто бывает полезным “азотное правило”. Оно устанавливает, что молекула с четной молекулярной массой либо не должна содержать азот, либо число атомов азота должно быть четным; нечетная молекулярная масса требует нечетного числа атомов азота. Это правило справедливо для всех соединений, содержащих углерод, водород, кислород, азот, серу и галогены, а также многие другие реже встречающиеся атомы, такие как фосфор, бор, кремний, мышьяк и щелочноземельные металлы.
Интенсивность пика молекулярного иона зависит от стабильности самого иона. Наиболее устойчивыми молекулярными ионами являются ионы чисто ароматических систем. В общем случае способность органических соединений давать пик молекулярного иона уменьшается в ряду
ароматические соединения > сопряженные алкены > насыщенные циклические соединения > органические сульфиды > неразветвленные алканы с короткими цепями > тиолы.
Определение молекулярной формулы
Молекулярный ион и изотопные пики в масс-спектрах низкого разрешения
До сих пор мы обсуждали масс-спектры низкого (единичного) разрешения (с целочисленными значениями масс), т.е. масса молекулярного иона C7H7NO (рис.17.) с m/z 121 складывается из целочисленных масс наиболее распространенных изотопов 12C, 1H, 14N и 16O.
Кроме того, существуют молекулярные частицы, в состав которых входят изотопы с более низким природным содержанием, что приводит к появлению “изотопных пиков” с М+1, М+2 и т.д. На рис.17 пик М+1 имеет интенсивность около 8% относительно интенсивности пика молекулярного иона, которая принята за 100%. В интенсивность этого пика вносят вклад изотопы 13C, 2H, 15N и 17O.
Молекулярный ион в спектре высокого разрешения
Единственную молекулярную формулу (или молекулярную формулу фрагмента) часто можно получить одним лишь точным измерением массы молекулярного иона (масс-спектрометрия высокого разрешения). Это возможно благодаря тому, что атомные массы не являются целочисленными значениями (табл.9). Например, для целочисленного массового числа 28 в масс-спектрах высокого разрешения можно увидеть различия между CO, N2, CH2N и C2H4.
В табл. 9 представлены массы распространенных ядер с точностью до 4-5 десятичных знаков, здесь же показаны привычные значения атомных масс (усредненные величины для элементов).
Табл.9. Точные величины масс изотопов [1].

Фрагментация
На первый взгляд кажется, что из данных по фрагментации молекул, происходящей при воздействии колоссального избытка энергии, можно только грубо оценивать их структуру. Однако разработанные логические обоснования корреляций между масс-спектром и структурой можно оценить как исключительно изящные, хотя иногда и произвольные.
Обычно стараются рассматривать молекулярный ион с локализованным зарядом. В приближении Будзикевича и соавторов (1967), положительный заряд локализован либо на π-связи (за исключением сопряженных систем), либо на гетероатоме.
Фрагментацию инициирует электронный удар, Только малая часть переносимой электронным пучком энергии расходуется на фрагментацию. Главная часть этой энергии переносится на структуру частицы и расходуется на возбуждение электронных и колебательных состояний катион-радикала.
Фрагментация молекулярного иона с нечетным числом электронов (катион-радикала М·+) по одинарной связи может происходить по гомолитическому или гетеролитическому пути. В случае гомолитического распада (схема 3, I) каждый электрон “движется” независимо, как показано стрелками типа рыболовного крючка (с полуострием): фрагментами являются катион с четным числом электронов и свободный радикал (с нечетным числом электронов). Во избежание загромождения формул достаточно изображать только одну из пары изогнутых стрелок (схема 3, II). При гетеролитическом распаде пара электронов “движется” в одном направлении к заряженному месту, как показано обычной изогнутой стрелкой; фрагментами также являются катион с четным числом электронов и радикал, но в данном случае положительный заряд находится на алкильном продукте (схема 3, III).

Схема 3.
В отсутствие колец (фрагментация которых требует разрыва двух или большего числа связей), бóльшая часть узнаваемых фрагментов в масс-спектре являются катионами с четным числом электронов, образованными, как было показано выше, при разрыве одинарных связей. Дальнейшая фрагментация такого катиона обычно приводит к другому катиону с четным числом электронов и нейтральной молекуле или фрагменту тоже с четным числом электронов (схема 3, IV).
Вероятность разрыва конкретной связи обусловлена ее прочностью, вероятностью переходов с низкой энергией и устойчивостью образовавшихся как заряженных, так и нейтральных фрагментов.
Используя общепринятые представления физической органической химии, можно сформулировать ряд общих правил для предсказания наиболее интенсивных пиков в спектре.
Относительная интенсивность пика молекулярного иона максимальна для неразветвленных соединений и уменьшается по мере увеличения разветвленности (см.правило 3).
С увеличением молекулярной массы в гомологическом ряду относительная интенсивность пика молекулярного иона обычно уменьшается. Исключением являются сложные эфиры жирных кислот.
Разрыв связей происходит преимущественно по алкилзамещенным атомам углерода. Чем больше степень замещения, тем вероятнее распад. Это является следствием повышения устойчивости третичного карбкатиона по сравнению с вторичным, который, в свою очередь, устойчивее первичного. Порядок устойчивости катионов: СН3+ < RCH2+ < R2CH+ < R3C+.
Двойные связи, циклические структуры и, особенно, ароматические (или гетероароматические) циклы стабилизируют молекулярный ион и, таким образом, увеличивают вероятность его появления.
Двойные связи способствуют аллильному распаду циклоалкенов с образованием аллильного карбокатиона.
Насыщенные циклы склонны терять боковые цепи при σ-связи. Это просто особый случай разветвления (правило 3). Положительный заряд остается на циклическом фрагменте (см. схему 4.).

Схема 4.
Распад ароматических алкилзамещенных соединений наиболее вероятен по β-связи относительно цикла. В результате получается бензильный катион или, что более вероятно, катион тропилия (см.схему 5).

Схема 5.
Нужно иметь в виду, что представленные выше правила фрагментации применимы к масс-спектрам, которые получены с использованием электронного удара. Другие способы ионизации (например, химическая и др.) часто приводят к молекулярным ионам с гораздо более низкой энергией и их распад подчиняется другим правилам.
