
- •Оптические спектры
- •Законы поглощения света
- •Способы изображения спектров поглощения
- •1. Электронная спектроскопия связь электронных спектров поглощения со строением органических соединений
- •Связывающие орбитали: σ, π;
- •Несвязывающая орбиталь: n;
- •Разрыхляющие орбитали: π*, σ*
- •Энергия орбиталей повышается снизу вверх
- •Электронные спектры поглощения отдельных классов органических соединений
- •Растворители, применяемые при измерении электронных спектров поглощения
- •2. Инфракрасная спектроскопия
- •Спектры комбинационного рассеяния
- •3. Ядерный магнитный резонанс
- •Основы метода
- •Химический сдвиг
- •Соотношения между химическим сдвигом и молекулярной структурой
- •Непрямое спин-спиновое взаимодействие ядер
- •Интегрирование сигналов
- •Пример расшифровки спектра 1н ямр
- •4. Масс-спектрометрия
- •Методы ионизации
- •Список литературы
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
ПЕТРОЗАВОДСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
В.П. АНДРЕЕВ, П.С. СОБОЛЕВ
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ЛАБОРАТОРНОЙ ДИАГНОСТИКИ
Учебное пособие
для студентов II курса медицинского института
специальностей 31.05.01 «Лечебное дело» и 31.05.02 «Педиатрия»
Петрозаводск
Издательство ПетрГУ
2015
УДК
ББК
В___
Судакова Н.М.
К.б.н., доцент кафедры молекулярной биологии, биологической и органической химии
Галибина Н.А.,
к.б.н., зав. Лаборатории аналитической Института Леса КарНЦ РАН
Печатается по решению редакционно-издательского совета
Петрозаводского государственного университета
Настоящее учебное пособие содержит краткое изложение теоретических основ методов исследования структуры органических низко- и высокомолекулярных соединений по курсу «Введение в лабораторную диагностику», рекомендуемые студентам для более детального усвоения лекционного и семинарского материала, а также при подготовке к практическим занятиям.
Учебное пособие предназначено для студентов медицинских, биологических специальностей и направлений бакалавриата, магистрантов, изучающих физико-химические методы выделения органических соединений методы исследования их структуры.
ВВЕДЕНИЕ
В учебном пособии «Физико-химические основы лабораторной диагностики» представлены основные спектроскопические методы установления структуры и количественного содержания биологически важных соединений органической природы, а также некоторых низкомолекулярных неорганических веществ.
В учебном пособии рассматриваются различные методы качественного и количественного анализа соединений, такие как электронная и инфракрасная спектроскопия, спектроскопия комбинационного рассеяния, ядерный магнитный резонанс и масс-спектрометрия. Перечисленные физико- химические методы в настоящее время широко используются в различных современных приборах в клинической медицинской диагностике. В то же время квалифицированный медик обязан понимать достоинства и границы применения используемых аналитических методов.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ СТРУКТУРЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Среди многообразния физических методов, которые применяются при исследовании строения органических молекул, наибольший интерес представляет взаимодействие вещества с электромагнитным излучением в широком интервале частот, начиная с радиоволн и кончая γ-лучами, т.е. по всему электромагнитному спектру. При этом происходит изменение энергии молекул, которое определяется соотношением Бора
ΔЕ = Ек- Ен = hν
где ΔЕ – изменение энергии системы; Ек и Ен – энергия системы в конечном и начальном состояниях; h – постоянная Планка; ν – частота излучения.
Энергия переходов между двумя энергетическими уровнями может быть измерена в электрон-вольтах (эВ) или калориях (кал).
Связь между энергетическими и волновыми параметрами выражается следующими соотношениями:
λ нм = 107/ν см-1 = 28591/Е ккал/моль = 1239,8/E эв;
ν см-1 = 0,34976·103·E ккал/моль = 8,0658·103·E эв = 107/λ нм;
Е ккал/моль = 23,061·E эв = 2,8591·10-3·ν см-1 = 28591/λ нм;
E эВ =012398·10-3·ν см-1 = 4,3363·10-2·Е ккал/моль = 1239,8/λ нм
Например, длине волны 400 нм соответствует волновое число 25 000 см-1, энергия 3,100 эв/молекулу или 71,5 ккал/моль.
В табл.1 приведен полный спектр электромагнитных волн, который выражен как в энергетических единицах (в электрон-вольтах), так и в волновых параметрах.
Таблица 1 Электромагнитный спектр [1]

Электромагнитный спектр простирается от γ-лучей с длиной волны 10-10 см до радиоволн с длиной волны порядка 104 см; таким образом, длины волн изменяются по электромагнитному спектру на 15 порядков. Энергия по спектру также отличается на 15 порядков и изменяется от 107 эв и более для жестких лучей до 10-8 эв для радиоволн.
Высокоэнергетическая область спектра начинается γ-лучами с энергией 107 эв и более и длиной волны порядка 10-11 см. Это излучение вызывает изменение в энергетическом состоянии ядер, и изучение его дает возможность получить сведения о ядерных силах и взаимодействиях (область спектроскопии γ –резонанса) [2-4].
Энергия порядка сотен тысяч электрон-вольт (длина волны 10-8 см) соответствует рентгеновским лучам, при действии которых происходит изменение энергетического состояния внутренних электронов атома, расположенных вблизи ядра. Изучение этого взаимодействия дает возможность определить энергию связи внутренних электронов ( область рентгеноспектральных исследований).
Энергия порядка десятков электрон-вольт (длина волны более 10-8 см) отвечает ультрафиолетовой и видимой областям спектра и соответствует изменению энергии валентных электронов (область электронной спектроскопии).
Следующая, инфракрасная, область простирается от 10-4 до 10-2 см. Энергия в этой области соответствует энергии переходов между колебательными уровнями атомов в молекулах и составляет доли электрон-вольта (область колебательной спектроскопии).
К инфракрасной области примыкает микроволновая область. Микроволновое поглощение связано с изменением энергии вращения атомов в молекуле и с колебаниями атомов в кристаллической решетке (область микроволновой спектроскопии).
Далее идет идет область радиоспектроскопии (область спектроскопии ядерного магнитного резонанса, ядерного квадрупольного резонанса и электронного парамагнитного резонанса).
Область электромагнитного спектра, которая изучается при помощи спектральных приборов, основанных на оптическом методе разложения излучения, называется областью оптических спектров.
Оптические спектры
Оптические спектры простираются от далекой инфракрасной области, граничащей с микроволновой областью, до рентгеновских лучей (табл.2).
Таблица 2. Область оптических спектров [1].
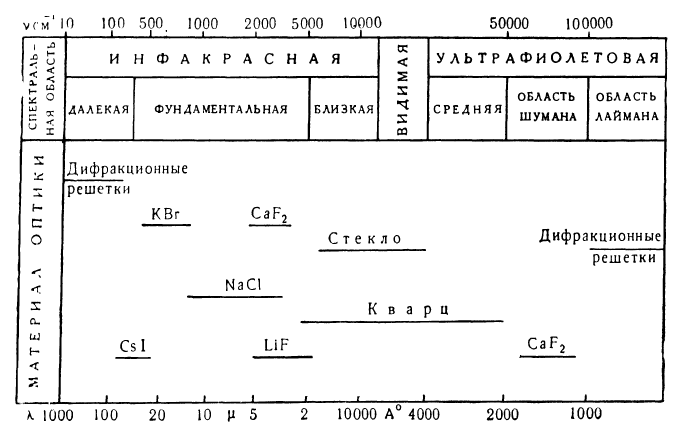
Законы поглощения света
Для оптических спектров имеются общие законы поглощения излучения, дающие соотношение между величиной поглощения и количеством поглощающего вещества.
Первый из них, обычно приписываемый Ламберту, сформулирован Бугером в 1729 году. Этот закон выражает зависимость между поглощательной способностью и толщиной слоя вещества.
Поток параллельных лучей монохроматического света при прохождении через гомогенную поглощающую среду ослабляется по экспоненциальному закону
I = I0e-kl
где I0 – интенсивность падающего монохроматического излучения; I - интенсивность прошедшего монохроматического излучения; l – толщина поглощающего слоя; k – коэффициент поглощения, являющийся индивидуальной характеристикой вещества для каждой длины волны.
Обычно пользуются логарифмической формой записи закона Бугера- Ламберта
D = lg I/I0 = k1l
Закону Бугера подчиняются все вещества.
Второй закон, сформулированный Бером в 1862 г., выражает связь между поглощающей способностью и концентрацией поглощающего вещества в растворе: поток параллельных лучей монохроматического излучения при прохождении через раствор поглощающего вещества концентрации с ослабляется по закону
I = I0e-kсl
или, в логарифмической форме
D = lg I/I0 = k2сl; k2 =0,4343k,
где k и k2 - коэффициенты поглощения, характеризующие вещество.
В отличие от закона Бугера – Ламберта закон Бера не универсален. Отклонения от закона Бера связаны с межмолекулярными взаимодействиями в растворах.
Экспериментальное определение выполнения закона Бера для конкретного вещества заключается в исследовании зависимости оптической плотности от концентрации. В случае подчинения раствора вещества закону Бера эта зависимость для различных длин волн изображается прямой линией. На рис. 1 приведен пример проверки закона Бера для раствора фенола в гексане.
Для инфракрасной области спектра отклонения от закона Бера встречаются чаще. Это вызвано тем, что при измерении спектров поглощения веществ в инфракрасной области используются концентрированные растворы, межмолекулярные взаимодействия в которых достаточно сильны.
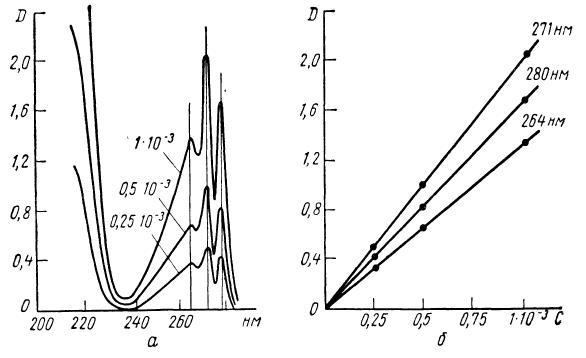
Рис.1. Проверка закона Бера для раствора фенола в гексане: а – спектры поглощения при различных концентрациях; б – зависимость оптической плотности от концентрации для длин волн 264, 271 и 280 нм [2].
Способы изображения спектров поглощения
Если концентрация вещества выражена в молях на литр и толщина слоя в сантиметрах, то коэффициент пропорциональности называется молярным коэффициентом поглощения ε или экстинцией, и тогда закон Бера записывается в виде:
D = εcl, или ε = D / cl.
На рис.2. приведен электронный спектр фенантрена в различных координатах. Как видно из рисунка, форма кривой зависит от выбора координат, в которых проведена запись.
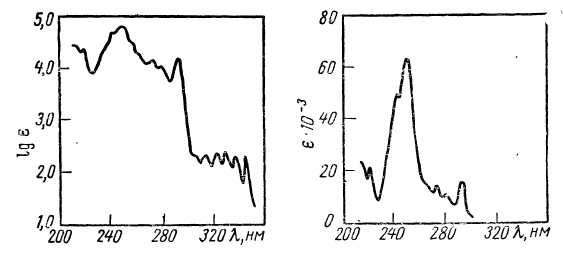
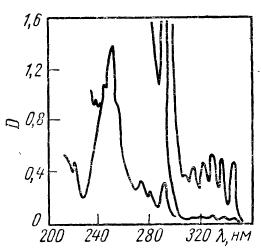
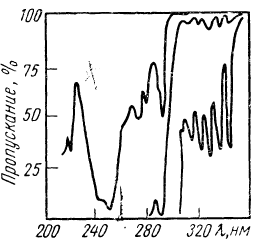
Рис.2. Электронный спектр поглощения фенантрена в различных координатах [2].
В инфракрасной спектроскопии интенсивности полос выражаются либо через пропускание (Т,%), либо через оптическую плотность (А). Пропускание – это отношение энергии излучения, пропущенного образцом, к энергии излучения, падающего на образец. Оптическая плотность – это десятичный логарифм величины, обратной пропусканию: А = lg(1/T). Обычно интенсивности полос обозначают в полуколичественных терминах (с. – сильная, ср. – средняя, сл. – слабая).
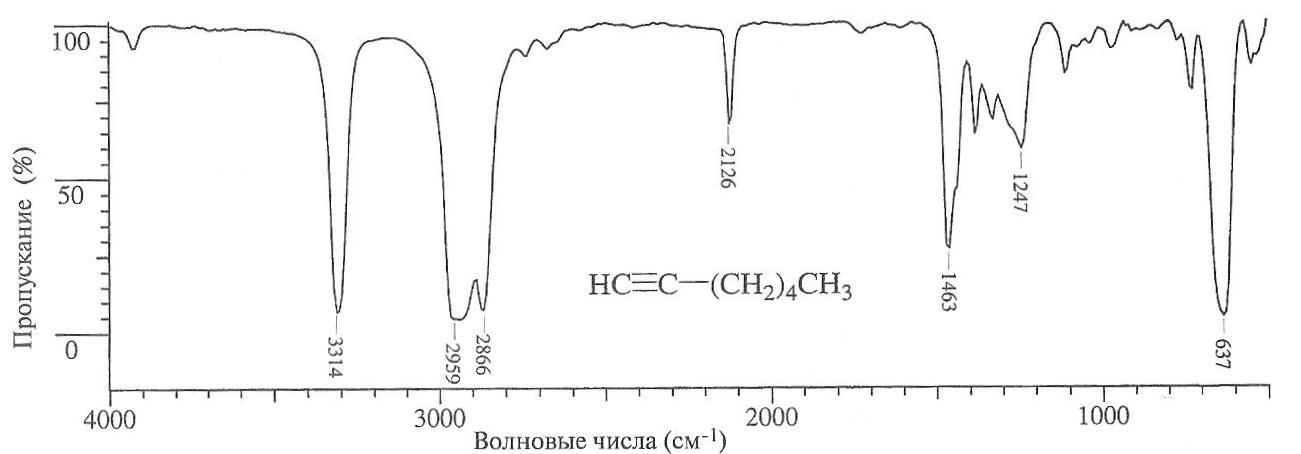 Рис. 3.
ИК-Спектр гептина-1 [5].
Рис. 3.
ИК-Спектр гептина-1 [5].
