
- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 2
- •Содержание
- •Часть 1
- •Часть 2
- •5 Карбоновые кислоты
- •5.1 Алифатические карбоновые кислоты
- •5.1.1 Одноосновные насыщенные кислоты
- •5.1.2 Одноосновные ненасыщенные кислоты
- •5.1.3 Двухосновные насыщенные кислоты
- •5.1.4 Двухосновные ненасыщенные кислоты
- •5.2 Ароматические карбоновые кислоты
- •6 Жиры
- •7 Амины
- •7.1 Алифатические амины
- •7.2 Ароматические амины
- •8 Ароматические диазо- и азосоединения, красители
- •9 Гидроксикислоты
- •9.1 Алифатические гидроксикислоты
- •9.2 Оптическая изомерия органических соединений
- •9.3 Ароматические гидроксикислоты (фенолокислоты)
- •10 Аминокислоты, полипептиды
- •10.1 Аминокислоты
- •10.2 Полипептиды
- •11 Альдегидо- и кетокислоты
- •12 Углеводы
- •12.1 Моносахариды
- •12.2 Дисахариды
- •12.3 Полисахариды
- •13 Гетероциклические соединения
- •13.1 Пятичленные гетероциклические соединения
- •13.2 Шестичленные гетероциклические соединения
- •14 Терпены
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 2
9.3 Ароматические гидроксикислоты (фенолокислоты)
Наибольшее значение имеет орто-гидроксибензойная или салициловая кислота.
Получают её действием СО2 под давлением на фенолят натрия:
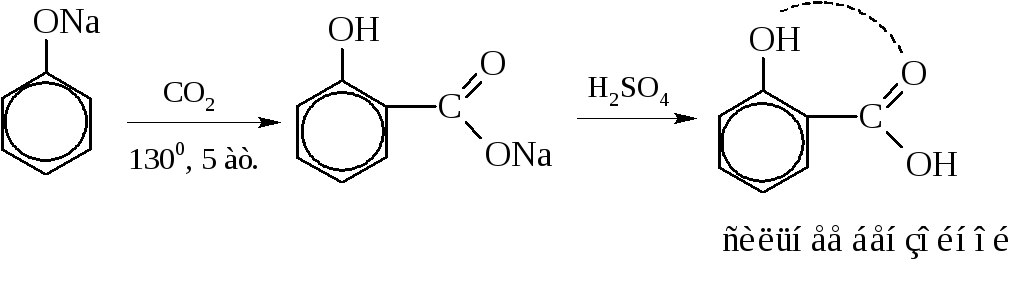
Салициловая кислота значительно сильнее бензойной: образование водородной связи между водородом фенольной и кислородом кислотной групп существенно повышает положительный заряд на атоме углерода карбоксила и тем самым – силу кислоты.
Салициловая кислота образует два ряда производных (по обеим функциональным группам):
– с галогенангидридами и ангидридами она реагирует по фенольной группе:

– хлорангидрид салициловой кислоты образует с фенолами или спиртами сложные эфиры по карбоксилу

В больших масштабах салициловая кислота используется в производстве красителей и лекарственных препаратов. Вот, например, широко известные лекарства

Из полигидроксикарбоновых кислот наиболее известна 3,4,5-тригидроксибензойная или галловая кислота.

Она входит в состав природных дубильных веществ, находится в чае, чернильных орешках.
Танины, извлекаемые из дубильных орешков, представляют собой глюкозу, ацилированную галловой кислотой.

Дубильные вещества – это органические соединения растительного происхождения, имеющие вяжущий вкус. Особенно много их в коре дуба. Применяются, например, для дубления сырых кож. Дубление с химической точки зрения – процесс соединения дубильных веществ с белками кожи (денатурация белков). Отсюда: «дубленка». При этом образуется термически и химически стойкий слой, трудно проницаемый для воды и газов. Получены и синтетические дубители.
В медицине дубильные вещества употребляются как противоядие при отравлении алкалоидами, желудочно-кишечных заболеваниях, при ожогах (таннин) и т.д. Большое значение имеют дубильные вещества в пищевой промышленности, где они нередко определяют характер переработки и вкусовые достоинства готового продукта. Например, производство черного чая основано на превращении дубильных веществ, содержащихся в молодых побегах чайного растения. От правильно проведенного окисления дубильных веществ при ферментации зависит в основном цвет, вкус и аромат чая. Дубильные вещества используются также в производстве какао и ряда других пищевых продуктов.
10 Аминокислоты, полипептиды
10.1 Аминокислоты
Аминокислотами называют соединения, в которых одновременно содержатся аминная и карбоксильная группы. Простейшие аминокислоты имеют тривиальные названия. Обычно же их называют как замещённые соответствующих кислот, обозначая положение аминогрупп относительно кислотной буквами α, β, γ, δ и т. д. Используется также названия по номенклатуре ИЮПАК:
|
|
глицин, гликокол, аминоуксусная, аминоэтановая |
|
|
α-аланин, α-аминопропионовая, 2-аминопропановая |
|
|
β-аланин, β-аминопропионовая, 3-аминопропановая |
|
|
валин, α-аминовалериановая, 2-аминопентановая |
|
|
α-аминокапроновая 2-аминогексановая |
|
|
изолейцин, 2-амино-3-метилпентановая |
|
|
лизин, α,δ-диаминокапроновая, 2,6-диаминогексановая
|
Аминокислоты могут содержать одну или несколько кислотных групп и различаться по основности. В молекулу аминокислоты может также входить и несколько аминогрупп.
Методы получения
– Аминокислоты имеют чрезвычайно большое физиологическое значение. Из остатков аминокислот построены белки и полипептиды. При гидролизе белковых веществ животных и растительных организмов образуются аминокислоты.
– Действие аммиака на галоидзамещённые кислоты

– α-Аминокислоты получают действием аммиака на оксинит-рилы
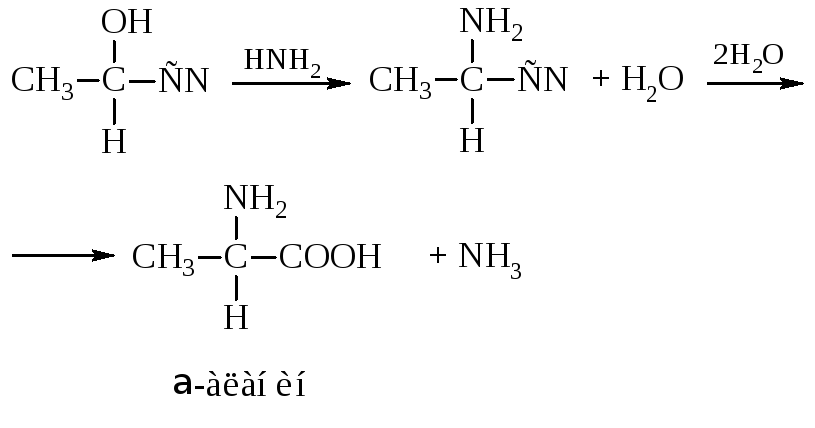
Оксинитрилы получают действием на альдегиды HCN

Физические свойства
Аминокислоты в настоящее время рассматриваются как продукты нейтрализации карбоксила и аминогруппы в одной и той же молекуле, т.е. как внутренние соли

Молекула внутренней соли является биполярным ионом, то есть молекулой с разноимёнными зарядами на противоположных концах молекулы.
Существованием аминокислот в виде биполярных ионов объясняются высокие температуры плавления аминокислот, их малая летучесть, нерастворимость в углеводородах и хорошая растворимость в воде. Некоторые аминокислоты оптически активны.
Химические свойства
Поскольку в молекулах аминокислот имеются амино- и карбоксильные группы, они вступают в реакции, характерные для этих функциональных групп. Эти реакции были рассмотрены ранее в соответствующих разделах курса.
Дополнительно к этому познакомимся со свойствами аминокислот, которые обусловлены одновременным присутствием в структуре молекул обеих функциональных групп.
– Наличие в молекуле аминокислоты кислотной и основной групп обуславливает амфотерность этих соединений и существование их в виде биполярного иона. В кислой среде образуется катион соли аминокислоты как основания, в щелочной – анион соли аминокислоты, как кислоты.

Концентрация водородных ионов (рН среды), при которой амфотерное соединение наименее и в равной мере диссоциировано по обоим направлениям, называется изоэлектрической точкой.
В изоэлектрической точке аминокислота существует в виде биполярного иона (в целом электрически нейтрального соединения), поэтому в изоэлектрической точке водные растворы аминокислот неэлектропроводны. Изоэлектрическая точка для каждой аминокислоты является индивидуальной характеристикой и может использоваться для их идентификации.
– С основаниями аминокислоты образуют соли. Особенно характерно образование медных солей, имеющих интенсивную синюю окраску. Эти вещества являются внутрикомплексными соединениями

– Химическое поведение аминокислот в значительной мере определяется взаимным расположением аминогруппы и карбоксила. Особенно ярко это проявляется при нагревании аминокислот.
α-Аминокислоты при нагревании легко отщепляют воду и дают дикетопиперазины.

β-Аминокислоты отщепляют аммиак и образуют аммонийную соль непредельной кислоты

γ- и δ-Аминокислоты отщепляют воду внутримолекулярно и дают лактамы

Отдельные представители
α-Аминопропионовая кислота (α-аланин)

В α-аланине имеется асимметрический атом углерода. Поэтому он оптически активен. L(+)-аланин входит в состав всех белков. Его можно получать гидролизом фиброина шёлка.
2,6-диаминогексановая кислота (лизин)
*
![]()
В состав лизина входят две аминогруппы и один карбоксил. Поэтому он является сильным основанием. L(+)-лизин входит в состав белков и относится к незаменимым аминокислотам.
6-Аминогексановая кислота (ε-аминокапроновая)
![]()
Эта кислота и её лактам, капролактам, используется для получения синтетического волокна капрон.

