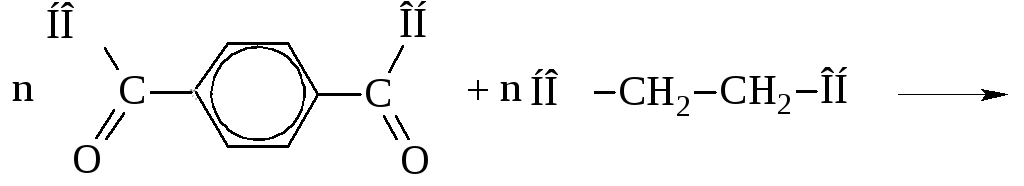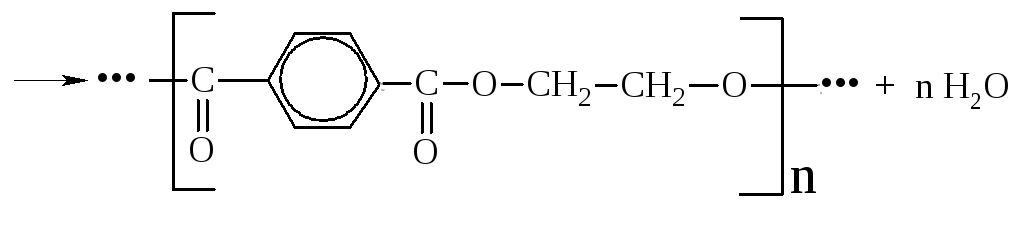- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 2
- •Содержание
- •Часть 1
- •Часть 2
- •5 Карбоновые кислоты
- •5.1 Алифатические карбоновые кислоты
- •5.1.1 Одноосновные насыщенные кислоты
- •5.1.2 Одноосновные ненасыщенные кислоты
- •5.1.3 Двухосновные насыщенные кислоты
- •5.1.4 Двухосновные ненасыщенные кислоты
- •5.2 Ароматические карбоновые кислоты
- •6 Жиры
- •7 Амины
- •7.1 Алифатические амины
- •7.2 Ароматические амины
- •8 Ароматические диазо- и азосоединения, красители
- •9 Гидроксикислоты
- •9.1 Алифатические гидроксикислоты
- •9.2 Оптическая изомерия органических соединений
- •9.3 Ароматические гидроксикислоты (фенолокислоты)
- •10 Аминокислоты, полипептиды
- •10.1 Аминокислоты
- •10.2 Полипептиды
- •11 Альдегидо- и кетокислоты
- •12 Углеводы
- •12.1 Моносахариды
- •12.2 Дисахариды
- •12.3 Полисахариды
- •13 Гетероциклические соединения
- •13.1 Пятичленные гетероциклические соединения
- •13.2 Шестичленные гетероциклические соединения
- •14 Терпены
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 2
5.1.4 Двухосновные ненасыщенные кислоты
Наиболее простыми представителями этого ряда кислот являются фумаровая и малеиновая кислоты. Они имеют одинаковую структурную формулу и являются геометрическими изомерами:
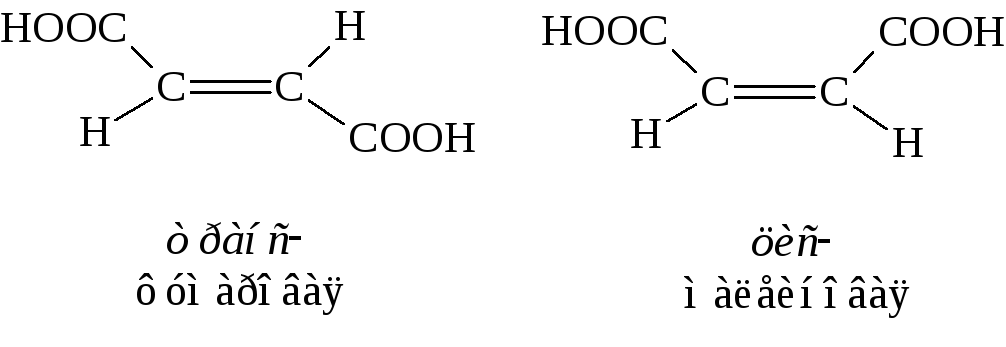
Обе кислоты получают из яблочной кислоты. Осторожное нагревание даёт фумаровую, сильное – малеиновую кислоту
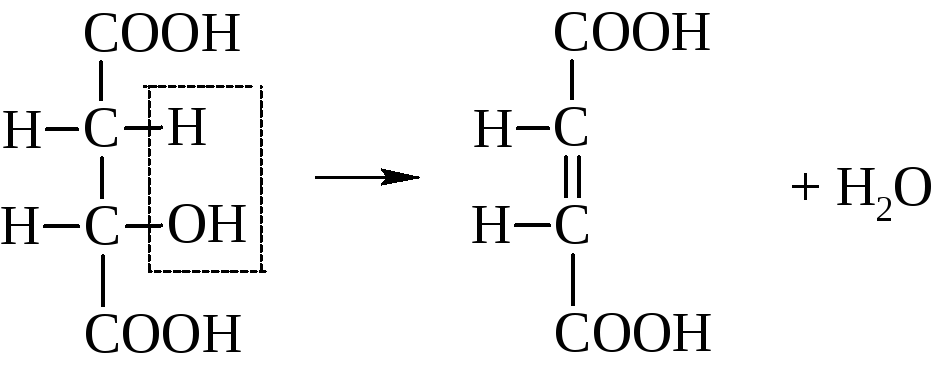
Одинаковость структурной формулы обеих кислот подтверждается тем, что при гидрировании они дают одну кислоту – янтарную
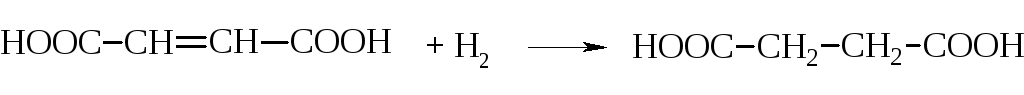
Различия в пространственном строении малеиновой и фумаровой кислот сильно отражается на их свойствах.
Фумаровая кислота плохо растворима в воде, возгоняется без плавления при температуре 200 °С. Малеиновая кислота очень легко растворима в воде и плавится при 130 °С, она является более сильной кислотой, чем фумаровая.
При нагревании малеиновая кислота легко отщепляет воду с образованием малеинового ангидрида
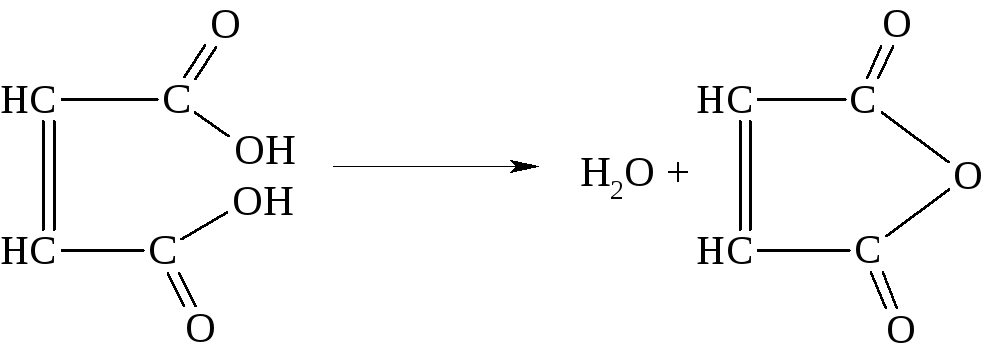
Малеиновый ангидрид получается в технике при неполном окислении многих органических соединений (бензол, бутилены, циклогексан и др.). Он является хорошим диенофилом и применяется для обнаружения сопряженных диенов. Используется также в производстве стеклопластиков и для получения сополимеров со стиролом, акриловыми и метакриловыми эфирами. Такое применение его обусловлено наличием в молекуле активированной двойной связи С = С.
Фумаровая кислота своего ангидрида не образует и лишь при температуре 300 °С отщепляет воду с образованием… малеинового ангидрида.
С энергетической точки зрения фумаровая кислота стабильней малеиновой кислоты на 29,2 кДж∙моль-1.
5.2 Ароматические карбоновые кислоты
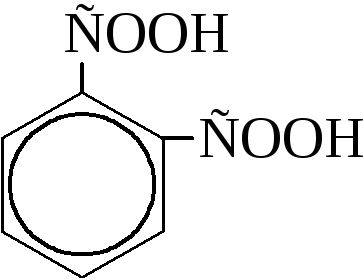
В зависимости от числа карбоксильных групп, – СООН, связанных с ароматическим ядром, ароматические карбоновые кислоты могут быть одно-, двух- и многоосновными. Они обычно носят тривиальные названия. Например:
|
|
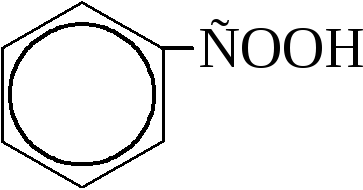
бензойная кислота |
|
|
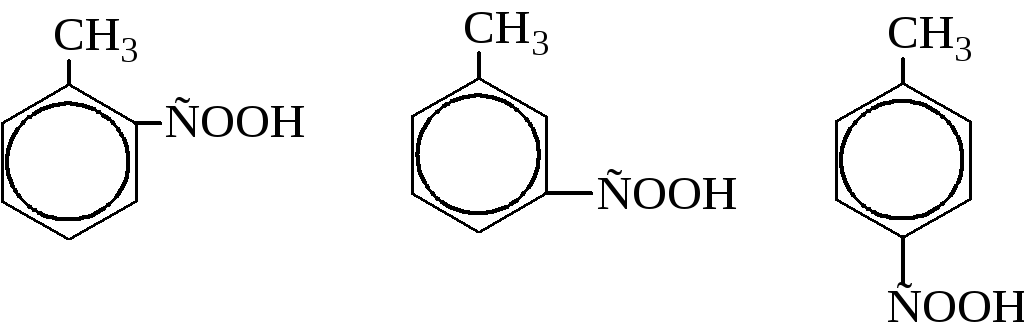
о-, м- и п-толуиловые кислоты |
|
|
о-фталевая |
|
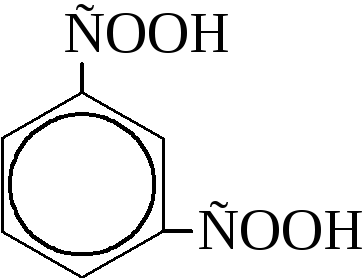
|
м-фталевая или изофталевая |
|
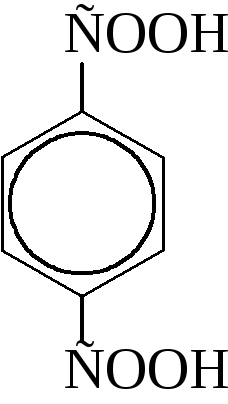
|
п-фталевая или терефталевая |
|
|
1,2,3-бензолтрикарбо-новая кислота или гемимеллитовая |
Способы получения
Ароматические карбоновые кислоты могут быть получены обычными методами получения карбоновых кислот, например, гидролизом геминальных тригалогенпроизводных с галогенами в боковой цепи, гидролизом ароматических нитрилов, через магнийорганические соединения и т.д.. Однако преимущественно их получают способами, основанными на окислении.
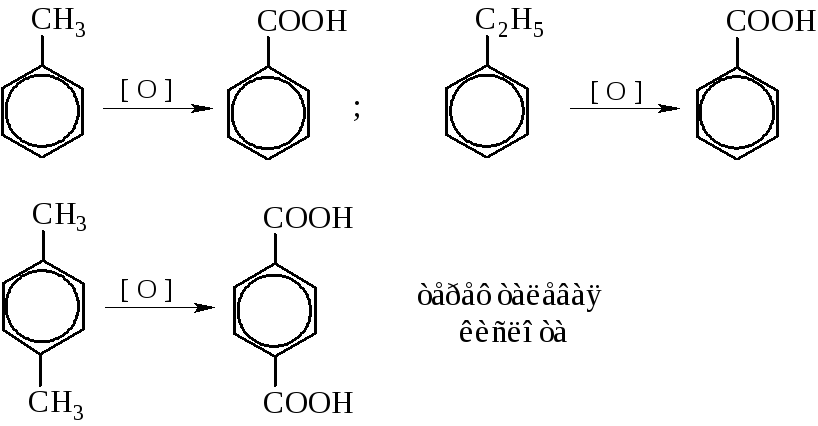
– Окисление ароматических углеводородов. При энергичном окислении боковые цепи гомологов бензола «отгорают» и образуют соответствующие ароматические кислоты. Окислителями служат хромовая кислота и щелочной раствор перманганата калия.
– Окисление ароматических кетонов гипохлоритом натрия

Физические свойства
Ароматические кислоты – кристаллические вещества, плохо растворимые в воде и хорошо – в полярных органических растворителях.
Химические свойства
– Константы диссоциации ароматических кислот несколько выше, чем у кислот жирного ряда (.бензойная кислота – 6,6·10-5,.уксусная кислота – 1,76·10-5). Это связано с большей электрофильностью бензольного кольца (смещение электронной плотности к сильно ненасыщенной группировке).
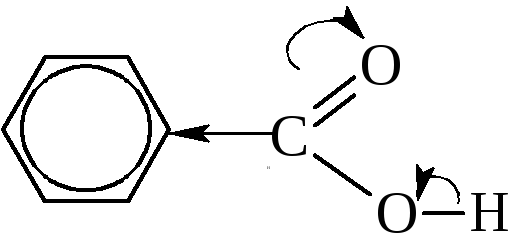
– Для карбоксильной группы в ароматических кислотах характерны те же реакции, что и в алифатическом ряду: это реакции образования солей со щелочами, образования ангидридов и галогенангидридов, реакции этерификации, ацилирования и т.д.
Например, при нагревании смеси ароматической кислоты и спирта в присутствии серной кислоты образуется сложный эфир.
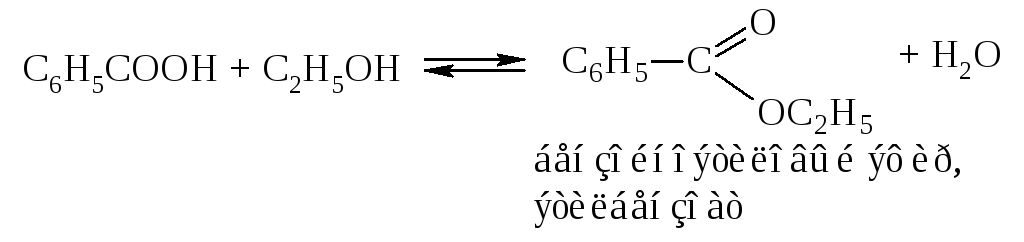
Если заместителей в орто-положении нет, то этерификация идёт также легко, как и в случае алифатических кислот. Однако, если одно из орто-положений замещено, скорость реакции резко падает, если же замещены оба орто-положения – реакция вовсе не идет.
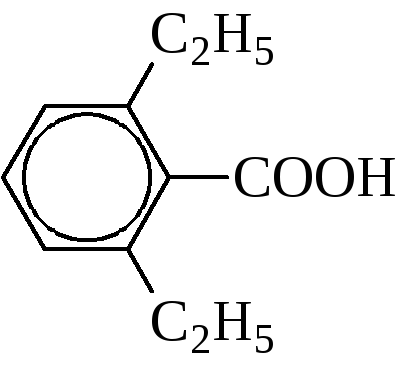
Этот факт указывает на пространственные затруднения: орто-заместители настолько сильно экранируют углерод кислотной группы, что затрудняют или делают невозможной атаку внешнего реагента на него.
В реакциях замещения в ароматическом ядре карбоксильная группа выступает как ориентант второго рода (электроноакцепторная группа) и направляет электрофильную атаку в мета-положение, затрудняя реакцию.
Бензойная кислота
Бензойная кислота содержится в некоторых природных смолах. Получают её почти исключительно окислением толуола. Она применяется в производстве красителей и лекарственных веществ. Большое промышленное значение имеет хлористый бензоил – хлорангидрид бензойной кислоты,
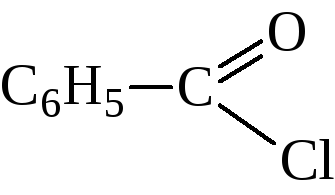
Получают его неполным гидролизом бензотрихлорида, который готовят хлорированием толуола на свету.

Хлористый бензоил находит применение как ацилирующее средство.
Из ароматических кислот с карбоксилом в боковой цепи наиболее известна фенилуксусная кислота, которую получают через её нитрил.

Используют в парфюмерии и медицине.
Дикарбоновые ароматические кислоты
Они представлены тремя изомерами
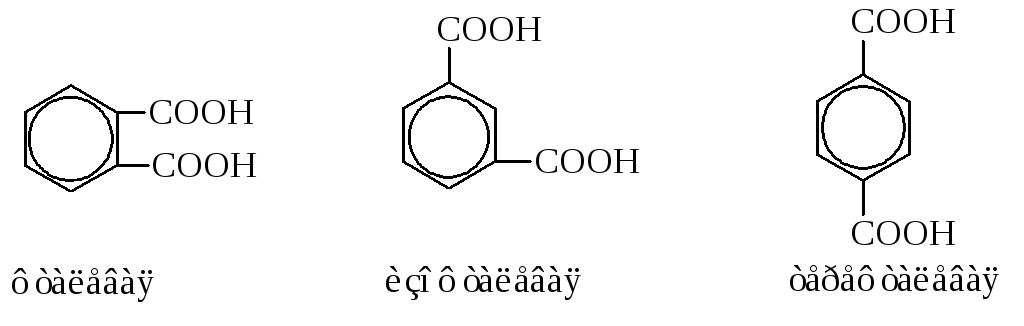
Используются, в основном, фталевая и терефталевая кислоты. Фталевая кислота получается окислением о-ксилола (о-диметилбензола) или нафталина. При нагревании она даёт фталевый ангидрид.
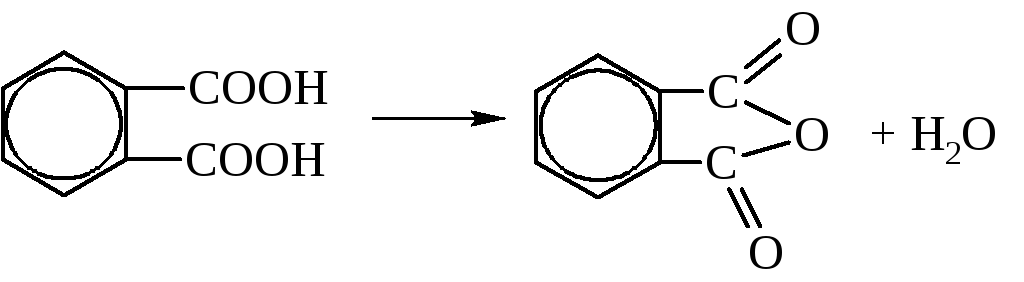
Фталевая кислота используется, главным образом, в виде фталевого ангидрида. Он идёт на получение эфиров фталевой кислоты. Диметилфталат является хорошим репелленом (отпугивает комаров, гнус). Конденсацией фталевого ангидрида и глицерина получают глифталевые смолы, применяющиеся в качестве прочных покровных материалов, плёнок, лаков. Фталевый ангидрид идёт на производство красителей.
Терефталевую кислоту получают окислением п-ксилола. Она применяется для получения полиэтилентерефталата, из которого формуют синтетическое полиэфирное волокно лавсан. Этерификация кислоты этиленгликолем протекает как реакция поликонденсации с образованием полимера и выделением воды: