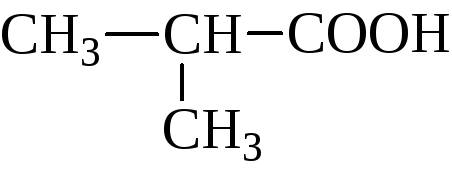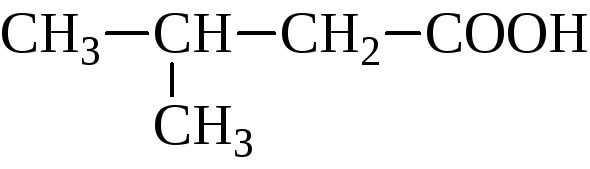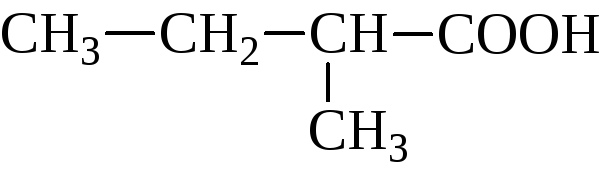- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 2
- •Содержание
- •Часть 1
- •Часть 2
- •5 Карбоновые кислоты
- •5.1 Алифатические карбоновые кислоты
- •5.1.1 Одноосновные насыщенные кислоты
- •5.1.2 Одноосновные ненасыщенные кислоты
- •5.1.3 Двухосновные насыщенные кислоты
- •5.1.4 Двухосновные ненасыщенные кислоты
- •5.2 Ароматические карбоновые кислоты
- •6 Жиры
- •7 Амины
- •7.1 Алифатические амины
- •7.2 Ароматические амины
- •8 Ароматические диазо- и азосоединения, красители
- •9 Гидроксикислоты
- •9.1 Алифатические гидроксикислоты
- •9.2 Оптическая изомерия органических соединений
- •9.3 Ароматические гидроксикислоты (фенолокислоты)
- •10 Аминокислоты, полипептиды
- •10.1 Аминокислоты
- •10.2 Полипептиды
- •11 Альдегидо- и кетокислоты
- •12 Углеводы
- •12.1 Моносахариды
- •12.2 Дисахариды
- •12.3 Полисахариды
- •13 Гетероциклические соединения
- •13.1 Пятичленные гетероциклические соединения
- •13.2 Шестичленные гетероциклические соединения
- •14 Терпены
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 2
5 Карбоновые кислоты
В состав органических карбоновых кислот в качестве функциональной входит карбоксильная группа

В зависимости от числа этих групп различают одно-, двух-, трёх-… многоосновные кислоты. В зависимости от типа присоединенного к карбоксилу радикала они обычно подразделяются на алифатические (насыщенные и ненасыщенные), алициклические, ароматические и т.д.
5.1 Алифатические карбоновые кислоты
5.1.1 Одноосновные насыщенные кислоты
Гомологический ряд этих кислот начинается муравьиной кислотой
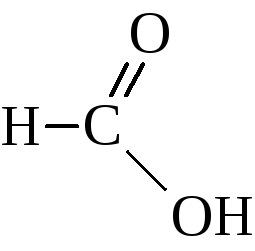
Изомерия кислот этого ряда определяется строением углеводородного радикала при карбоксильной группе и начинается с четвёртого члена ряда. Тривиальные названия карбоновых кислот привились очень прочно и широко используются наряду с названиями по номенклатуре ИЮПАК. Названия кислот по этой номенклатуре производятся от названия соответствующего углеводорода с добавлением суффикса -овая кислота. Иногда эти кислоты называют как производные уксусной кислоты.
|
|
муравьиная, метановая | |
|
|
уксусная, этановая | |
|
|
пропионовая, пропановая | |
|
|
масляная, бутановая |
|
|
|
изомасляная, 2-метилпропановая | |
|
|
валериановая, пентановая | |
|
|
изовалериановая, 3-метилбутановая | |
|
|
метилэтилуксусная, 2-метилбутановая | |
|
|
капроновая, гексановая | |
|
|
энантовая, гептановая | |
|
|
каприловая, октановая | |
|
|
пеларгоновая, нонановая | |
|
|
пальмитиновая, гексадекановая | |
|
|
стеариновая, октадекановая и т.д. | |
Способы получения
– Способы, основанные на окислении:
а) окисление первичных спиртов (см. тему «Гидроксисоединения»);
б) окисление альдегидов (см. тему «Карбонильные соединения»);
в) окисление предельных углеводородов кислородом воздуха на катализаторе. При окислении синтина (см. тему «Алканы») этот способ даёт смесь кислот с разной длиной цепи и используется в промышленности при производстве моющих средств.
– Гидролиз нитрилов, которые получают действием цианида калия на галогеналкилы

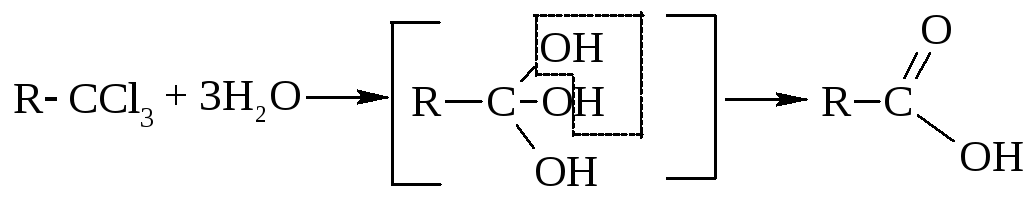
– Гидролиз
геминальных тригалогеналканов
– Синтез через магнийорганические соединения

– Оксосинтез – промышленный метод получения карбоновых кислот. Он заключается в действии на олефины оксида углерода (II) и водяного пара при 300…400 °С в присутствии катализаторов (например, Ni(CO)4)
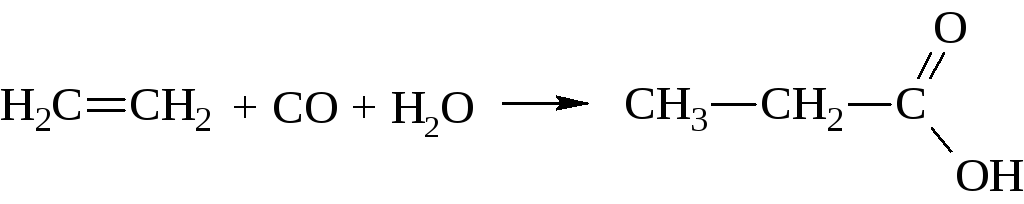
Физические свойства
Муравьиная, уксусная и пропионовая кислоты легкоподвижные бесцветные жидкости с характерным острым запахом. С водой смешиваются во всех отношениях. Кислоты С4 – С9 – маслянистые жидкости. Растворимость их в воде сильно уменьшается с ростом молекулярной массы. Кислоты С10 и выше – твёрдые кристаллические вещества, нерастворимые в воде.
Температуры кипения их растут по мере увеличения молекулярной массы. Сравнительно со спиртами, имеющими то же число углеродных атомов, кислоты кипят выше. Например, этиловый спирт кипит при 78,3 °С, а уксусная кислота – при 118,5 °С. Это объясняется большей ассоциацией молекул кислоты и образованием ею более прочных ассоциатов. Физические измерения указывают в основном на димеризацию за счёт водородных связей.
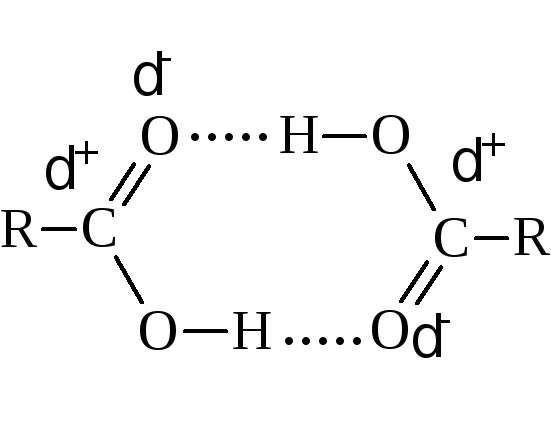
Кислоты с чётным числом углеродных атомов плавятся при более высокой температуре, чем кислоты с нечётным числом.
Химические свойства
– Карбоновые кислоты – это протонные кислоты. При диссоци-ации они выделяют протон
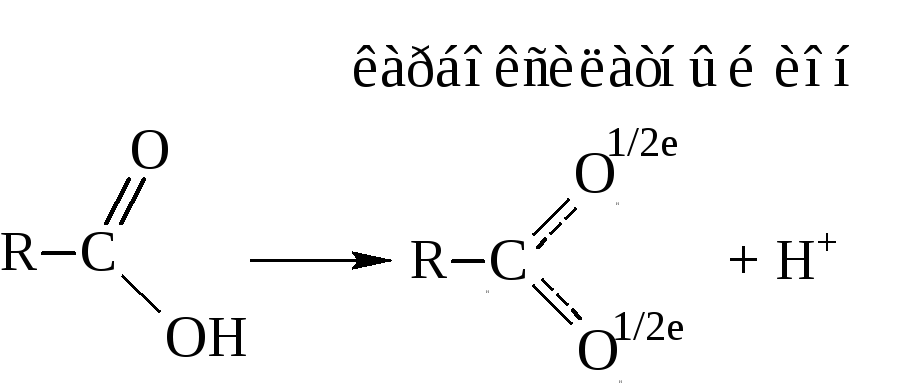
Кислотные свойства объясняются перераспределением электронной плотности в карбоксильной группе в сторону кислорода.
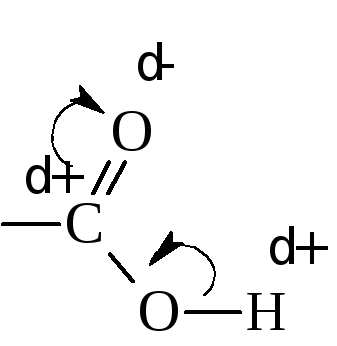
Вследствие этого связь О – Н ослабляется и сравнительно легко разрывается. Величина константы диссоциации фактически зависит от величины дробного положительного заряда на карбоксильном углероде. Чем он выше, тем сильнее кислота. Степень диссоциации или, другими словами, сила кислот зависит также от величины и характера радикала, соединённого с карбоксильной группой. Алкильные радикалы посредством индукционного эффекта повышают электронную плотность в карбоксиле (понижают положительный заряд на карбоксильном углероде), тем самым, понижая силу кислоты.

С увеличением алкильного радикала константы диссоциации карбоновых кислот несколько уменьшается. Так, константа диссоциации муравьиной кислоты Н–СООН 2,17·10-4, уксусной СН3–СООН 1,76·10-5 и капроновой СН3–СН2–СН2–СН2–СН2–СООН 1,31·10-5.
Введение в радикал электрофильной, электронооттягивающей группы, напротив, увеличивает силу кислоты. К примеру, константа диссоциации хлоруксусной кислоты 1,40·10-3.

– Как всякие кислоты, карбоновые кислоты способны к образованию солей с металлами, их оксидами и гидрооксидами
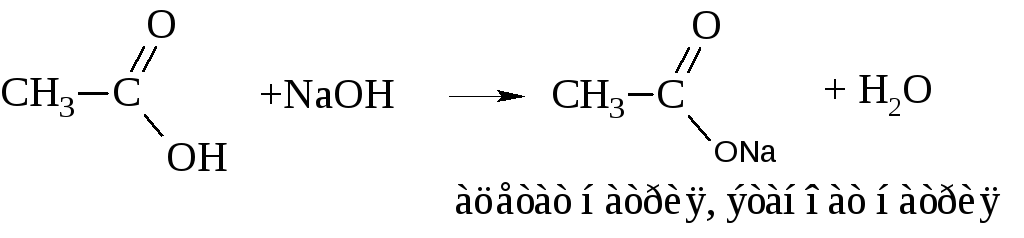
Пиролизом кальциевых солей получают альдегиды и кетоны, пиролизом натриевых в присутствии NаОН – углеводороды.
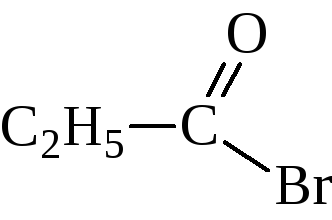
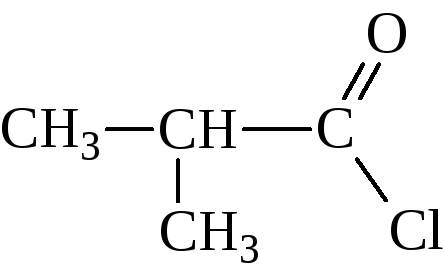
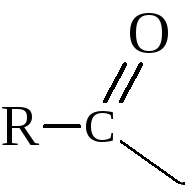
– При действии на кислоты галогенидов фосфора или тионилгалогенида образуются галогенангидриды кислот
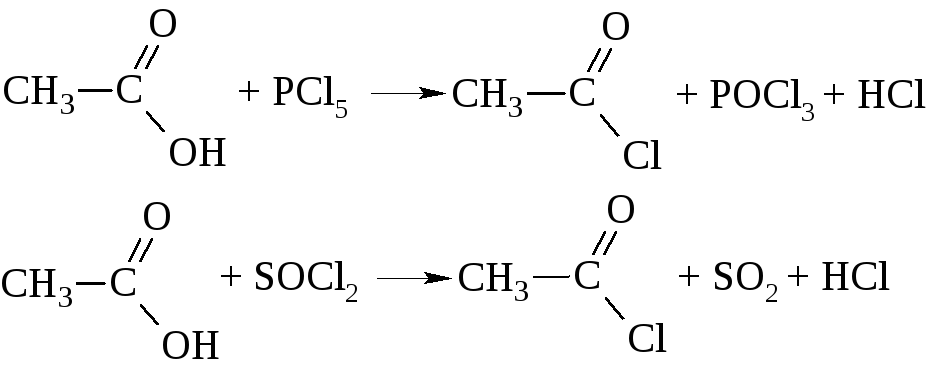
Галогенангидриды кислот называют по кислоте и галогену (хлорангидрид уксусной кислоты), а также по кислотному радикалу ацилу
|
|
хлористый формил, хлористый метаноил |
|
|
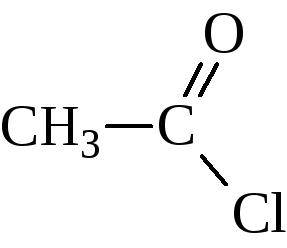
хлористый ацетил, хлористый этаноил |
|
|
Бромистый пропионил, бромистый пропаноил |
|
|
хлористый изобутирил, хлористый 2-метилпропаноил |
В галоидангидридах кислот галоид чрезвычайно подвижен и легко вступает в реакции обмена. Причиной подвижности галоида является большой положительный заряд на углероде (δ+), который связан сразу с двумя электронооттягивающими атомами – кислородом и галогеном.
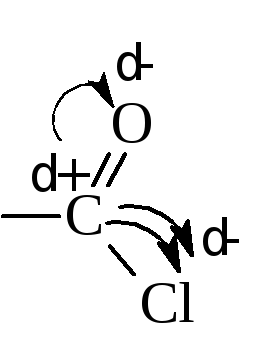
Этот углерод легко подвергается атаке нуклеофильных реагентов.
В реакциях галогенангидридов с соединениями, содержащими металлы или активный атом водорода, происходит замена атомов металла или водорода на ацил. Реакция называется ацилированием. Например, в случае уксусной кислоты – это ацетилирование.
Ацилированием получают целый ряд производных кислот: соли, ангидриды, сложные эфиры, амиды, нитрилы и др. Например:
а) гидролиз хлорангидрида или ацетилирование воды

б) алкоголиз хлорангидрида или ацетилирование спиртов
в) аммонолиз хлорангидрида или ацетилирование аммиака
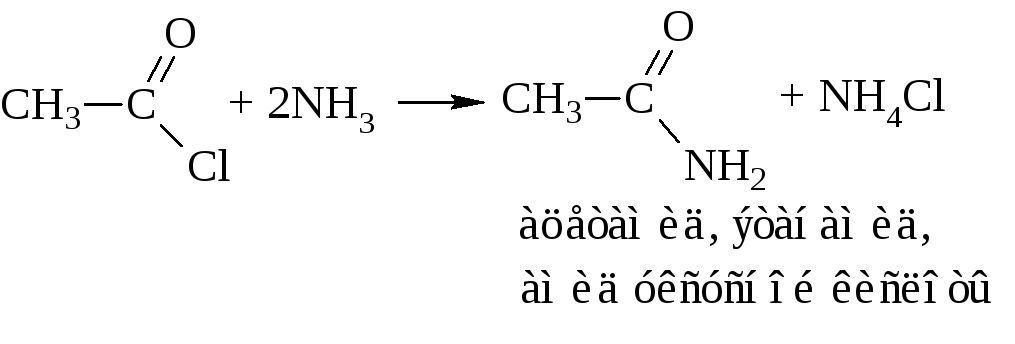
г)

– В результате отщепления воды от двух молекул кислоты также образуются ангидриды кислот

или ангидрид этановой кислоты
Таким путём ангидриды получаются лишь в очень жёстких условиях: или в присутствии сильных водоотнимающих средств (Р2О5), или в присутствии катализаторов (Al2O3) при высоких температурах. Обычно их синтезируют действием галогенангидридов на соли кислот
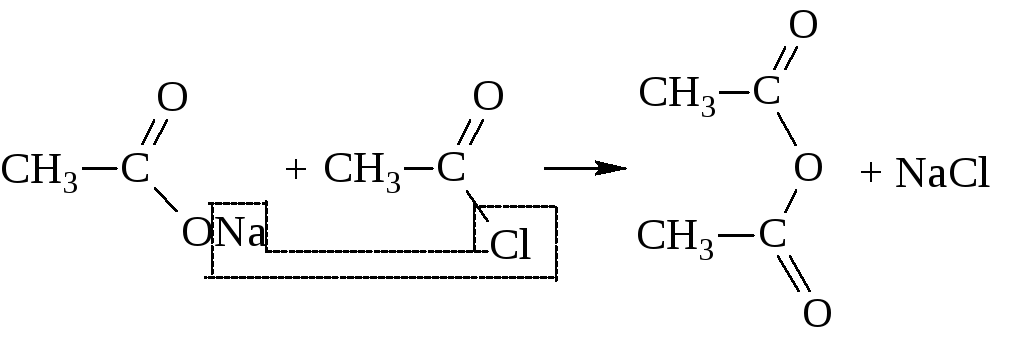
Ангидрид могут образовывать и две различные кислоты.
Ангидриды кислот – вещества весьма активные:
с водой они дают соответствующие кислоты
 ,
,
со спиртами и аммиаком образуют смеси кислот со сложными эфирами и амидами соответственно.

Ангидриды кислот являются хорошими ацилирующими средствами. Однако половина молекулы ангидрида не ацилирует, а выделяется в виде кислоты.
– Амиды кислот. Их обычно получают через галогенангидриды и ангидриды кислот (см. выше). В промышленности амиды синтезируют действием аммиака на кислоты
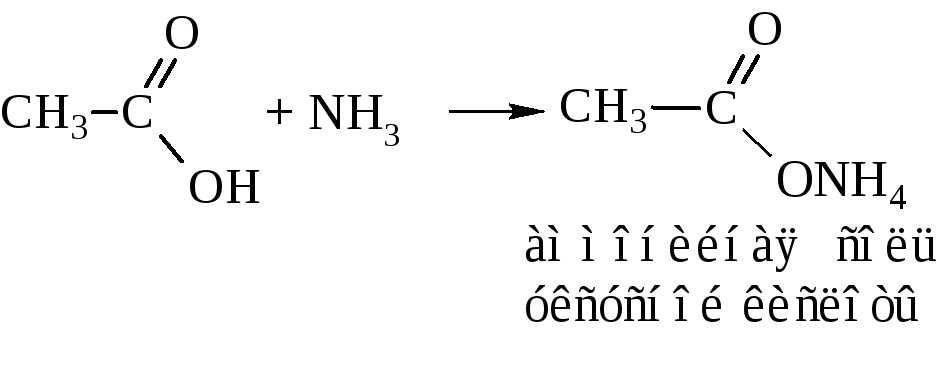
При сухой перегонке аммонийная соль выделяет воду с образованием амида

Ацетамид по номенклатуре ИЮПАК будет называться этанамидом.
При ацилировании аминов получаются алкил- и диалкиламиды, имеющие промышленное значение.
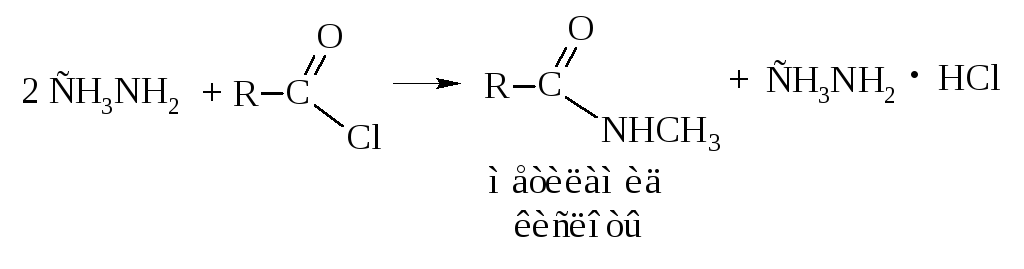
– Сложные эфиры можно получать прямым взаимодействием кислоты со спиртом, т.е. реакцией этерификации кислот спиртами в присутствии кислого катализатора
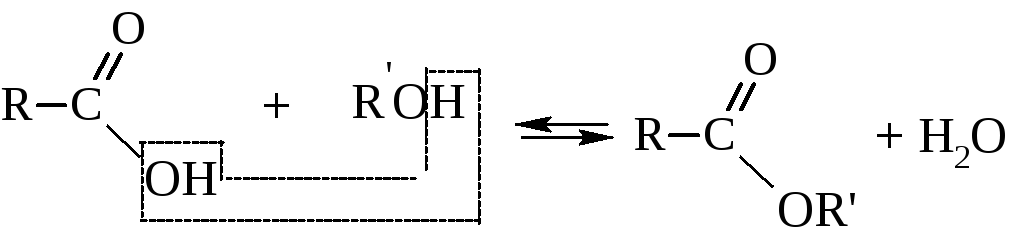
Эта реакция давно интересовала химиков. В 1862 году Бертло установил, что реакция обратима и равновесие наступает, когда прореагирует примерно по 2/3 моля исходных веществ. В конце ХIХ века Н. А. и Н. Б. Меншуткины обнаружили, что скорость реакции этерификации зависит от строения кислоты и спирта. Было установлено, что скорость этерификации падает при увеличении числа и объёма радикалов при α-углеродном атоме по отношению к карбоксилу. Этот факт, очевидно, объясняется экранированием углеродного атома карбоксила замещающими радикалами.
С помощью меченых атомов (изотоп кислорода О18) было показано, что вода при этерификации образуется за счёт гидроксила кислоты и водорода спирта
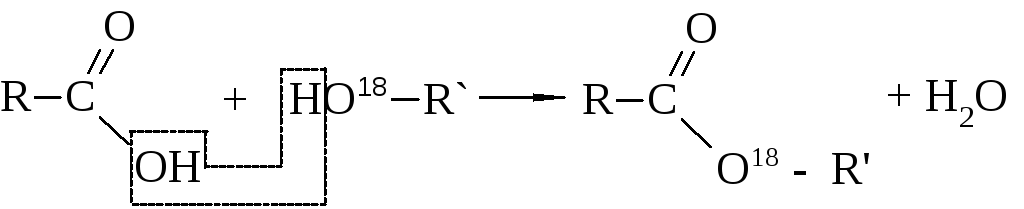
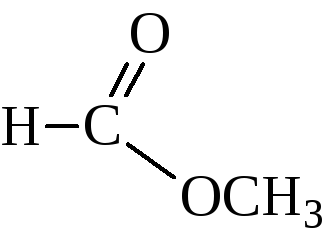
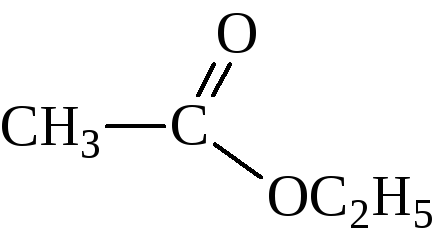
Названия сложных эфиров по тривиальной номенклатуре строятся по следующей схеме: название радикала спирта плюс название кислотного радикала, в котором окончание -ил заменено на -ат. По номенклатуре ИЮПАК: название радикала спирта плюс название кислоты, в котором окончание -овая заменено на -оат.
|
|
метилформиат, метилметаноат |
|
|
этилацетат, этилэтаноат |
|
|
бутилпропионат, бутилпропаноат |
Как показано выше, сложные эфиры можно также получать взаимодействием спиртов с ангидридами и галогенангидридами кислот.
В реакции со спиртами сложные эфиры способны обмениваться с ними радикалами. Эта реакция называется переэтерификацией.
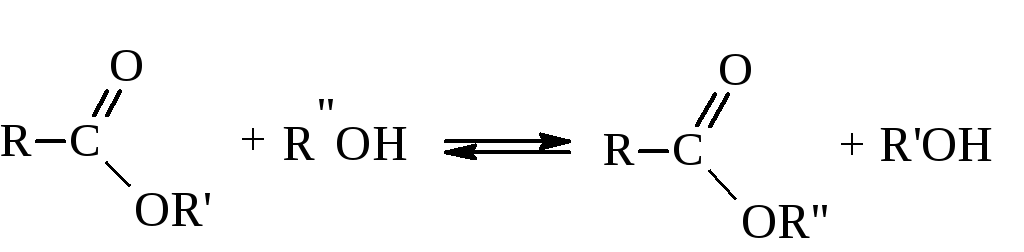
– Галогензамещенные кислоты
Хотя в карбоксильной группе наблюдается значительное смещение электронной плотности к кислороду, углеродный атом карбоксила обладает не столь большим положительным зарядом, как углерод карбонила в кетонах и альдегидах. Это обусловлено частичной нейтрализацией электронной ненасыщенности углерода смещением электронов от гидроксила
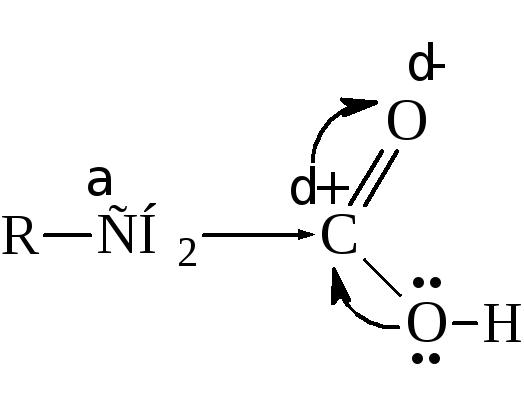
И всё же карбоксил оказывает влияние на соединённый с ним углеводородный радикал, оттягивая на себя электронную плотность и повышая активность водородных атомов, прежде всего у α-углерода.
Прямое хлорирование и бромирование карбоновых кислот происходит на свету с вступлением галогенов в α-положение.
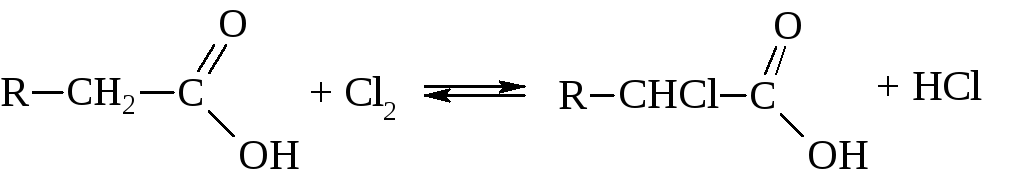
Обычным же способом синтеза α-галогензамещённых кислот является метод Гелль-Фольганд-Зелинского, заключающийся в действии на карбоновую кислоту молекулярного хлора или брома в присутствии фосфора
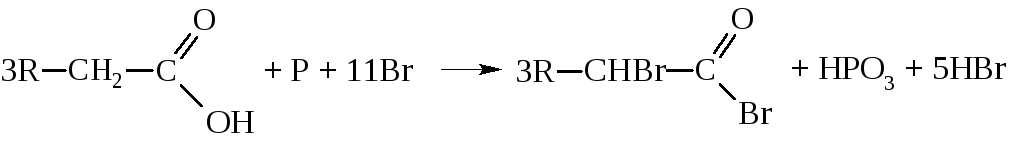
Другой метод синтеза, приводящий к β-галогензамещенным кислотам, заключается в гидрохлорировании α,β-ненасыщенных карбоновых кислот
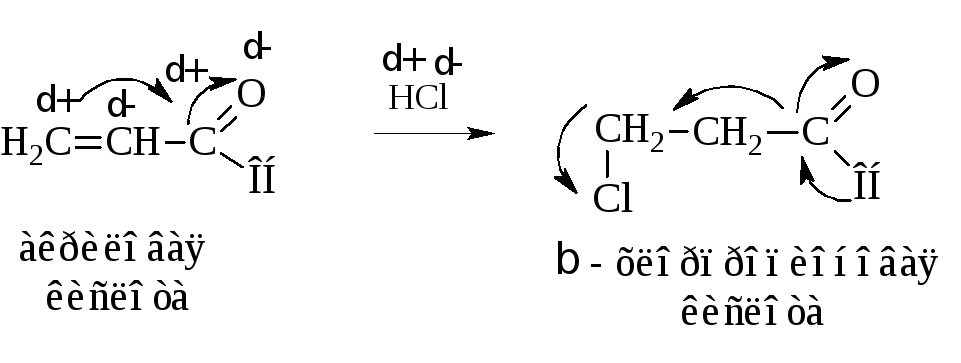
Присоединение НCl протекает вопреки правилу Марковникова из-за смещения электронной плотности по системе сопряжения молекулы к кислороду и в соответствии с зарядами атомов.
Действие галогеноводородных кислот на гидроксикислоты также приводит к желаемому результату
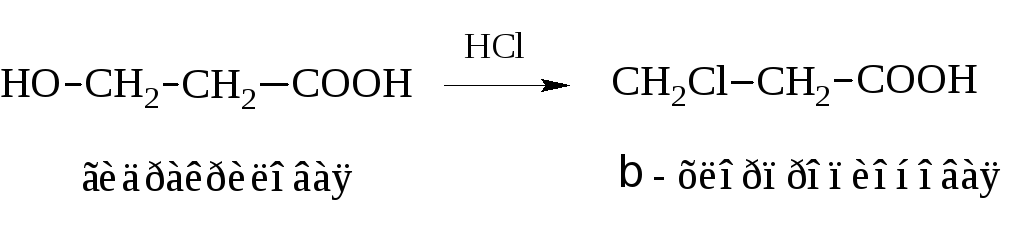
Замещение α-водорода галогеном значительно повышает силу кислоты. Галоген сильно оттягивает электронную пару от α-углерода, обнажая его положительный заряд. Он, в свою очередь, через углерод карбоксила притягивает к себе электроны гидроксильной группы. Таким образом, посредством индукционного эффекта, протон гидроксила активируется. Подобная картина, правда, менее выражено, наблюдается и при удалении галогена от карбоксила.
При замене водорода в радикале кислоты на I, Br, Cl, F, а также увеличении числа атомов галогена, последовательно увеличивается сила и константы диссоциации кислот (К).
Например:
|
|
К·105
|
|
К·105 |
|
|
1,75 |
|
5700 |
|
|
200 |
|
50000 |
|
|
150 |
|
140 |
|
|
150 |
|
9 |
|
|
75 |
|
Галогенкислоты благодаря большой активности нашли широкое применение.
Отдельные представители
Муравьиная кислота – жидкость с tкип = 100,8 °C и резким запахом. При попадании на кожу вызывает ожоги.
В промышленности её получают из оксида углерода и едкого натра
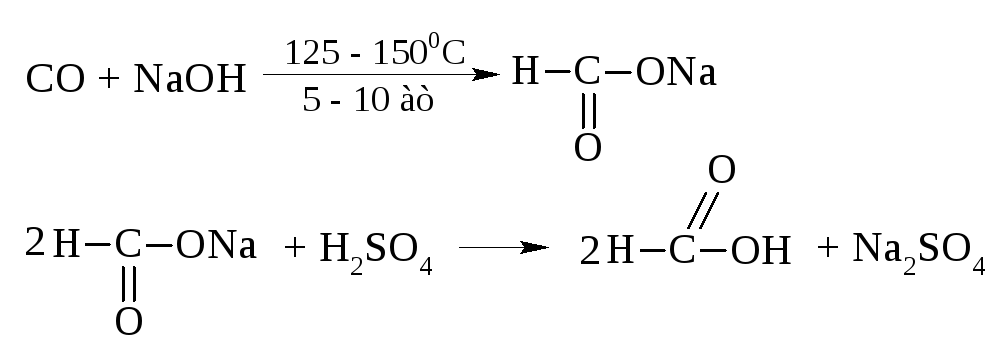
Муравьиная кислота занимает особое место в ряду кислот. Наряду с карбоксилом в ней может быть выделена и альдегидная группа.
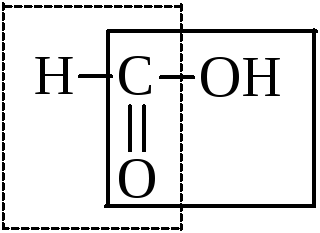
Поэтому, обладая всеми свойствами кислот, она вступает в реакции окисления: серебряного зеркала, с фелинговой жидкостью, – т.е. в типично альдегидные реакции.
Муравьиная кислота используется для дезинфекции в медицине и промышленности, при крашении тканей, в ряде синтезов.
Уксусная кислота
Безводная уксусная кислота при температуре +16,6 °С застывает и называется поэтому ледяной. tкип.= 118,5 °С.
Получают её гидратацией ацетилена, окислением этилового спирта и предельных углеводородов, уксуснокислым брожением сахаристых веществ и другими методами.
В химическом отношении – это обычная карбоновая кислота.
Применяется как прекрасный растворитель, в кожевенном производстве, лакокрасочной, пищевой, химической и других отраслях промышленности. Причём расходуется в больших количествах.
Высшие жирные кислоты
Наиболее известны пальмитиновая С15Н31СООН и стеариновая С17Н35СООН кислоты. Эти кислоты имеют молекулы с нормальной цепочкой углеродных атомов. Их получают при омылении жиров и каталитическим окислением парафинов.
Соли этих кислот – мыла. Натриевые и калиевые соли этих кислот хорошо растворимы в воде и хорошо «мылятся». Соли магния, кальция, бария и др. (соли жёсткости) плохо растворяются в воде. Поэтому в жёсткой воде обычные мыла переходят в нерастворимое состояние и не «мылятся».
Для изготовления свечей используют твердую смесь высших жирных кислот – стеарин.