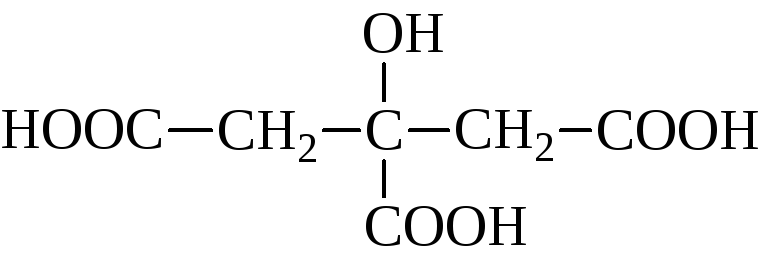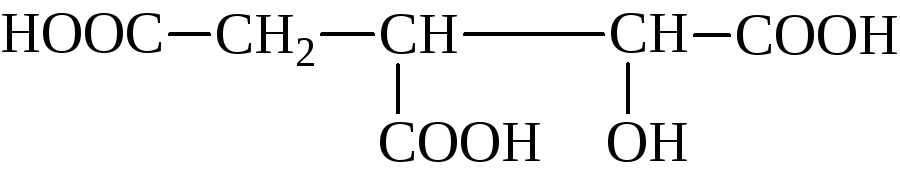- •Г. Н. Роганов органическая химия Учебно-методическое пособие
- •Часть 2
- •Содержание
- •Часть 1
- •Часть 2
- •5 Карбоновые кислоты
- •5.1 Алифатические карбоновые кислоты
- •5.1.1 Одноосновные насыщенные кислоты
- •5.1.2 Одноосновные ненасыщенные кислоты
- •5.1.3 Двухосновные насыщенные кислоты
- •5.1.4 Двухосновные ненасыщенные кислоты
- •5.2 Ароматические карбоновые кислоты
- •6 Жиры
- •7 Амины
- •7.1 Алифатические амины
- •7.2 Ароматические амины
- •8 Ароматические диазо- и азосоединения, красители
- •9 Гидроксикислоты
- •9.1 Алифатические гидроксикислоты
- •9.2 Оптическая изомерия органических соединений
- •9.3 Ароматические гидроксикислоты (фенолокислоты)
- •10 Аминокислоты, полипептиды
- •10.1 Аминокислоты
- •10.2 Полипептиды
- •11 Альдегидо- и кетокислоты
- •12 Углеводы
- •12.1 Моносахариды
- •12.2 Дисахариды
- •12.3 Полисахариды
- •13 Гетероциклические соединения
- •13.1 Пятичленные гетероциклические соединения
- •13.2 Шестичленные гетероциклические соединения
- •14 Терпены
- •Список использованной литературы
- •Приложение а учебно-методические материалы для самостоятельной работы студентов
- •Продолжение приложения а
- •Продолжение приложения а
- •Приложение б
- •Часть 2
9 Гидроксикислоты
Гидроксикислоты относятся к соединениям со смешанными функциями. Так называют органические соединения, содержащие две или более различных функциональных групп. К этой обширной группе соединений относятся также аминокислоты, альдегидо- и кетокислоты, гидроксиальдегиды, гидроксикетоны, углеводы и многие другие.
9.1 Алифатические гидроксикислоты
Гидроксикислоты – это органические вещества, в состав которых входят гидроксильная и карбоксильная группы.
Например, СН2–СООН – гидроксиуксусная кислота.
׀
ОН
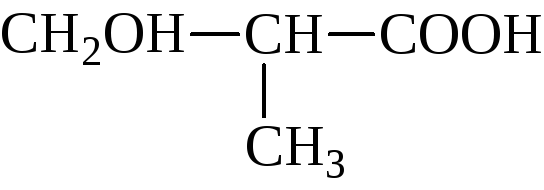
Для гидроксикислот различают понятия основности и атомности. Основность гидроксикислот измеряется числом карбоксильных групп в молекулах, а атомность – числом гидроксилов, включая и гидроксилы кислотных групп. Так, молочная кислота является одноосновной и двухатомной
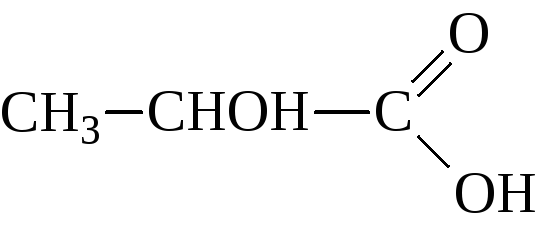
яблочная – двухосновной и трёхатомной
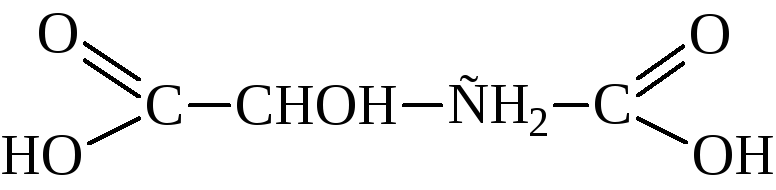
Изомерия. Номенклатура
Простейшие гидроксикислоты обычно имеют тривиальные названия по природным источникам их получения: молочная, яблочная, винная и т.д.
Гидрксикислоты могут быть названы как гидроксипроизводные карбоновых кислот. Положение гидроксила относительно карбоксила указывается греческими буквами α, β, γ и т.д.
Названия гидроксикислот по номенклатуре ИЮПАК происходят от названий соответствующих карбоновых кислот с добавлением приставки гидрокси-, указывающей на гидроксил. Нумерация начинается с карбоксильной группы.
Изомерия гидроксикислот определяется изомерией углеродного скелета, числом и взаимным расположением групп –ОН и –СООН.
|
|
угольная, гидроксимуравьиная, гидроксиметановая |
|
|
гликолевая, гидроксиуксусная, гидроксиэтановая |
|
|
молочная, α-гидроксипропионовая, 2-гидроксипропановая |
|
|
гидракриловая, β-гидроксипропио-новая, 3-гидроксипропановая |
|
|
α-гидроксимасляная, 2-гидроксибутановая |
|
|
β-гидроксиизомасляная, 2-метил-3-гидроксипропановая |
|
|
яблочная, гидроксиянтарная, |
|
|
винные, дигидроксиянтарная
|
|
|
лимонная, 3-гидрокси-3-карбоксипентандиовая |
|
|
изолимонная, 2-гидрокси-3-карбоксипентандиовая |
Способы получения
Способы получения рассмотрим на примере одноосновных двухатомных гидроксикислот.
– Гидролиз галогензамещённых кислот

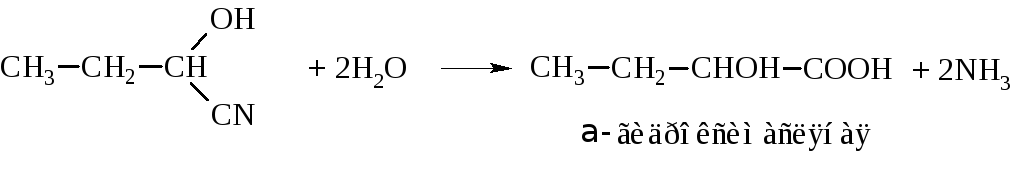
– α-Гидроксикислоты получают гидролизом оксинитрилов
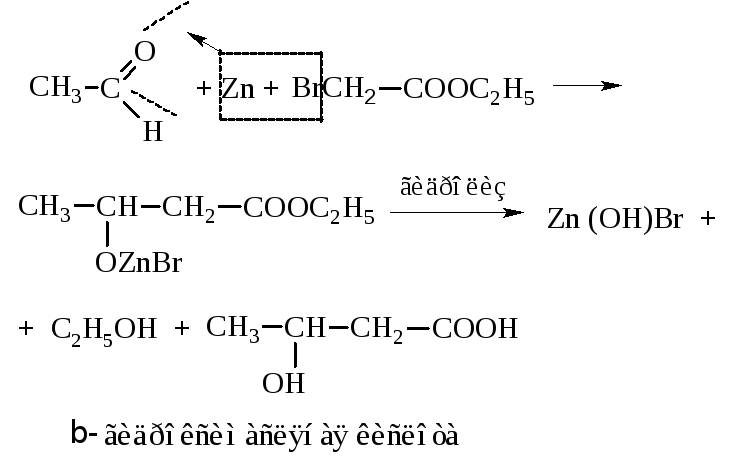
– β-Гидроксикислоты чаще всего получают по реакции Реформатского. Реакция заключается в действии цинка на смесь эфира галогензамещённой кислоты и альдегида или кетона с промежуточным образованием алкоголята эфира β-гидроксикислоты:
Гидрксикислоты могут быть получены также окислением гидроксиальдегидов и гликолей, присоединением воды к ненасыщеным кислотам и другими методами.
Физические свойства
Низшие гидроксикислоты – жидкие вещества, хорошо растворимые в воде. Остальные гидроксикислоты при комнатных условиях кристаллические вещества. Растворимость их в воде несколько лучше, чем у соответствующих карбоновых кислот.
Химические свойства
Присутствие в молекулах гидроксикислот двух функциональных групп обуславливает их реакции как спиртов и кислот. Естественно, взаимное влияние гидроксила и карбоксила накладывает отпечаток на их свойства. Особенно ярко это влияние проявляется когда обе группы находятся по соседству, т.е. в α-гидроксикислотах.
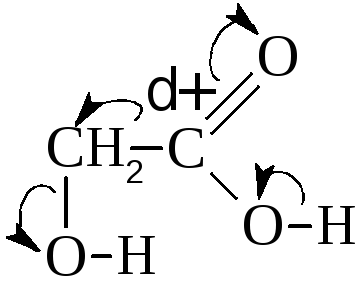
Дополнительный сдвиг электронной плотности в сторону гидроксила значительно увеличивает силу кислоты по сравнению с кислотами жирного ряда с тем же числом углеродных атомов. Например, константа диссоциации. гликолевой кислоты (СН2ОН–СООН – 1,76·10-5) в 8,5 раз больше, чем уксусной (СН3–СООН 1,48·10-4).
Вступление в реакцию спиртового или кислотного гидроксила определяется условиями реакции и природой реагента. Действие галогеноводородных кислот приводит к замещению спиртового гидроксила. Под действием пятихлористого фосфора реагируют оба гидроксила одновременно (спиртовой и кислотный). Со щелочами в первую очередь образуются соли кислот, а затем уже алкоголяты. Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, могут замещать гидроксил на другие группы. Как кислоты они дают соли, сложные эфиры, амиды и т.д.
Рассмотрим некоторые особые реакции, протекание которых возможно только благодаря одновременному присутствию в молекуле гидроксильной и карбоксильной групп.
– α-Гидроксикислоты легко восстанавливаются в карбоновые кислоты

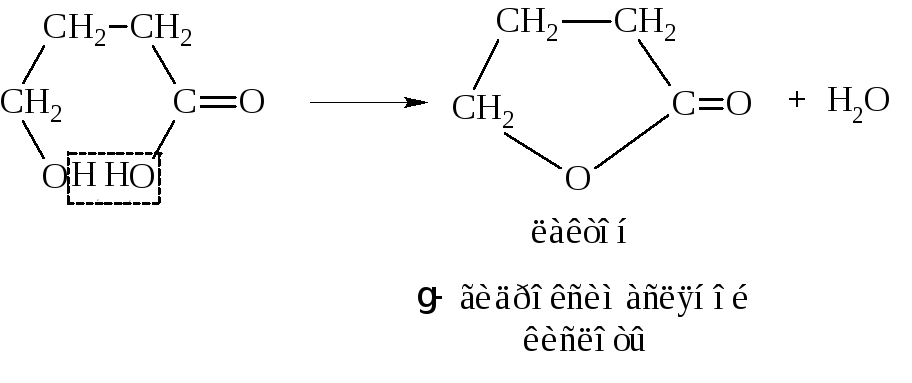
– Гидроксикислоты более или менее легко отщепляют воду при нагревании, причём в зависимости от положения гидроксила образуются совершенно различные продукты.
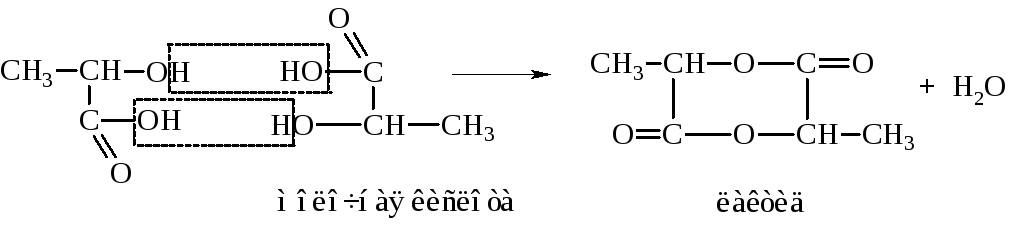
α-Гидроксикислоты при нагревании легко отщепляют воду с образованием циклических сложных эфиров – лактидов. При этом гидроксильные и карбоксильные группы двух молекул взаимно этерифицируются
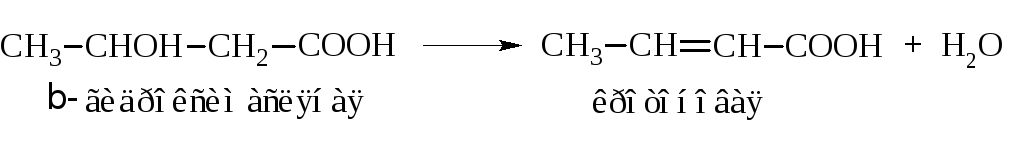
β-Гидроксикислоты при нагревании отщепляют воду и дают ненасыщенные кислоты
В γ- и δ-гидроксикислотах, а также в гидроксикислотах с более удаленным расположением гидроксила благодаря внутреннему вращению в достаточно длинной углеродной цепочке возможно пространственное сближение групп –ОН спирта и карбоксила. При дегидратации они образуют внутренние циклические сложные эфиры – лактоны.