
- •Эксплуатация компрессорных станций магистральных газопроводов введение
- •Глава 1 характеристики природных газов
- •1.1. Исходные понятия и определения
- •Теплоемкость газов
- •Массовая теплоемкость некоторых газов при постоянном (атмосферном) давлении в кДж/ (кг · °с)
- •Смеси газов
- •Физические характеристики компонентов природного газа
- •Теплота сгорания газов
- •Низшая теплота сгорания некоторых компонентов природного газа
- •Пределы взрываемости газовоздушных смесей
- •Пределы и интервал взрываемости газов в смеси с воздухом при температуре 20 °с и давлении 0,1 мПа
- •1.2. Законы идеальных газов. Области их применения
- •Критические параметры некоторых веществ
- •1.3. Технологические характеристики природных газов и их компонентов
- •1.4. Термодинамическое обеспечение решения энерготехнологических задач трубопроводного транспорта природных газов
- •Значение коэффициента Джоуля-Томсона () для метана в зависимости от температуры и давления
- •Значения параметров природного газа с содержанием метана 97% в зависимости от температуры при среднем давлении 5 мПа
- •Глава 2 назначение и устройство компрессорных станций
- •2.1. Особенности дальнего транспорта природных газов
- •2.2. Назначение и описание компрессорной станции
- •2.3. Системы очистки технологического газа на кс
- •2.4. Технологические схемы компрессорных станций
- •2.5. Назначение запорной арматуры в технологических обвязках кс
- •2.6. Схемы технологической обвязки центробежного нагнетателя кс
- •2.7. Конструкции и назначения опор, люк-лазов и защитных решеток в обвязке гпа
- •2.8. Системы охлаждения транспортируемого газа на компрессорных станциях
- •2.9. Компоновка газоперекачивающих агрегатов на станции
- •2.10. Система импульсного газа
- •2.11. Система топливного и пускового газа на станции
- •2.12. Система маслоснабжения кс и гпа, маслоочистительные машины и аппараты воздушного охлаждения масла
- •2.13. Типы газоперекачивающих агрегатов, применяемых на кс
- •Уральский турбомоторный завод (узтм), г. Екатеринбург
- •Невский завод им. Ленина (нзл), г.Санкт-Петербург
- •Первый Бриенский завод (Чехия), г.Брно
- •Показатели злектроприводных агрегатов
- •Показатели газомотокомпрессоров
- •Структура парка гпа в системе оао "Газпром"
- •Показатели перспективных газотурбинных установок нового поколения
- •2.14. Нагнетатели природного газа. Их характеристики
- •2.34. Неполнонапорный одноступенчатый нагнетатель 370-18 агрегата гтк-10-4 производства нзл:
- •Характеристики центробежных нагнетателей для транспорта природных газов
- •2.15. Электроснабжение кс Электроснабжение газотурбинных кс и гпа
- •Электроснабжение гпа
- •Электроснабжение электроприводной кс
- •Резервные аварийные электростанции
- •Система питания постоянным током автоматики и аварийных насосов смазки гпа, автоматики зру-10 кВ, аварийного освещения
- •2.16. Водоснабжение и канализация кс
- •Теплоснабжение кс
- •2.17. Организация связи на компрессорных станциях
- •2.18. Электрохимзащита компрессорной станции
- •2.19. Грозозащита компрессорной станции
- •Глава 3 эксплуатация газоперекачивающих агрегатов с газотурбинным приводом
- •3.1. Организация эксплуатации цехов с газотурбинным приводом
- •3.2. Схемы и принцип работы газотурбинных установок
- •3.3. Подготовка гпа к пуску
- •3.4. Проверка защиты и сигнализации гпа
- •Защита по давлению масла смазки
- •Защита по погасанию факела
- •Защита по осевому сдвигу роторов
- •Защита по перепаду между маслом уплотнения и газом в полости нагнетателя (защита "масло-газ")
- •Защита от превышения температуры газа
- •Защита по превышению частоты вращения роторов твд, тнд и турбодетандера
- •Защита по температуре подшипников
- •Система защиты от вибрации
- •3.5. Пуск гпа и его загрузка
- •3.6. Обслуживание агрегата и систем кс в процессе работы
- •3.7. Подготовка циклового воздуха для гту
- •3.8. Очистка осевого компрессора в процессе эксплуатации
- •3.9. Устройство для подогрева всасывающего циклового воздуха. Антиобледенительная система
- •3.10. Противопомпажная защита цбн
- •1’’’ - Режим работы нагнетателя с малыми возмущениями. I - линия контроля помпажа;
- •3.11. Работа компрессорной станции при приеме и запуске очистных устройств
- •3.12. Особенности эксплуатации гпа при отрицательных температурах
- •3.13. Система пожаротушения гпа и ее эксплуатация
- •3.14. Вибрация, виброзащита и вибромониторинг гпа
- •3.15. Нормальная и аварийная остановка агрегатов
- •3.16. Остановка компрессорной станции ключом аварийной остановки станции (каос)
- •Глава 4 эксплуатация газоперекачивающих агрегатов с электроприводом
- •4.1. Характеристика приводов, основные типы эгпа и их устройство
- •Техническая характеристика гпа с электроприводом
- •4.2. Системы избыточного давления и охлаждения статора и ротора электродвигателя
- •4.3. Системы масло-смазки и масло-уплотнения эгпа, их отличие от систем гту
- •4.4. Редукторы - мультипликаторы, применяемые на электроприводных гпа
- •4.5. Особенности подготовки к пуску и пуск гпа
- •4.6. Обслуживание эгпа во время работы
- •4.7. Регулирование режима работы гпа с электроприводом
- •4.8. Применение на кс электроприводных гпа с регулируемой частотой вращения
- •4.9. Эксплуатация вспомогательного оборудования и систем компрессорного цеха
- •4.10. Совместная работа электроприводного и газотурбинного компрессорных цехов
- •Глава 1. Характеристики природных газов
- •Глава 2. Назначение и устройство компрессорных станций
- •Глава 3. Эксплуатация газоперекачивающих агрегатов с газотурбинным приводом
- •Глава 4. Эксплуатация газоперекачивающих агрегатов с электроприводом
Пределы взрываемости газовоздушных смесей
Исключение образования взрывоопасных газовоздушных концентраций, а также появление источников воспламенения этой смеси (пламени, искр) всегда является основной задачей обслуживающего персонала компрессорных станций. При взрыве газовоздушной смеси резко повышается давление в зоне взрыва, приводящее к разрушению строительных конструкций, а скорость распространения пламени достигает сотни метров в секунду. Например, температура самовоспламенения метановоздушной смеси находится на уровне 700 °С, а метан является основным компонентом природного газа. Его содержание в газовых месторождениях колеблется в диапазоне 92-98%.
При взрыве газовоздушной смеси, находящейся под давлением 0,1 МПа, развивается давление около 0,80 МПа. Газовоздушная смесь взрывается, если в ней содержится 5-15 % метана; 2-10 % пропана; 2-9 % бутана и т.д. При повышении давления газовоздушной смеси пределы взрываемости сужаются. Следует отметить, что примесь кислорода в газе увеличивает опасность взрыва.
Пределы и интервал взрываемости газов в смеси с воздухом при температуре 20 °С и давлении 0,1 МПа приведены в табл. 1.4.
Таблица 1.4
Пределы и интервал взрываемости газов в смеси с воздухом при температуре 20 °с и давлении 0,1 мПа
|
#G0Газ |
Пределы взрываемости, % по объему |
Интервал взрываемости, % по объему | |
|
|
нижний |
верхний |
|
|
Ацетилен |
2,3 |
82,0 |
79,7 |
|
Бутан |
1,5 |
8,5 |
7,0 |
|
Бутилен |
1,7 |
9,0 |
7,3 |
|
Водород |
4,0 |
75,0 |
71,0 |
|
Метан |
5,0 |
15,0 |
10,0 |
|
Нефтепромысл. газ |
4,0 |
14,0 |
10,0 |
|
Оксид углерода |
12,5 |
75,0 |
62,5 |
|
Природный газ |
5,0 |
15,0 |
10,0 |
|
Пропан |
2,0 |
9,5 |
7,5 |
|
Пропилен |
2,2 |
9,7 |
7,5 |
|
Этан |
3,0 |
14,0 |
11,0 |
|
Этилен |
3,0 |
33,3 |
30,3 |
1.2. Законы идеальных газов. Области их применения
Идеальными газами принято считать газы,
подчиняющиеся уравнению Клапейрона
(![]() ).
Одновременно под идеальными подразумеваются
газы, в которых отсутствуют силы
межмолекулярного взаимодействия, а
объем самих молекул равен нулю. В
настоящее время можно утверждать, что
ни один из реальных газов не подчиняется
этим газовым законам. Тем не менее эти
специфические газовые законы достаточно
широко используются в технических
расчетах. Эти законы просты и достаточно
хорошо характеризуют поведение реальных
газов при невысоких давлениях и не очень
низких температурах, вдали от областей
насыщения и критических точек вещества.
Наибольшее практическое распространение
получили законы Бойля-Мариотта,
Гей-Люссака, Авогадро и на их основе
полученное уравнение Клапейрона-Менделеева.
).
Одновременно под идеальными подразумеваются
газы, в которых отсутствуют силы
межмолекулярного взаимодействия, а
объем самих молекул равен нулю. В
настоящее время можно утверждать, что
ни один из реальных газов не подчиняется
этим газовым законам. Тем не менее эти
специфические газовые законы достаточно
широко используются в технических
расчетах. Эти законы просты и достаточно
хорошо характеризуют поведение реальных
газов при невысоких давлениях и не очень
низких температурах, вдали от областей
насыщения и критических точек вещества.
Наибольшее практическое распространение
получили законы Бойля-Мариотта,
Гей-Люссака, Авогадро и на их основе
полученное уравнение Клапейрона-Менделеева.
Закон Бойля-Мариотга утверждает, что
при постоянной температуре (![]() =
const) произведение абсолютного давления
и удельного объема идеального газа
сохраняет постоянную величину (
=
const) произведение абсолютного давления
и удельного объема идеального газа
сохраняет постоянную величину (![]() = const), т.е. произведение абсолютного
давления и удельного объема зависит
только от температуры. Откуда при
= const), т.е. произведение абсолютного
давления и удельного объема зависит
только от температуры. Откуда при
![]() =
const имеем:
=
const имеем:
![]() .
(1.27)
.
(1.27)
Закон Гей-Люссака утверждает, что при
постоянном давлении (![]() =
const) объем идеального газа изменяется
прямо пропорционально повышению
температуры:
=
const) объем идеального газа изменяется
прямо пропорционально повышению
температуры:
![]() ,
(1.28)
,
(1.28)
где
![]() - удельный объем газа при температуре
- удельный объем газа при температуре
![]() °С
и давлении
°С
и давлении
![]() -
удельный объем газа при температуре
-
удельный объем газа при температуре
![]() =
0 °С и том же давлении
=
0 °С и том же давлении
![]() ;
;
![]() - температурный коэффициент объемного
расширения идеальных газов при 0 °С,
сохраняющий одно и то же значение при
всех давлениях и одинаковый для всех
идеальных газов:
- температурный коэффициент объемного
расширения идеальных газов при 0 °С,
сохраняющий одно и то же значение при
всех давлениях и одинаковый для всех
идеальных газов:
![]() .
(1.29)
.
(1.29)
Таким образом, содержание закона
Гей-Люссака сводится к следующему
утверждению: объемное расширение
идеальных газов при изменении температуры
и при
![]() =
const имеет линейный характер, а температурный
коэффициент объемного расширения
=
const имеет линейный характер, а температурный
коэффициент объемного расширения
![]() является универсальной постоянной
идеальных газов.
является универсальной постоянной
идеальных газов.
Сопоставление законов Бойля-Мариотта и Гей-Люссака приводит к уравнению состояния идеальных газов:
![]() ,
(1.30)
,
(1.30)
где
![]() - удельный объем газа;
- удельный объем газа;
![]() - абсолютное давление газа;
- абсолютное давление газа;
![]() - удельная газовая постоянная идеального
газа;
- удельная газовая постоянная идеального
газа;
![]() -
абсолютная температура идеального
газа:
-
абсолютная температура идеального
газа:
![]() .
(1.31)
.
(1.31)
Физический смысл удельной газовой
постоянной
![]() - это удельная работа в процессе
- это удельная работа в процессе
![]() =
const при изменении температуры на один
градус.
=
const при изменении температуры на один
градус.
Закон Авогадро утверждает, что объем
одного моля идеального газа
![]() не зависит от природы газа и вполне
определяется давлением и температурой
вещества (
не зависит от природы газа и вполне
определяется давлением и температурой
вещества (![]() ).
На этом основании утверждается, что
объемы молей разных газов, взятых при
одинаковых давлениях и температурах,
равны между собой. Если
).
На этом основании утверждается, что
объемы молей разных газов, взятых при
одинаковых давлениях и температурах,
равны между собой. Если
![]() - удельный объем газа, а
- удельный объем газа, а
![]() - мольная масса, то объем моля (мольный
объем) равен
- мольная масса, то объем моля (мольный
объем) равен
![]() .
При равных давлениях и температурах
для разных газов имеем:
.
При равных давлениях и температурах
для разных газов имеем:
![]() .
(1.32)
.
(1.32)
Так как удельный мольный объем газа
![]() зависит в общем случае только от давления
и температуры, то произведение
зависит в общем случае только от давления
и температуры, то произведение
![]() в уравнении (1.32) - есть величина одинаковая
для всех газов и поэтому называется
универсальной газовой постоянной:
в уравнении (1.32) - есть величина одинаковая
для всех газов и поэтому называется
универсальной газовой постоянной:
![]() ,
Дж/кмоль·К. (1.33)
,
Дж/кмоль·К. (1.33)
Из уравнения (1.33) следует, что удельные
газовые постоянные отдельных газов
![]() определяются через их мольные массы.
Например, для азота (
определяются через их мольные массы.
Например, для азота (![]() )
удельная газовая постоянная будет
)
удельная газовая постоянная будет
![]() = 8314/28 = 297 Дж/(кг·К). (1.34)
= 8314/28 = 297 Дж/(кг·К). (1.34)
Для
![]() кг газа с учетом того, что
кг газа с учетом того, что
![]() ,
уравнение Клапейрона записывается в
виде:
,
уравнение Клапейрона записывается в
виде:
![]() ,
(1.35)
,
(1.35)
где
![]() - количество вещества в молях
- количество вещества в молях
![]() .
Для 1 кмоля газа:
.
Для 1 кмоля газа:
![]() .
(1.36)
.
(1.36)
Последнее уравнение, полученное русским ученым Д.И. Менделеевым, часто называют уравнением Клапейрона-Менделеева.
Значение мольного объема идеальных
газов в нормальных физических условиях
(![]() = 0 °С и
= 0 °С и
![]() = 101,1 кПа) составит:
= 101,1 кПа) составит:
![]() =
22,4 м
=
22,4 м![]() /кмоль.
(1.37)
/кмоль.
(1.37)
Уравнение состояния реальных газов
часто записывают на основе уравнения
Клапейрона с введением в него поправки
![]() ,
учитывающей отклонение реального газа
от идеального
,
учитывающей отклонение реального газа
от идеального
![]() ,
(1.38)
,
(1.38)
где
![]() - коэффициент сжимаемости, определяемый
по специальным номограммам или из
соответствующих таблиц. На рис. 1.1
приведена номограмма для определения
численных значений величины
- коэффициент сжимаемости, определяемый
по специальным номограммам или из
соответствующих таблиц. На рис. 1.1
приведена номограмма для определения
численных значений величины
![]() природного газа в зависимости от давления
природного газа в зависимости от давления
![]() ,
относительной плотности газа по воздуху
,
относительной плотности газа по воздуху
![]() и его температуры
и его температуры
![]() .
В научной литературе коэффициент
сжимаемости
.
В научной литературе коэффициент
сжимаемости
![]() обычно определяется в зависимости от
так называемых приведенных параметров
(давление и температура) газа:
обычно определяется в зависимости от
так называемых приведенных параметров
(давление и температура) газа:
![]() ;
;
![]() ,
(1.39)
,
(1.39)
где
![]() ,
,
![]() и
и
![]() - соответственно приведенное, абсолютное
и критическое давление газа;
- соответственно приведенное, абсолютное
и критическое давление газа;
![]() ,
,
![]() и
и
![]() - соответственно приведенная, абсолютная
и критическая температура газа.
- соответственно приведенная, абсолютная
и критическая температура газа.
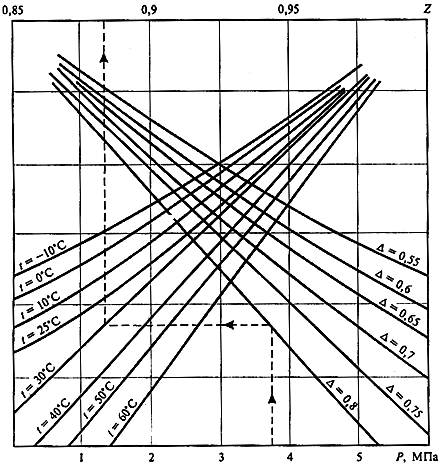
Рис. 1.1. Номограмма расчёта
![]() в зависимости от
в зависимости от
![]() ,
,
![]() ,
,
![]()
Критическим давлением называется такое давление, при котором и выше которого никаким повышением температуры жидкость уже не может быть превращена в пар.
Критической температурой называется такая температура, при которой и выше которой ни при каком повышении давления нельзя сконденсировать пар.
Численные значения критических параметров для некоторых газов приведены в табл. 1.5.
Таблица 1.5
