
- •Эксплуатация компрессорных станций магистральных газопроводов введение
- •Глава 1 характеристики природных газов
- •1.1. Исходные понятия и определения
- •Теплоемкость газов
- •Массовая теплоемкость некоторых газов при постоянном (атмосферном) давлении в кДж/ (кг · °с)
- •Смеси газов
- •Физические характеристики компонентов природного газа
- •Теплота сгорания газов
- •Низшая теплота сгорания некоторых компонентов природного газа
- •Пределы взрываемости газовоздушных смесей
- •Пределы и интервал взрываемости газов в смеси с воздухом при температуре 20 °с и давлении 0,1 мПа
- •1.2. Законы идеальных газов. Области их применения
- •Критические параметры некоторых веществ
- •1.3. Технологические характеристики природных газов и их компонентов
- •1.4. Термодинамическое обеспечение решения энерготехнологических задач трубопроводного транспорта природных газов
- •Значение коэффициента Джоуля-Томсона () для метана в зависимости от температуры и давления
- •Значения параметров природного газа с содержанием метана 97% в зависимости от температуры при среднем давлении 5 мПа
- •Глава 2 назначение и устройство компрессорных станций
- •2.1. Особенности дальнего транспорта природных газов
- •2.2. Назначение и описание компрессорной станции
- •2.3. Системы очистки технологического газа на кс
- •2.4. Технологические схемы компрессорных станций
- •2.5. Назначение запорной арматуры в технологических обвязках кс
- •2.6. Схемы технологической обвязки центробежного нагнетателя кс
- •2.7. Конструкции и назначения опор, люк-лазов и защитных решеток в обвязке гпа
- •2.8. Системы охлаждения транспортируемого газа на компрессорных станциях
- •2.9. Компоновка газоперекачивающих агрегатов на станции
- •2.10. Система импульсного газа
- •2.11. Система топливного и пускового газа на станции
- •2.12. Система маслоснабжения кс и гпа, маслоочистительные машины и аппараты воздушного охлаждения масла
- •2.13. Типы газоперекачивающих агрегатов, применяемых на кс
- •Уральский турбомоторный завод (узтм), г. Екатеринбург
- •Невский завод им. Ленина (нзл), г.Санкт-Петербург
- •Первый Бриенский завод (Чехия), г.Брно
- •Показатели злектроприводных агрегатов
- •Показатели газомотокомпрессоров
- •Структура парка гпа в системе оао "Газпром"
- •Показатели перспективных газотурбинных установок нового поколения
- •2.14. Нагнетатели природного газа. Их характеристики
- •2.34. Неполнонапорный одноступенчатый нагнетатель 370-18 агрегата гтк-10-4 производства нзл:
- •Характеристики центробежных нагнетателей для транспорта природных газов
- •2.15. Электроснабжение кс Электроснабжение газотурбинных кс и гпа
- •Электроснабжение гпа
- •Электроснабжение электроприводной кс
- •Резервные аварийные электростанции
- •Система питания постоянным током автоматики и аварийных насосов смазки гпа, автоматики зру-10 кВ, аварийного освещения
- •2.16. Водоснабжение и канализация кс
- •Теплоснабжение кс
- •2.17. Организация связи на компрессорных станциях
- •2.18. Электрохимзащита компрессорной станции
- •2.19. Грозозащита компрессорной станции
- •Глава 3 эксплуатация газоперекачивающих агрегатов с газотурбинным приводом
- •3.1. Организация эксплуатации цехов с газотурбинным приводом
- •3.2. Схемы и принцип работы газотурбинных установок
- •3.3. Подготовка гпа к пуску
- •3.4. Проверка защиты и сигнализации гпа
- •Защита по давлению масла смазки
- •Защита по погасанию факела
- •Защита по осевому сдвигу роторов
- •Защита по перепаду между маслом уплотнения и газом в полости нагнетателя (защита "масло-газ")
- •Защита от превышения температуры газа
- •Защита по превышению частоты вращения роторов твд, тнд и турбодетандера
- •Защита по температуре подшипников
- •Система защиты от вибрации
- •3.5. Пуск гпа и его загрузка
- •3.6. Обслуживание агрегата и систем кс в процессе работы
- •3.7. Подготовка циклового воздуха для гту
- •3.8. Очистка осевого компрессора в процессе эксплуатации
- •3.9. Устройство для подогрева всасывающего циклового воздуха. Антиобледенительная система
- •3.10. Противопомпажная защита цбн
- •1’’’ - Режим работы нагнетателя с малыми возмущениями. I - линия контроля помпажа;
- •3.11. Работа компрессорной станции при приеме и запуске очистных устройств
- •3.12. Особенности эксплуатации гпа при отрицательных температурах
- •3.13. Система пожаротушения гпа и ее эксплуатация
- •3.14. Вибрация, виброзащита и вибромониторинг гпа
- •3.15. Нормальная и аварийная остановка агрегатов
- •3.16. Остановка компрессорной станции ключом аварийной остановки станции (каос)
- •Глава 4 эксплуатация газоперекачивающих агрегатов с электроприводом
- •4.1. Характеристика приводов, основные типы эгпа и их устройство
- •Техническая характеристика гпа с электроприводом
- •4.2. Системы избыточного давления и охлаждения статора и ротора электродвигателя
- •4.3. Системы масло-смазки и масло-уплотнения эгпа, их отличие от систем гту
- •4.4. Редукторы - мультипликаторы, применяемые на электроприводных гпа
- •4.5. Особенности подготовки к пуску и пуск гпа
- •4.6. Обслуживание эгпа во время работы
- •4.7. Регулирование режима работы гпа с электроприводом
- •4.8. Применение на кс электроприводных гпа с регулируемой частотой вращения
- •4.9. Эксплуатация вспомогательного оборудования и систем компрессорного цеха
- •4.10. Совместная работа электроприводного и газотурбинного компрессорных цехов
- •Глава 1. Характеристики природных газов
- •Глава 2. Назначение и устройство компрессорных станций
- •Глава 3. Эксплуатация газоперекачивающих агрегатов с газотурбинным приводом
- •Глава 4. Эксплуатация газоперекачивающих агрегатов с электроприводом
Смеси газов
Природные газы представляют собой
смесь, состоящую из нескольких чистых
веществ, химически не взаимодействующих
между собой: метана СН![]() ,
этана С
,
этана С![]() Н
Н![]() ,
пропана С
,
пропана С![]() Н
Н![]() ,
бутана С
,
бутана С![]() Н
Н![]() и других углеводородов. Поэтому одной
из важнейших характеристик смеси
является ее состав. Состав смеси обычно
определяется посредством нахождения
массовой или мольной концентрации
компонентов, входящих в смесь. Понятие
"моль", как отмечалось выше, означает
количество вещества в граммах, численно
равное его мольной массе, а киломоль -
количество вещества в килограммах, тоже
численно равное его мольной массе. Так,
например, киломоль кислорода О
и других углеводородов. Поэтому одной
из важнейших характеристик смеси
является ее состав. Состав смеси обычно
определяется посредством нахождения
массовой или мольной концентрации
компонентов, входящих в смесь. Понятие
"моль", как отмечалось выше, означает
количество вещества в граммах, численно
равное его мольной массе, а киломоль -
количество вещества в килограммах, тоже
численно равное его мольной массе. Так,
например, киломоль кислорода О![]() равен 32 кг, киломоль метана СН
равен 32 кг, киломоль метана СН![]() - 16,04 кг и т.д. Физические характеристики
компонентов природного газа приведены
в табл. 1.2.
- 16,04 кг и т.д. Физические характеристики
компонентов природного газа приведены
в табл. 1.2.
Массовой концентрацией
![]() -го
компонента называется отношение массы
данного компонента
-го
компонента называется отношение массы
данного компонента
![]() к массе всей смеси
к массе всей смеси
![]() :
:
Таблица 1.2
Физические характеристики компонентов природного газа
|
#G0Компонент состава газа |
Формула |
Мольная масса |
Плотность,
кг/м |
Плотность по отношению к воздуху |
Температура сжижения, °С |
|
Метан |
СН |
16,04 |
0,72 |
0,55 |
-161,5 |
|
Этан |
С |
30,07 |
1,36 |
1,05 |
-89 |
|
Пропан |
С |
44,09 |
2,02 |
1,55 |
-42 |
|
Бутан |
С |
58,12 |
2,70 |
2,08 |
-1 |
|
Пентан |
С |
72,15 |
3,22 |
2,50 |
+36 |
|
Гексан |
С |
86,18 |
- |
3,00 |
+68 |
|
Этилен |
С |
28,05 |
1,26 |
0,98 |
-104 |
|
Пропен |
С |
42,08 |
1,92 |
1,48 |
-48 |
|
Бутен |
С |
56,10 |
2,60 |
2,00 |
-6 |
|
Пентен |
С |
70,13 |
3,13 |
- |
- |
|
Ацетилен |
С |
26,04 |
1,17 |
0,31 |
-84 |
|
Бензол |
С |
78,11 |
3,48 |
- |
- |
|
Оксид углер.
|
СО |
28,01 |
1,25 |
0,97 |
-192 |
|
Углекис.газ |
СО |
44,01 |
1,98 |
1,53 |
-78 |
|
Сероводород |
H |
34,08 |
1,54 |
1,19 |
+46 |
|
Азот |
N |
28,02 |
1,25 |
0,97 |
-196 |
|
Кислород |
O |
32,0 |
1,43 |
1,10 |
-186 |
|
Водород |
Н |
2,02 |
0,09 |
0,07 |
-253 |
|
Водяной пар |
Н |
18,02 |
0,77 |
0,59 |
+100 |
![]() ,
(1.17)
,
(1.17)
![]() .
(1.18)
.
(1.18)
Сумма всех массовых концентраций компонентов, составляющих смесь, равна единице:
![]() .
(1.19)
.
(1.19)
Соответственно определяется изобарная теплоемкость смеси газов:
![]() ,
(1.20)
,
(1.20)
где
![]() - массовая доля i-го компонента смеси;
- массовая доля i-го компонента смеси;
![]() - изобарная теплоемкость i-го компонента;
- изобарная теплоемкость i-го компонента;
![]() - число компонентов в смеси.
- число компонентов в смеси.
Мольной концентрацией
![]() -го
компонента называется отношение числа
киломолей данного компонента
-го
компонента называется отношение числа
киломолей данного компонента
![]() к общему числу киломолей
к общему числу киломолей
![]() :
:
![]() ,
(1.21)
,
(1.21)
![]() .
(1.22)
.
(1.22)
Сумма всех мольных концентраций компонентов, составляющих смесь, равна единице:
![]() .
(1.23)
.
(1.23)
Отношение массы данного компонента
![]() к количеству молей этого компонента
к количеству молей этого компонента
![]() характеризует его мольную массу
характеризует его мольную массу
![]() ,
а отношение массы всей смеси
,
а отношение массы всей смеси
![]() к количеству молей смеси характеризует
мольную массу смеси
к количеству молей смеси характеризует
мольную массу смеси
![]() :
:
![]() ;
;
![]() .
(1.24)
.
(1.24)
С учетом вышеприведенных соотношений средняя мольная масса смеси определяется соотношением:
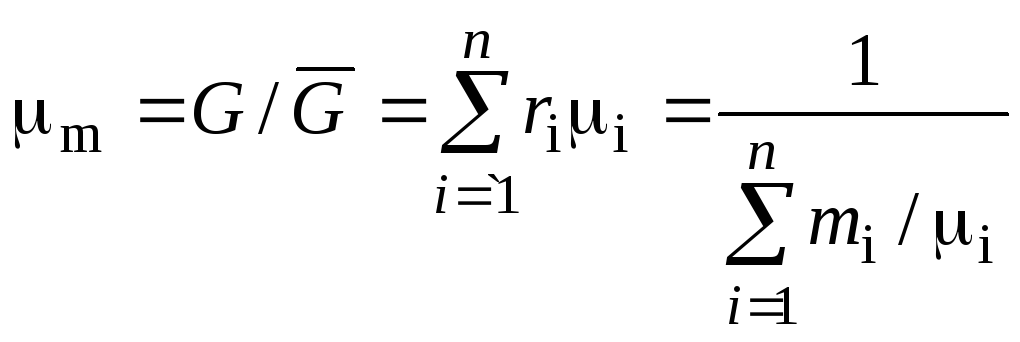 .
(1.25)
.
(1.25)
Мольные концентрации компонентов смеси
идеального газа численно равны его
объемным концентрациям, которые
определяются как отношение объема
данного компонента
![]() при давлении и температуре смеси к
объему всей смеси
при давлении и температуре смеси к
объему всей смеси
![]() .
В силу этого объемные концентрации
компонентов смеси газов в ряде случаев
определяют и через соотношение давлений:
.
В силу этого объемные концентрации
компонентов смеси газов в ряде случаев
определяют и через соотношение давлений:
![]() ,
(1.26)
,
(1.26)
где
![]() - парциальное давление компонента газа;
- парциальное давление компонента газа;
![]() -давление
смеси в целом.
-давление
смеси в целом.
Состав природного газа обычно регулярно определяется на газопроводах соответствующими лабораториями с использованием хроматографического анализа.
Пример 1.1. Определить мольные концентрации
компонентов природного газа и его
среднюю мольную массу при следующем
объемном составе компонентов газа:
метана СН![]() = 94%, этана С
= 94%, этана С![]() Н
Н![]() = 3%, пропана С
= 3%, пропана С![]() Н
Н![]() =
1,5%, бутана С
=
1,5%, бутана С![]() Н
Н![]() =
0,5%, углекислого газа СО
=
0,5%, углекислого газа СО![]() =
1,0%.
=
1,0%.
Решение. Мольные концентрации компонентов по уравнению (1.21):
![]() =
0,94;
=
0,94;
![]() = 0,03;
= 0,03;
![]() =
0,015;
=
0,015;
![]() = 0,005;
= 0,005;
![]() = 0,01. По уравнению (1.25) с учетом численных
значений мольных масс компонентов
получим:
= 0,01. По уравнению (1.25) с учетом численных
значений мольных масс компонентов
получим:
![]() =
0,94·16,04+0,03·30,07+0,015·44,09+0,01·58,12 = 17,37 кг/кмоль.
=
0,94·16,04+0,03·30,07+0,015·44,09+0,01·58,12 = 17,37 кг/кмоль.
