
Слепнева - FIZIKOKhIMIYa_POLIMEROV_1
.pdf
Министерство образования Республики Беларусь БЕЛОРУССКИЙ НАЦИОНАЛЬНЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра «Химия»
|
|
|
|
|
|
|
|
|
|
|
|
У |
|
|
|
|
|
|
|
|
|
|
|
Т |
|
|
|
|
|
|
|
Л.М. Слепнёва |
|
Н |
|
|||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
и |
Б |
|
|
|
|
|
|
ФИЗИКОХИМИЯ ПОЛИМЕРОВ |
|
|
|
||||||
|
|
|
|
|
|
|
пр |
|
|
|
|
|
|
|
|
|
|
|
|
Пособ е й |
|
|
|
||
|
|
по дисциплине «Физ кох м я полимеров» |
|
|
||||||||
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
для студентов направления специальности 1-36 20 02-01 |
|||||||||||
|
|
|
|
|
т |
|
|
|
|
|
|
|
«Упаковочное производство ( ектирование и дизайн упаковки)» |
||||||||||||
|
|
|
|
за чн й ф рмы обучения |
|
|
|
|||||
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
Минск
БНТУ
2011
1
УДК 678.01:544.16 (075.8)
ББК 24.7я7
|
С 47 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рецензенты: |
|
|
|
|||
|
|
|
|
Е.И. Плюгачёва, И.И. Карпунин |
|
У |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Слепнёва, Л.М. |
|
|
|
|
|
|
Т |
||||
С 47 |
Физикохимия полимеров: пособие по дисциплине «Физикохимия |
|||||||||||
|
полимеров» для студентов направления специальности 1-36 20 02-01 |
|||||||||||
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
«Упаковочное производство (проектирование и дизайн упаковки)» за- |
|||||||||||
|
очной формы обучения / Л.М. Слепнёва. – Минск: БНТУ, 2011. – 136 с. |
|||||||||||
|
ISBN 978-985-525-371-7. |
|
|
|
Б |
|
|
|||||
|
|
|
|
|
|
|
|
|
й |
|
|
|
|
Пособие предназначено для студентов направления специальности |
|||||||||||
|
1-36 20 02-01 «Упаковочное производство (проектирование и дизайн |
|||||||||||
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
упаковки)» заочной формы обучения факультета технологий управ- |
|||||||||||
|
ления и гуманитаризации БНТУ, обучающ хся по программе «Физи- |
|||||||||||
|
кохимия полимеров». |
|
р |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||
|
Пособие может быть использовано студентами для более глубоко- |
|||||||||||
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
го изучения химии полимеров в учебном курсе органической химии, а |
|||||||||||
|
также всеми, кто интересуется химией и физикой полимеров. |
|
|
|||||||||
|
|
|
|
|
т |
|
|
|
УДК 678.01:544.16 (075.8) |
|||
|
|
|
|
и |
|
|
|
|
ББК 24.7я7 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
ISBN 978-985-525-371-7 |
|
|
|
|
Слепнёва Л.М., 2011 |
|||||||
|
|
|
|
|
|
|
|
|
|
БНТУ, 2011 |
|
|
2
|
|
|
|
|
Содержание |
|
|
|
|
|||
В в е д е н и е. . . |
. . . . |
. . . |
. . |
. . |
. . . . |
. . . . |
. . . . . |
. . . . . |
. . . . . |
. . . . |
. . 4 |
|
Тема 1. |
Основные понятия и определения. . |
. . . . . |
. . . . |
. . . . . |
. 8 |
|||||||
Тема 2. |
Углеводороды. кислородсодержащие органические |
|
||||||||||
|
соединения: спирты, фенолы, простые эфиры, |
|
|
|||||||||
|
пероксиды, эпоксисоединения. классификация |
|
|
|||||||||
|
и номенклатура. . |
. . |
. . . . |
. . . . |
. . . . . |
. . . . . |
. . . . . |
. . . . |
. 17 |
|||
Тема 3. |
Кислородсодержащие органические соединения: |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
Н |
|
|
|
альдегиды, кетоны, карбоновые кислоты, сложные |
У |
||||||||||
|
эфиры. Азотсодержащие и органические соединения. |
|||||||||||
|
Углеводы. Классификация и номенклатура. . . . |
Т. . . . . 26 |
||||||||||
Тема 4. |
Природные источники углеводородов – сырья |
|
|
|||||||||
|
для производства полимеров. . . . . . |
. . . . . |
. . . . . |
. . . . |
. 35 |
|||||||
|
|
|
|
|
|
|
|
й |
|
|
|
|
Тема 5. |
Химическая связь. межмолекулярные |
|
|
|
||||||||
|
взаимодействия. . |
. . |
. . . . |
. . . |
. . . . . . . |
Б. . . . . . . . . |
. . . . |
. 42 |
||||
Тема 6. |
Классификация высокомолекулярных |
|
|
|
||||||||
|
|
|
|
|
|
р |
|
|
|
|
|
|
|
соединений. . . . |
. |
. . |
. . . . |
. . . . |
. . . . . . . |
. . . . . |
. . . |
. . . . . |
. 51 |
||
Тема 7. |
Молекулярно-массовые ха актер стики |
|
|
|
||||||||
|
|
|
|
о |
|
|
|
|
|
|
||
|
полимеров. |
. . . |
. . |
. . |
. . . . |
и. . . . . . . . . . |
. . . . . |
. . . . |
. . . . |
. . 58 |
||
Тема 8. |
Конфигурация и к нф |
мация макромолекулы |
|
|||||||||
|
|
|
т |
|
|
|
|
|
|
|
||
|
полимера. . |
. . . |
. . |
. . |
. . . . |
. . . . |
. . . . . . |
. . . . . |
. . . . |
. . . . . |
. 67 |
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
Тема 9. |
Надмолекулярная с руктура |
|
|
|
|
|
||||||
|
и физ ко-механ ческие свойства полимеров. . |
. . . . . |
. 78 |
|||||||||
|
з |
|
|
|
|
|
|
|
|
|
|
|
Тема 10. |
Методы с нтеза полимеров. |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 89 |
||||||
|
о |
|
|
|
|
|
|
|
|
|
|
|
Тема 11. |
Полимеры для упаковки. . . . |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 100 |
||||||
Тема 12. |
Раств ры полимеров. . . . |
. . . |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 110 |
|||||
Тема 13. |
Деструкция полимеров. |
. . . . |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 117 |
|||||
Тема |
|
|
|
|
|
|
|
|
|
|
|
|
14. |
Полимерные материалы и переработка |
|
|
|
||||||||
|
олимеров. |
. . . |
. . |
. . |
. . . . |
. . . . |
. . . . . . |
. . . . . |
. . . . |
. . . . |
. . 123 |
|
Р |
|
|
|
|
|
|
|
|
|
|
|
|
Л и тпр а т у р а. |
. . . |
. . . . |
. |
. . . |
. . . |
. . . . |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 130 |
|
П ИЛОЖЕНИЯ. |
. . . . |
. . . |
. . |
. . |
. . . . |
. . . |
. . . . . . . |
. . . . . |
. . . . |
. . . . |
. 131 |
|
П ИЛОЖЕНИЕ 1. . . |
. . . . |
. |
. . |
. . . . |
. . . . |
. . . . . . . |
. . . . . |
. . . |
. . . . . |
. 131 |
||
П ИЛОЖЕНИЕ 2. Варианты контрольных заданий. . . . . |
. . . . |
. 134 |
||||||||||
3
В В Е Д Е Н И Е
Пособие предназначено для студентов заочного отделения факультета технологий управления и гуманитаризации БНТУ, обучающихся по учебному плану, содержащему в учебной программе дисциплину «Физикохимия полимеров». Пособие включает 14 тем в последовательности постепенного усложнения, начиная от основных понятий и определений органической химии и оканчивая при-
высших учебных заведений по направлению специальностиТ«Упаковочное производство (проектирование и дизайн упаковки)».
У Содержание пособия соответствует типовой учебнойНпрограмме для
менением полимерных материалов в упаковочном производстве.
В процессе подготовки к занятию, зачету или экзамену необхо-
димо внимательно прочитать теоретическую часть темы и выпол- |
||||
|
|
|
|
й |
нить контрольные задания. Студенты заочного отделения выполня- |
||||
ют письменную контрольную работу, вариантБкоторой определяет- |
||||
|
|
Если |
||
ся по следующей схеме. Если две последн е цифры студенческого |
||||
|
р |
|
||
билета представляют собой число меньшее или равное 30, то это |
||||
число и будет номером варианта. |
|
|
две последние цифры сту- |
|
димо |
|
|
||
денческого билета больше т идцати, то, чтобы определить вариант |
||||
контрольного задания, не бх |
|
|
от двух последних цифр номера |
|
т |
|
|
|
|
студенческого биле а ня ь число 30, пока не получится число |
||||
и |
|
|
|
|
меньшее или равное ридца и. Это и будет вариант контрольного |
||||
задания. Например: две последние цифры студенческого билета 33. Тогда 33 – 30з= 3. Номер варианта 3. Далее в приложении 2 находят номера задачо, относящиеся к данному варианту. В приложении 2
представлено 30 вариантов контрольных работ.
Контрпоправокльные задания выполняются в отдельной тетради. Условиезадачи ереписывается полностью, решение следует привести
сразу осле за иси условия. В тетради необходимо оставлять поля Рдля и замечаний рецензента. Химические формулы органич ских соединений необходимо представлять в структурном виде (полная, сокращенная или скелетная формулы), функциональные
группы – обязательно с изображением всех связей между атомами. Следует давать исчерпывающие ответы на тестовые вопросы, т. е.
необходимо проанализировать каждый из четырех предложенных вариантов ответов, выбрать правильные варианты, объяснить, почему они правильные, и также по возможности объяснить, почему от-
4

вергаются другие варианты ответов, как неправильные. В тестовых заданиях может быть от одного до четырех правильных ответов.
На итоговом зачете или экзамене по курсу студент должен пока-
зать прочные знания по следующим вопросам: |
|
|
||||||||||
1. |
|
Формулы органических соединений: полные и сокращенные |
||||||||||
структурные формулы, |
пространственные формулы, скелетное |
|||||||||||
написание формул, молекулярные формулы. |
|
|
У |
|||||||||
|
|
|
||||||||||
2. |
|
Классификация органических соединений в зависимости от |
||||||||||
структуры углеродного скелета. |
|
|
|
|
|
|||||||
3. |
|
Понятие о номенклатуре органических соединений (IUPAC1, |
||||||||||
тривиальная, рациональная). |
|
|
|
|
Н |
|
||||||
4. |
|
Высокомолекулярные органические соединения (ВМСТ), строе- |
||||||||||
|
|
|
|
|
|
|
|
|
|
Б |
|
|
ние их молекул и формулы. Основные понятия и определения: по- |
||||||||||||
лимер, мономер, структурное звено, степень полимеризации. |
|
|||||||||||
|
|
|
|
|
|
|
|
|
й |
|
|
|
5. |
|
Понятие о функциональной группе. |
|
|
|
|||||||
6. |
|
Классификация и номенклатура углеводородов. Углеводород- |
||||||||||
ные радикалы. |
|
|
|
|
и |
|
|
|
||||
|
|
|
|
|
|
|
|
|
||||
7. |
|
Галогенпроизводные углеводородов. |
|
|
|
|||||||
|
|
|
|
|
|
|
р |
|
|
|
|
|
8. |
|
Органические соединения с к слородсодержащими функцио- |
||||||||||
нальными группами: спирты, фенолы, простые эфиры, пероксиды, |
||||||||||||
эпоксисоединения. |
т |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
9. |
|
Органические соединения с кислородсодержащими функцио- |
||||||||||
нальными группами: альдегиды, кетоны, карбоновые кислоты, слож- |
||||||||||||
ные эфиры. |
|
их |
о |
|
|
|
|
|
||||
|
|
|
з |
|
|
|
|
|
|
|
|
|
10. |
Органическ е соед нения с азотсодержащими функциональ- |
|||||||||||
ными группами. |
|
|
|
|
|
|
|
|
|
|||
11. |
Углев ды, классификация. Полисахарид – целлюлоза. |
|||||||||||
|
п |
|
|
|
|
|
|
|
|
|
|
|
12. |
Нефть и ее переработка. Пиролиз, крекинг, риформинг. Полу- |
|||||||||||
чение не редельных мономеров путем крекинга. Полимерные мате- |
||||||||||||
е |
|
|
|
|
|
|
|
|
|
|
||
риалы, олучаемые из продуктов нефтепереработки. |
|
|||||||||||
13. |
Б нзин, октановое число бензина. |
|
|
|
||||||||
Р |
|
|
|
|
|
|
|
|
|
|
|
|
14. |
Продукты коксохимического производства. Их применение. |
|||||||||||
15. |
Структуры Льюиса. Кислоты и основания Льюиса. Кислоты |
|||||||||||
Льюиса – катализаторы реакций полимеризации. |
|
|
||||||||||
16. |
Типы химической связи в органических соединениях: ковалент- |
|||||||||||
ная и ионная. Донорно-акцепторные связи. Полярность связи. Дипольные моменты молекул. Полярные и неполярные растворители.
1IUPAC – International Union of Pure and Applied Chemistry.
5
17. |
Межмолекулярные взаимодействия: диполь-дипольные, ин- |
||||||||||
дукционные и дисперсионные. Водородные связи. |
|
|
|||||||||
18. |
Классификация высокомолекулярных соединений (по проис- |
||||||||||
хождению, форме макромолекул, по отношению к нагреванию, по |
|||||||||||
деформационно-прочностным свойствам и назначению). |
|
||||||||||
19. |
Сополимеры и гомополимеры. |
|
|
|
|
||||||
20. |
Молекулярно-массовое распределение. |
|
|
||||||||
21. |
Среднечисловая и среднемассовая молекулярная масса поли- |
||||||||||
меров. Степень полидисперсности. |
|
|
Н |
||||||||
22. |
Среднечисловая и среднемассовая степень полимеризацииУ. |
||||||||||
23. |
Изомерия. Понятие изомерии применительно к полимерным |
||||||||||
молекулам. |
|
|
|
|
|
|
|
|
Т |
||
24. |
Структурная изомерия высокомолекулярных соединений. Гомо- |
||||||||||
полимеры структурно регулярные и нерегулярные. |
|
|
|||||||||
|
|
|
|
|
|
|
|
й |
|
|
|
25. |
Геометрическая (цис-, транс-) изомерия. Геометрическая изо- |
||||||||||
мерия в каучуках. Каучук натуральный |
синтетическийБ |
. Связь де- |
|||||||||
|
|
|
|
|
|
|
и |
|
|
||
формационных свойств каучука с ц с-, |
транс-конфигурацией его |
||||||||||
двойных связей. |
|
|
|
р |
|
|
|
|
|||
26. |
Оптическая изомерия. Сте ео егулярные (изотактические, син- |
||||||||||
|
|
|
|
|
о |
|
|
|
|
|
|
диотактические) и стереонерегуля ные (атактические) полимеры. |
|||||||||||
27. |
Конформация макр м лекулы. Понятие сегмента полимер- |
||||||||||
ной цепи. |
|
|
т |
|
|
|
|
|
|
||
|
|
|
и |
|
|
|
|
|
|
|
|
28. Агрегатное фазовое состояние вещества. Физическое состоя- |
|||||||||||
ние полимеров. Аморфное кристаллическое состояние полимеров. |
|||||||||||
|
|
з |
|
|
|
|
|
|
|
|
|
29. |
Зависимость ф з ческого состояния полимеров от темпера- |
||||||||||
|
Факторы |
|
|
|
|
|
|
|
|
|
|
туры: термомеханическая кривая аморфных полимеров. Температу- |
|||||||||||
ры стекл вания, текучести и плавления. Регулярность макромоле- |
|||||||||||
п |
|
|
|
|
|
|
|
|
|
|
|
кулярной структуры полимеров и их кристаллизация. |
|
||||||||||
30. |
|
, влияющие на температуру стеклования полимеров; |
|||||||||
т м ратура термической деформации. Пластификаторы. |
|
||||||||||
Ре32. Понятие о механизме реакции. Классификация процессов син- |
|||||||||||
теза полимеров.
33. Цепная полимеризация: свободнорадикальная, ионная и координационная. Промежуточные органические частицы реакций полимеризации: органический радикал, органический катион, органи-
6
ческий анион. Способы и условия образования органических радикалов и ионов, гомолитический и гетеролитический разрыв связи.
34. |
Ступенчатая полимеризация: поликонденсация и полиприсо- |
||||||||||||
единение. Наиболее важные типы реакций поликонденсации. |
|
||||||||||||
35. |
Типы полимерных материалов, применяющиеся в упаковоч- |
||||||||||||
ном производстве: полиэтилен высокой и низкой плотности, поли- |
|||||||||||||
пропилен, поливинилхлорид (ПВХ), полистирол и др. |
|
|
|||||||||||
36. |
Полиэфиры, полиамиды, целлюлоза. |
|
|
|
|||||||||
37. |
Растворение полимеров в сравнении с растворением низко- |
||||||||||||
молекулярных веществ. Набухание полимера. |
Н |
У |
|||||||||||
|
|
||||||||||||
38. |
Свободный и связанный растворитель. Связь растворимости |
||||||||||||
полимера с его строением. |
|
|
|
|
Т |
||||||||
39. |
Классификация деструкции по механизму действия. Физиче- |
||||||||||||
ские и химические факторы деструкции полимеров. |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
й |
|
|
|
40. |
Термоокислительная деструкция. |
|
|
|
|||||||||
41. Стабилизация полимеров. АнтиоксидантыБ. Фотостабилизаторы. |
|||||||||||||
42. |
Пластики, каучуки и резины, волокна, жидкие смолы. |
|
|||||||||||
|
|
|
|
|
|
|
|
р |
|
|
|
|
|
43. |
Технологические процессы переработки первичных полиме- |
||||||||||||
ров: прямое прессование, литье под давлением, экструзия, каланд- |
|||||||||||||
рирование и др. |
|
|
о |
и |
|
|
|
||||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
п |
|
|
|
|
|
|
|
|
|
|
||
е |
|
|
|
|
|
|
|
|
|
|
|
||
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
7
Т е м а 1 ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ
1.1.Формулы органических соединений: полные и сокращенные структурные формулы, пространственные формулы, скелетное написание формул, молекулярные формулы.
1.2.Классификация органических соединений в зависимостиУот структуры углеродного скелета.
1.3.Понятие о номенклатуре органических соединенийТ(тривиальная, IUPAC, рациональная).
1.4.Высокомолекулярные органические соединенияН, строение молекулы и формулы. Основные понятия и определения: полимер, мономер, структурное звено, степень полимеризацииБ.
|
й |
|
Углерод поистине уникален по кол честву и разнообразию соеди- |
||
время |
|
|
нений, которые он образует. В то |
|
как большинство элементов |
образует порядка десятков соединен й, углерод образует миллионы. В |
|||||||||
|
|
|
|
|
о |
|
|
||
состав молекул природных |
ганическихисоединений кроме углерода |
||||||||
входят атомы водорода, кисл |
|
да, азота, реже – серы и фосфора. |
|
||||||
Электронная |
формула а |
|
ма |
углерода в основном состоянии |
|||||
|
|
|
и |
|
|
|
|
|
|
1s22s22p2. На внешнем уровне находятся четыре электрона, которые |
|||||||||
определяют четырехвален ность1 |
углерода в органических соеди- |
||||||||
|
з |
т |
|
1 |
|
||||
|
|
|
|
|
2 2 6 2 2 |
) – |
|||
нениях. Электронный аналог углерода – кремний (1s 2s 2p 3s 3p |
|||||||||
|
образует |
|
|
|
|
|
|
|
|
также |
|
четыре связи, что позволяет использовать его вме- |
|||||||
сто углер да в кремнийорганических полимерах.
Электр нная ф рмула атома водорода 1s , водород в органических соединениях одновалентен, т. е. способен соединяться только с
|
одним сос дним атомом и только одной связью. |
|
|
Элпктронная формула атома кислорода 1s22s22p4, кислород про- |
|
|
явля т валентность два. Такую же валентность проявляет электрон- |
|
|
е |
2 2 6 2 4 |
|
ный аналог кислорода – сера (1s 2s 2p 3s 3p ). |
|
|
|
|
1 |
|
|
РВалентными электронами называются электроны внешнего электронного уровня |
||
атома. Валентность определяется как число химических связей, которыми данный атом соединен с другими. Проявляемая атомом в соединении валентность далеко не всегда равна числу валентных электронов, поскольку не все электроны внешнего уровня могут участвовать в образовании связей.
8

Электронная формула азота 1s22s22p3, в органических соединениях азот трехвалентен.
Поскольку в органической молекуле атомы влияют друг на друга через систему электронных связей, свойства соединений зависят от того, как атомы связаны в молекуле.
1.1. Формулы органических соединений. Структурная форму-
ла показывает, в каком порядке атомы соединены внутри молекулы. Порядок соединения атомов можно представить в виде полной или
|
|
|
|
|
|
|
|
|
|
Н |
|
|
сокращенной структурной формулы, пространственной (трехмерУ- |
||||||||||||
ной) формулы, скелетного изображения и др. |
|
|
|
|||||||||
В полной структурной формуле все атомы изображаютсяТсимво- |
||||||||||||
лами, а связи между ними – с помощью черточек: одинарная связь |
||||||||||||
(−), двойная связь (=) и тройная связь ( ≡ )1. Поскольку каждая связь |
||||||||||||
|
|
|
|
|
|
|
|
|
данный |
|
|
|
в полной структурной формуле изображается одной черточкой, то |
||||||||||||
чтобы определить валентность любого атома,Бнужно просто сосчи- |
||||||||||||
|
|
|
|
|
|
|
|
и |
|
|
|
|
тать количество черточек, которыми |
|
атом соединяется с |
||||||||||
|
|
|
|
|
|
|
р |
|
|
|
|
|
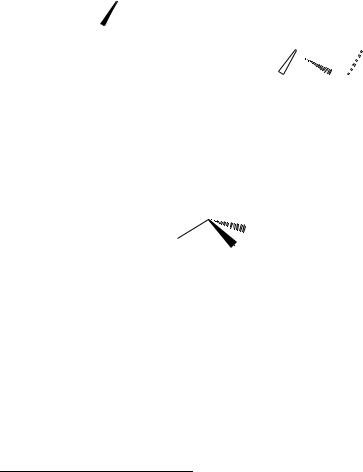
соседними. Например, полные структурные формулы этанола и изо- |
||||||||||||
бутана приведены на рис. 1.1. |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
т |
|
|
|
Н |
Н |
Н |
|
|
|
|
|
и |
|
|
|
|
│ |
│ |
│ |
|
|
H H |
|
|
|
|
|
Н − С − С − С − Н |
|||||
|
|
|
|
|
|
|
|
|||||
|
│ |
│ |
з |
|
|
|
|
|
│ |
│ |
│ |
|
|
|
|
|
|
|
|
|
|
|
|
||
Н − С − С− O −H |
|
|
|
|
|
Н │ Н |
||||||
|
а |
о |
|
|
|
|
|
|
|
б |
|
|
|
│ |
│ |
|
|
|
|
|
|
|
Н − С − Н |
||
|
H |
H |
|
|
|
|
|
|
|
|
│ |
|
|
п |
|
|
|
|
|
|
|
|
Н |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
е |
|
|
|
|
|
|
|
|
|
|
|
|
Р |
|
|
|
Рис. 1.1. Полные структурные формулы: |
|
|
||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|
а – этанола; б – изобутана |
|
|
|
||||
Отличие сокращенной структурной формулы от полной заклю-
чается в том, что связи между атомами С и Н в ней не изображают-
1 При расчете валентности атома одна двойная связь (=) считается как две связи, а одна тройная – как три связи.
9
ся. В сокращенной структурной формуле изображаются все атомы углерода вместе с группами присоединенных к ним атомов водорода. Группы атомов, находящиеся на разветвлении углеродной цепи, берутся в скобки. Сокращенные структурные формулы этанола и изобутана соответственно можно изобразить так: СН3 – СН2 – ОН и
СН3 – СН(CH3) – CН3 или СН3СН2ОН и СН3СН(CH3)CН3. |
|
У |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пространственные структурные формулы – способ изображе- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т |
||
ния расположения атомов в пространстве, в котором черные клино- |
|||||||||||||||||
видные |
связи |
|
утолщением |
клина указывают |
направление к |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Н |
|
|||
наблюдателю того атома, к которому обращено утолщение. Свет- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
||
лые клиновидные или пунктирные связи |
, |
|
, |
|
означают |
||||||||||||
удаление от наблюдателя. Связи, лежащие в одной плоскости, изоб- |
|||||||||||||||||
ражаются прямыми линиями. |
|
|
|
|
й |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
Пример изображения пространственной формулы приведен на |
|||||||||||||||||
рис. 1.2. |
|
|
|
|
|
|
|
|
|
|
и |
|
|
|
|
|
|
|
|
|
|
|
|
|
р H |
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|||
|
|
|
|
|
о |
|
|
|
H |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
и |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
з |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
о |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Р с. 1.2. Пространственная формула метана |
|
|
|
|
||||||||||
При из бражении формул длинноцепочечных молекул наиболее |
|||||||||||||||||
же |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
удобным является скелетное изображение соединения, где прямые |
|||||||||||||||||
линии |
р дставляют углерод-углеродные связи, а символы атомов |
||||||||||||||||
Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
угл родапи связанного с ним водорода не изображаются совсем, так |
|||||||||||||||||
как не изображаются связи С–Н. Присутствие атомов углерода |
|||||||||||||||||
предполагается |
на пересечении |
прямых |
линий . |
|
Предполагается |
||||||||||||
также, что каждый атом углерода связан с таким количеством атомов водорода, которое обеспечивает четырехвалентность углерода.
1 Пересечение прямых линий под углом отражает изогнутую форму цепочки углеводородных атомов.
10
