
Молекулярная физика (11-18)
.pdf
|
3 / ( u ). |
(2) |
|
Вязкость можно |
определить, |
воспользовавшись |
известной формулой |
Пуазейля (3), выражающей вязкость |
через объем V газа, протекающего через |
||
сечение трубки за определенное время t при определенной разности давлений ΔР на концах трубки:
|
r4 |
t, |
(3) |
|
8V L |
||||
|
|
|
где r – радиус, L – длина трубки (капилляра).
Средняя скорость теплового движения молекул газа может быть найдена по
формуле: |
|
|
|
|
|
|
|
u |
8 RT |
, |
(4) |
|
|
|
|
где R – универсальная газовая постоянная, |
T – абсолютная температура, μ – |
||
молярная масса газа.
Плотность газа можно найти из уравнения Клапейрона -Менделеева:
PV |
m |
RT , |
|
(5) |
||
|
|
|||||
|
|
|
|
|
||
откуда |
P |
|
|
|||
m/V |
, |
(6) |
||||
RT |
||||||
|
|
|
|
|
||
где Р – давление газа.
Подставляя (3), (4), (6) в формулу (2) , получим расчетную формулу для определения длины свободного пробега:
|
|
3 r4 P t |
|
|
|
|
|
|
|
RT |
, |
(7) |
|||
16V L P |
|
2 |
|
||||
|
|
|
|
|
|||
где В gh– разность давлений, определяемая в работе с помощью U- образного водяного манометра, т.е. через В – плотность воды, g – ускорение
свободного падения, h– разность уровней жидкости в манометре.
Эффективный диаметр молекулы можно вычислить из формулы, выражающей его связь с длиной свободного пробега:
4
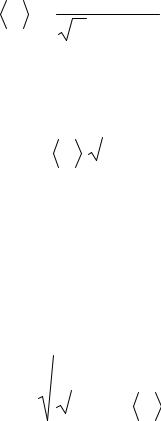
|
|
1 |
, |
(8) |
2 n d2 |
где n – число молекул в единице объема (концентрация) при данных условиях, d
– эффективный диаметр молекулы, тогда:
d2 |
|
1 |
|
. |
(9) |
||
|
|
|
n |
||||
2 |
|||||||
|
|
|
|||||
Концентрацию при данных условиях определим из выражения:
n |
P |
, |
(10) |
|
kT |
||||
|
|
|
где k – постоянная Больцмана.
Используя формулы (8), (9) и (10), получаем выражение для эффективного
диаметра молекулы газа: |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
d |
|
|
kT |
|
. |
(11) |
|||
|
|
|
|
||||||
2 P |
|
||||||||
|
|
|
|
|
|
||||
Для вычисления коэффициента внутреннего трени я, средней длины свободного пробега и эффективного диаметра молекул воздуха по формулам (3),
(7) и (11) соответственно, необходимо знать: параметры капилляра (радиус и длину), через который протекает воздух; разность давлений на концах капилляра (разность уровней жидкости в U-образном манометре); температуру и давление окружающего воздуха, а также объем воздуха, протекшего через капилляр за определенное время.
Описание установки
1. Внешний вид установки представлен на рис. 1. На передней панели расположены: клапан К1 (1) перепуска воды из вспомогательного бачка в мерную емкость (6), клапан К2 (2) напуска воздуха в мерную емкость для перепуска воды из этой емкости во вспомогательную, водяной U -образный манометр (3), уровнемер с измерительными шкалами (4), капилляр (5) и тумблер «КОМПРЕССОР» (12) включения микрокомпрессора с индикацией.
2. Схема установки (рис. 2) включает капилляр (5), |
соединенный одним |
|
концом через систему пневмопровода с мерной емкостью (6) и U -образным |
||
манометром (3). Другой конец капил ляра сообщается с атмосферой. |
Мерная |
|
емкость соединена трубкой (8) со вспомогательным сосудом (9), в |
котором |
|
находится вода. С помощью трубки (10) бачок |
(9) соединен с |
|
5
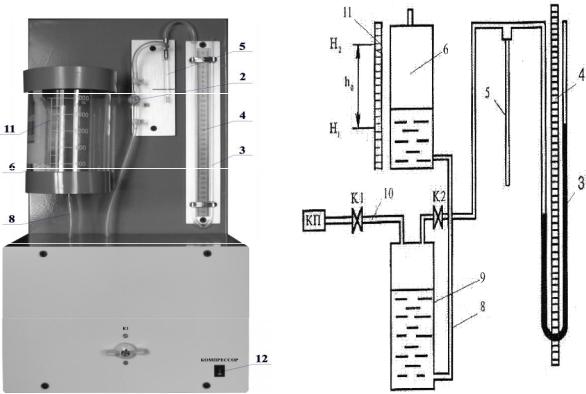
микрокомпрессором. При закрытом клапане К 2 и открытом клапане К1 вода из вспомогательной емкости (9) через трубку перетекает в мерную емкость (6). При закрытом клапане К1 и открытом клапане К2 вода вытесняет воздух из вспомогательной емкости через капилляр в атмосферу. Так как сечение капилляр а мало, то возникает разность давлений воздуха на его концах, которая измеряется
Рис. 1. Внешний вид установки |
Рис. 2. Схема установки |
водяным U-образным манометром. С помощью секундомера измеряется время истечения заданного объема жидкости из мерной емкости, который определяется с помощью уровнемера (11). Для повторения опыта закрывают клапан К 2 и, включив компрессор, открывают клапан К 1. При этом вода перетекает из вспомогательной емкости (9) в мерную емкость (6). Уровень воды в мерной емкости определяется по уровнемеру (11).
Поскольку разность давлений на концах капилляра в момент включения секундомера и в момент его выключения различна, то необходимо взять среднюю разность давлений за время проведения опыта.
Порядок выполнения работы
1.Выписать данные установки в таблицу.
2.Для воздуха в лаборатории по барометру определить давление Р по термометру температуру Т. Занести данные в таблицу.
6
3. Определиться, по указанию преподавателя, с конечной целью выполнения работы (все ли пункты обозначенные в работе вы выполняете ), с объемом перетекающей из сосуда в сосуд жидкости и отметками Н2 и Н1. Занести объем V в таблицу.
4. Закрыть краны К1 и К2.
5. Включить электропитание микрокомпрессора тумблером "КОМПРЕССОР".
6. Открыть кран К1 и установить уровень воды в мерной емкости выше отметки уровнемера Н2, заданной преподавателем. Закрыть кран К1. Компрессор на время можно выключить.
7. Отрыть кран К2 и в момент прохождения уровня воды верхней мерной емкости отметки уровнемера Н2 включить секундомер и произвести отсчет
разности уровней жидкости в водяном U-образном манометре hВ. Результат записать в таблицу.
8. В момент прохождения уровня воды в мерной емкости нижней отметки уровнемера Н1 выключить секундомер и произвести отсчет разности уровней
жидкости в водяном U-образном манометре hН. Результаты записать в таблицу. Закрыть кран К2.
9.Пункты 4÷8 повторить до пяти раз и определить среднее значение h в рамках каждого опыта hср.
10.Рассчитать в системе СИ коэффициент внутреннего трения воздуха по формуле (12), среднюю длину свободного пробега молекул воздуха <λ> по формуле (13) и эффективный диаметр молекулы по формуле (14) с введенными обобщенными постоянными А, В и С.
A |
hCP t |
, |
|
(12) |
|||||
|
|
|
|||||||
|
|
|
V |
|
|
|
|
|
|
где постоянная |
А = 3·10-9 Н, |
|
|||||||
B |
hCP t |
|
|
|
|
|
|
||
|
|
|
T |
, |
(13) |
||||
|
|
|
|
|
|||||
|
|
|
V P |
|
|
||||
где постоянная |
В = |
|
10-5 м4/(с ·К1/2), |
|
|||||
|
|
|
|
|
|
|
|
|
|
d C |
|
T |
, |
|
|
|
(14) |
||
P |
|
|
|
||||||
|
|
|
|
|
|
|
|
||
7
где постоянная С = 1,76·10-11 Дж 1/2/ К1/2.
11. Оценить погрешность для коэффициента вязкости воздуха по указанию преподавателя по формулам (15) или (16).

|
2 |
16 |
|
r 2 |
|
V 2 |
|
g 2 |
|
L 2 |
|
h 2 |
|
2 |
|
t |
2 |
|
(15) |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, |
|||
|
|
|
|
r |
V |
|
g |
|
L |
h |
|
|
|
t |
|
|
|
|||||
|
|
|
|
|
|
|
|
|||||||||||||||
где , r, V, g, L, h, , t – абсолютные |
погрешности |
||||||||||||||||||||
соответствующих величин. |
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
табл измер |
|
|
100%. |
|
|
|
|
|
(16) |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
табл |
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
12. Сравнить, полученные в эксперименте результаты с табличными. |
|
|
|||||||||||||||||||
Табличные значения определяемых для воздуха величин при температуре |
|||||||||||||||||||||
20оС: ηТАБЛ |
= 17,2·10-6 Па·с; |
|
= 6,5·10-8 м; |
d = 3,5·10-10 м. |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
Таблица результатов измерений и вычислений |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
№ |
V |
|
t |
|
|
|
hB |
|
hH |
hCP |
|
η |
|
<λ> |
|
|
d |
|
|||
|
м3 |
|
с |
|
|
|
мм |
|
мм |
мм |
|
Па·с |
|
м |
|
|
м |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
μ |
|
|
|
|
r |
|
|
|
|
L |
|
R |
|
|
С |
|
|
||||
кг/моль |
|
|
|
|
мм |
|
|
|
|
мм |
Дж / (моль·К) |
|
Дж 1/2/ К1/2 |
|
|||||||
29·10-3 |
0,5 ± 0,1 |
|
80 ± 1 |
|
8,31 |
|
|
1,76·10-11 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Р |
|
|
|
|
Т |
|
|
|
|
А |
|
В |
|
|
С |
|
|
||||
Па |
|
|
|
|
К |
|
|
|
|
Н |
м4 / (с ·К1/2) |
|
Дж |
½ |
/ К |
1/2 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
3·10-9 |
|
10-5 |
|
|
1,76·10-11 |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
8
1.Запишите уравнение Менделеева -Клапейрона для одного моля идеального
газа.
2.Что называют эффективным диаметром молекулы?
3.Что называют средней длиной свободного пробега молекулы?
4.Запишите выражение для определения средней длины свободного пробега молекулы. Поясните.
5.Как изменится средняя длина свободного пробега молекул с увеличением давления?
6.Зависит ли средняя длина свободного пробега от температуры газа? Ответ обоснуйте.
7.Запишите выражение для определения средней скорости теплового движения молекул. Поясните.
8.Запишите формулу Пуазейля для определения динамической вязкости.
9.Что понимают под вязкостью газов? Объясните причины возникновения вязкого трения.
10.Как изменяется вязкость газа и жидкости с увеличением температуры?
Индивидуальные задания |
|
|
1. Найти среднюю длину свободного пробега |
молекул воздуха при |
|
температуре 20оС и давлении 0,15 МПа. Эффективный диаметр |
молекул |
|
воздуха принять равным 0,3 нм. |
Ответ: 67,6 |
нм. |
2.Во сколько раз вязкость кислорода больше вязкос ти азота?
Температуры газов одинаковы. Ответ: в 1,07 раза.
3. Вычислить среднюю длину свободного пробега молекул хлора при температуре 0оС и давлении 760 мм.рт.ст. Эффективный диаметр молекул хлора принять равным 0,35 нм. Ответ: 68,3 нм.
4.Найти среднюю длину свободного пробега атомов гелия, если
известно, что плотность его равна 21 г/м 3. |
Ответ: 1,8 мкм. |
5.В сосуде объемом 100 см3 находится 0,5 г азота. Найти среднюю
длину свободного пробега молекул азота. |
Ответ: 23 нм. |
9

6. В сосуде находится углекислый газ , плотность которого равна 1,7 кг/м3. Средняя длина свободного пробега его молекул составляет 79 нм. Найти
диаметр молекул углекислого газа. |
Ответ: 0,35 нм. |
7. В сферической колбе объемом 1 л |
находится азот. При какой |
плотности азота средняя длина свободного пробега молекул азота станет больше размеров сосуда? Отве т: 0,94 мг/м3.
8. Определить какое количество столкновений испытывает за одну секунду молекула аргона при температуре 290 К и давлении 0,1 мм.рт.ст. Эффективный диаметр молекулы аргона принять равным 0,29 нм.
Ответ: 49 000 с-1.
9. Какое предельное число молекул газа должно находиться в 1 см 3 сферического сосуда, диаметр которого равен 15 см, чтобы молекулы не сталкивались друг с другом? Эффективный диаметр мо лекулы газа принять
равным 0,3 нм. |
Ответ: 1,7 ·1013 см -3. |
10. Сколько молекул воздуха ударяется ежеминутно об оконное стекло |
|
размером 40 см на 60 см при температуре 17 оС и давлении 760 мм.рт.ст.
Молярная масса воздуха 29 г/моль. |
Ответ: 4,48 ·1028. |
11. Найти диаметр молекулы кислорода, если при температуре 273 К его |
|
вязкость составляет 18,8 мкПа·с. |
Ответ: 9·1020. |
12. На рисунке 3 показано сечение прибора, служащего для измерения динамической вязкости (коэффициента внутреннего трения) газов. Между цилиндрами А и В с общей осью вращения находится газ, причем внутренний цилиндр полностью охватывается внешним. Если привести внешний цилиндр в быстрое вращение, то на каждый элемент ΔS боковой поверхности
внутреннего цилиндра будет действовать u окружное усилие, называемое силой
|
|
внутреннего |
трения |
F u S , |
где |
η – |
||||
|
|
|
|
|
|
r |
|
|
|
|
В |
А |
динамическая вязкость газа, |
заполняющего |
|||||||
|
|
пространство |
между |
цилиндрами, |
u/ r – |
|||||
Fтр |
|
мера убывания линейной скорости на единицу |
||||||||
|
длины |
радиуса |
(градиент |
скорости). |
||||||
|
|
|||||||||
|
|
Вычислить |
динамическую |
вязкость |
для |
|||||
Рис. 3. |
|
воздуха |
и |
углекислого |
газа, |
если |
сила |
|||
|
внутреннего |
трения равна 6,2 мН и 5 мН |
||||||||
|
|
соответственно, диаметры |
цилиндров 210 и |
|||||||
200 мм, их высота 290 мм, внешний цилиндр вращается со скоростью 900 об/мин. Ответ: 17,2 мкПа·с; 14 мкПа·с.
10
13. Определить скорость вращения внешнего цилиндра прибора описанного в предыдущей задаче, если найденн ый коэффициент динамической вязкости для кислорода получился равным 19,2 мкПа·с, а действующая на внутренний цилиндр сила трения, составила 4,07 мН? Вычислить динамическую вязкость для водорода, если при той же силе внутреннего трения скорость вращения внешнего цилиндра равнялась 1200 об/мин. Ответ: 530 об/мин; 8,5 мкПа·с.
Библиографический список
1.Т.И. Трофимова. Молекулярно -кинетическая теория идеальных газов./ Трофимова Т.И.//Курс физики: Учеб. – М; 2000-Гл.8, § 46-48.-С. 92-97.
2.Детлаф А.А. Основы молекулярной физики и термодинамики. /А.А. Детлаф, Б.М. Яворский // Курс физики: Учеб. -М., 1999.- Гл. 10; § 10.6.-10.9.- С.136-143.
3.А.С. Ахматов. Лабораторный практикум по физике: Учеб пособие для студентов втузов / Ахматов А.С., Андреевск ий В.М., Кулаков А.И. и др.; Под ред. А.С. Ахматова. – М.: Высш. школа, 1980.– 360с., ил.
4.Чертов А.Г., Воробьев А.А. Задачник по физике: Учеб. Пособие для втузов. М.: 2001.– 640 с.
11
Федеральное агентство по образованию Ухтинский государственный технический университет
219
ИЗУЧЕНИЕ РАСПРЕДЕЛЕНИЯ МОЛЕКУЛ ГАЗА ПО СКОРОСТЯМ НА МЕХАНИЧЕСКОЙ МОДЕЛИ
Методические указания к лабораторным занятиям по физике
для студентов всех специальностей дневной и заочной формы обучения
Ухта 2008
УДК 53 (075) С 28
ББК 22.3. Я7
Северова, Н.А. Изучение распределения молекул газа по скоростям на механической модели. [Текст]: метод. указания / Н.А.Северова. – Ухта: УГТУ, 2008. – 15 с.: ил.
Методические указания предназначены для выполнения лабораторной работы по физике по теме «Молекулярно-кинетическая теория» для студентов всех специальностей.
Содержание методических указаний соответствует рабочей учебной програм ме.
Методические указания рассмотрены и одобрены кафедрой физики от 14.02.08г., пр. № 4 и предложены для издания.
Рецензент: |
Пономарев Н.С., к.ф -м.н., доцент кафедры физики |
|
Ухтинского государственного техни ческого университета. |
Редактор: |
Шамбулина В.Н., доцент кафедры физики |
|
Ухтинского государственного технического университета. |
В методических указаниях учтены предложения реце нзента и редактора.
План 2008 г., позиция . Подписано в печать . .08г.
Компьютерный набор: Омельчук И.В .
Объем 15 с. |
Тираж 60 экз. |
Заказ № . |
© Ухтинский государственный технический университет, 2008 169300, г. Ухта, ул. Первомайская, 13.
Отдел оперативной полиграфии УГТУ. 169300, г. Ухта, ул. Октябрьская, 13.
2
