
Молекулярная физика (11-18)
.pdf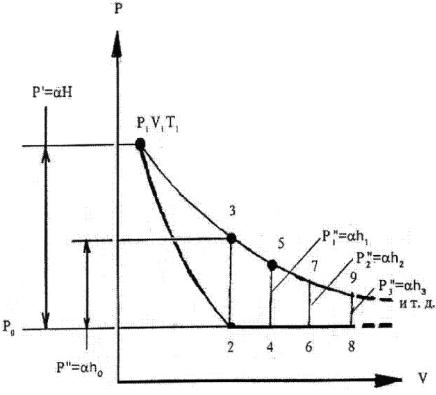
протекающий в баллоне при открытом клапане после завершения адиабатного расширения, 4 - 5 – изохорный процесс, протекающий после закрытия клапана.
Точки 1, 3, 5 лежат на изотерме, соответствующей температуре T1.
Примечание: Процессы, происходящие в сосуде, не являются квази - равновесными, поэтому графики, строго говоря, строить нельзя (в случае неравновесного процесса нельзя говорить о да влении и температуре газа, так как в разных частях баллона эти величины могут имет ь различные значения).
|
|
Рис.3. |
|
|
|
|
|
||
Очевидно, что с ростом t разность уровней |
жидкости |
в |
манометре |
h |
|||||
пpопоpциональная P5 - P4 |
будет |
уменьшаться. |
При |
t |
стремящемся |
к |
|||
бесконечности получим |
h 0, |
при t 0 |
(длительность |
адиабатного |
|||||
расширения весьма мала) получим h h0 . Измеряя |
h при различных значениях |
||||||||
t и строя график зависимости |
ln |
h |
f (t) , |
можно |
найти |
значение |
h |
||
|
|||||||||
|
|
|
H |
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||
экстраполяцией экспериментальной прямой (рис. 4).
8

|
Рис. 4. |
|
Порядок выполнения работы |
1. |
Выписать данные спецификации измерительных приборов, данные |
установки, условия опыта. |
|
2. |
Включить электропитание компрессора. Открыть кран К 1 и накачать в |
баллон воздух так, чтобы разность уровней жидкости в манометре стала около 250 мм. Закрыть кран К1, выждать 2-3 минуты до тех пор, пока температура воздуха в баллоне не станет равной темп ературе окружающей среды. Произвести дополнительную регулировку разностей уровней (в дальнейших опытах начальную разность уровней нужно поддерживать постоянной). По нижнему уровню мениска определить уровни жидкости L1 и L2 в коленах манометра;
записать значения L1, L2 , H L1 L2 в таблицу.
3. Резко нажать на клапан К2, соединив баллон с атмосферой. Одновременно включить секундомер. Выдержать клапан К2 открытым в течение заданного
времени |
t ; после этого отпустить клапан. Через 3 -4 минуты (после того, как |
||||||
уровни |
жидкости |
в манометре |
стабилизируются ), |
определить уровни L1 t и |
|||
|
|
|
|
|
|
|
t в таблицу. |
L2 t , записать значения |
L1 t , |
L2 t , ht |
L1 |
t L2 |
|||
4. Повторить |
опыты |
(пункты 2 - 3) не менее пяти раз для разных значений t |
|||||
времени нажатия на клапан К 2 |
- 10, 15, 20, 25, 30, 35 секунд. Следить за тем, |
||||||
чтобы начальная разность уровней H была постоянной.
9

Примечание: накачивать воздух в баллон нужно медленно (чтобы избежать значительного повышения температуры воздуха в баллоне) и осторожно (чтобы нижний уровень жидкости не достиг колена манометра).
5. Вычислить границы доверительного инт ервала по методу Стьюдента, причем, значение коэффициента α взять по указанию преподавателя, а из таблицы, представленной на плакате в аудитории , определиться со значением
коэффициента Стьюдента t , N для |
N 6: |
|
|
|
|
|
|||
|
|
|
|
|
|
i 2 |
|
|
|
t ,N |
|
. |
|||||||
N N 1 |
|||||||||
|
|
|
|
|
|||||
6.Записать результат с учетом погрешности измерения.
7.Сравнить экспериментальное значение с теоретическим значением (воздух считать двухатомным идеальным газом).
Таблица измерений и вычислений
№ |
H=L1 - L2 |
t |
h=L'1 - L'2 |
ho |
i |
|
|
|
|
i |
|
|
i 2 |
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
||||||||||||||
1 |
|
10 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
15 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
|
20 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
25 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5 |
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 |
|
35 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Сформулируйте первое начало термодинамики.
2.Что называется удельной и молярной теплоемкостью, как они связаны между собой?
3.Какова связь между Ср и СV для идеального газа?
4.Какой процесс называется адиабатическим ?
5.Что происходит с внутренней энергией газа при адиабатическом процессе?
6.Как изменяется температура газа при адиабатическом процессе ?
10
7.Что называется степенью свободы? Какое число степеней свободы имеет жесткая молекула (одноатомная, двухатомная, трехатомная)?
8.Вычислите теоретическое значение для воздуха на основе молекулярно-кинетической теории?
9.Может ли быть меньше 1?
10.Какие процессы изменения состояний газа имеют место в данной работе?
11.Выведите расчетную формулу.
12.Чему равна теплоемкость идеального газа при изотермическом процессе?
Индивидуальные задания
1. На рис. 5. изображены пять процессов, протекающих |
Р |
|
1 |
с идеальным газом. Как ведет себя внутренняя |
|
|
2 |
энергия газа в ходе каждого из процессов? |
|
|
3(изотерма) |
2. Показать, что разность удельных теплоемкостей газа |
|
5 |
(адиабата) |
|
V |
||
|
|
||
удовлетворяет уравнению Майера cP cV R . |
|
Рис.5 |
|
3. Изобразить для идеального газа примерные графики изохорического, изобарического, изотермического и адиабатического процессов на диаграммах: а) Р,V; б) T,V; в) P, T. Графики изобразить проходящими через одну точку.
4.Некоторое количество идеального одноатомного газа сжимают адиабатически до тех пор, пока давление не превзойдет начальное давление в 10 раз. Затем газ расширяется изотермически до первоначального объема. Во сколько раз конечное давление газа превышает начальное его давление? Ответ: в 2,51 раза
5.Идеальный газ (γ = 1,4), находящийся первоначально при температуре таяния льда, подвергается сжатию, в результате чего: а) объем уменьшается в 10 раз; б) давление увеличивается в 10 раз. Считая процесс сжат ия адиабатическим, определить до какой температуры нагревается газ вследствие сжатия.
Ответ: а) 413 оС; б) 245 оС.
6.Показать, нагревается или охлаждается идеальный газ, если он расширяется по закону pV 2 const ? Какова молярная теплоемкость газа при этом процессе?
Ответ: охлаждается, C CV R .
11

7.Температура в комнате объема V поднялась от значения Т1 до значения Т2. Как изменилась при этом внутренняя энергия воздуха, содержащегося в комнате?
Ответ: не изменилась.
8. Некоторое количество кислорода (рис. 6) занимает объем V1=3 л при температуре t =27 0С и давлении P1 =8,2·105 Па. Во втором состоянии газ имеет давление P2 = 6 ·105 Па. Найти:
а) количество тепла, полученного газом; б) работу, совершенную газом при изменении состояния; в) изменение внутренней энергии газа .
Р
Р1 1
Р2 2
V1 V Рис. 6
9. Считая азот идеальным газом, определить его удельную теплоемкость: 1) для изобарного процесса; 2) для изохорного процесса.
Ответ: 1) Cv=742 Дж/(кг·К); 2) Cp=1,04 кДж/(кг·К)
10. Азот массой 1 кг находится при температуре 280 К. Считая газ идеальным, определить: 1) внутреннюю энергию молекул азота; 2) среднюю кинетическую энергию вращательного движения молекул азота.
Ответ: 1) 0,2 МДж ; 2) 83,1 кДж.
11. Водород массой m = 20 г был нагрет на T = 100 К при постоянном давлении. Определить: 1) количество теплоты Q, переданное газу; 2) приращение U внутренней энергии газа; 3) работу А расширения.
Ответ: 1) 29,3 кДж ; 2) 20,9 кДж ; 3) 8,4 кДж.
12. Кислород объемом 2 л находится под давлением 1 МПа. Определить, какое количество теплоты необходимо сообщить газу, чтобы увеличить его давление вдвое в результате изохорного процесса. Ответ: 5кДж.
13.Некоторый газ массой 2 кг находится при температуре 300 К и под давлением 0,5 МПа. В результате изотермического сжатия давление газа увеличилось в три раза. Работа, затраченная на сжатие, А = -1,37 кДж. Определить: 1) какой это газ; 2) первоначальный удельный объем г аза.
Ответ: 1) гелий; 2) 1,25 м3/кг.
Библиографический список
Трофимова Т.И. Основы термодинамики. /Т.И. Трофимова // Курс физики: Учеб. – М.,2001. – Гл. 9; § 50-55. – С.100 - 110.
12
Федеральное агентство по образованию Ухтинский государственный технический университет
213
ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ВОЗДУХА МЕТОДОМ НАГРЕТОЙ НИТИ
Методические указания к лабораторной работе для студентов всех специальностей дневной и заочной формы обучения
Ухта
2007
УДК 53 (075) С 28
ББК 22.3. Я7
Северова, Н.А. Измерение коэффициента теплопроводности воздуха методом нагретой нити [Текст]: метод. указания/ Н.А.Северова. – Ухта: УГТУ, 2007. – 12 с.: ил.
Методические указания предназначены для выполнения лабораторной раб оты по физике по теме «Явления переноса» для студентов всех специальностей.
Содержание методических указаний соответствует рабочей учебной пр ограмме.
Методические указания рассмотрены и одобрены кафедрой физики от 19.02.07г., пр. № 5 и предложены к изданию.
Рецензент: |
Пономарев Н.С., к.ф-м.н., доцент кафедры физики |
|
|
Ухтинского государственного технического |
университета. |
Редактор: |
Шамбулина В.Н., доцент кафедры физики |
|
|
Ухтинского государственного технического |
университета. |
В методических указаниях учтены предложения рецензента и редактора.
План 2007г., позиция 36. |
|
|
Подписано в печать 30.11.07 г. |
Компьютерный набор: Северова Н.А. |
|
Объем 12 с. |
Тираж 60 экз. |
Заказ № 215. |
© Ухтинский государственный технический университет, 2007 169300, г. Ухта, ул.Первомайская, 13.
Отдел оперативной полиграфии УГТУ. 169300, г. Ухта, ул. Октябрьская, 13.
2
ИЗМЕРЕНИЕ КОЭФФИЦИЕНТА ТЕПЛОПРОВОДНОСТИ ВОЗДУХА МЕТОДОМ НАГРЕТОЙ НИТИ .
Цель работы: экспериментальное определение коэффициента теплопр о- водности воздуха, находящегося вблизи наг ретой электрическим током нити. В лабораторной работе определяются электрическая мощность, выделяемая в нити, и температура нити.
Краткая теория
Распространение теплоты в газах осуществляется тремя способами: тепл о- вым излучением (перенос энергии электромагнитными волн ами), конвекцией (перенос энергии за счет перемещения слоев газа в пространстве из областей с более высокой температурой в области с низкой температурой) и теплопроводностью.
Теплопроводность – это процесс передачи теплоты от более нагретого слоя газа к менее нагретому за счет хаотичного теплового движения молекул . Обычно этот процесс приводит к выравниванию температуры. Для стационарного одн о- мерного процесса (температура тела меняется лишь по оси ОX и разность температур в слое газа не изменяется с те чением времени), количество теплоты dQ, переносимое за время dt через площадку dS, нормальную к оси OX, в направлении убывания температуры, определяется по закону Фурье:
dQ (dT ) dS dt , |
(1) |
dx |
|
где – dT/dх – градиент температуры; – коэффициент теплопроводности.
При теплопроводности перенос энергии осуществляется в результате неп о- средственной передачи энергии от молекул, обладающих большей энергией, к молекулам, обладающим меньшей энергией. В случае малых з начений градиента температуры dT/dх (если температура мало меняется на расстоянии порядка длины свободного пробега молекулы) коэффициент теплопроводности не зав и- сит от градиента температуры, а зависит лишь от агрегатного состояния вещес т- ва, его атомно-молекулярного строения, температуры, давления.
Из молекулярно-кинетической теории идеального газа следует, что теор е-
тическое значение |
коэффициента теплопроводности может быть рассчитано по |
|||
формуле: |
|
1 |
cV , |
(2) |
|
|
3 |
|
|
3
где – плотность газа; < > – средняя скорость беспорядочного теплового движения молекул; < > – средняя длина свободного пробега молекул; cV
– удельная теплоемкость газа при постоянном объ еме. Для идеального газа имеют место соотношения :
|
|
|
|
|
|
|
1 |
|
|
|
8kT |
, |
|
|
, |
||||
|
|
|
|
||||||
|
|
mo |
|
|
2 n s |
|
|||
где mо – масса молекулы; k – постоянная Больцмана; n – число молекул в едини-
це объема; s – эффективное сечение столкновений молекул (s d2 , где d– эффективный диаметр сечения).
Тогда, преобразуя формулу (2), имеем:
const |
cV |
|
|
|
|
|
. |
|
|
T |
, т.е. |
T |
(3) |
||||||
s |
|||||||||
|
|
|
|
|
|
|
|
Отметим, что для реальных газов коэффициент теплопроводности с ув е- личением температуры растет быстрее, чем следует из (3). Это связано с незначительным увеличением cV и уменьшением эффективного сечения столкнов е- ний s с ростом температуры. Из опытов следует, что для многих газов (в частн о- сти, для воздуха):
const Tb , |
(4) |
где показатель b = 0,7÷1.
Методика измерения и вывод расчетной формулы
Нагреваемая вольфрамовая проволока -нить (7) (рис. 2) протянута по оси симметрии цилиндрического баллона (стеклянной цилиндрической трубки (8)) с двойными стенками; между стенками залита вода. Температура воды в баллоне и, следовательно, температура стенки Т трубки постоянна в течение опыта. Воль ф- рамовая проволока через соединительные провода подключается к источнику п и- тания постоянного тока. Ток в нити определяется по напряжению U R на балластном (образцовом) сопротивлении Ro . Напряжение на проволоке (нити) и напря-
жение на балластном сопротивлении измеряется мультиметром (3) при соотве т- ствующем положении переключателя (4) (рис . 1). При нагревании нити вдоль радиуса трубки создается градиент темпер атуры. Площадь, через которую передае т- ся тепло, равна площади поверхности цилиндра, коаксиального с нагретой нитью,
4
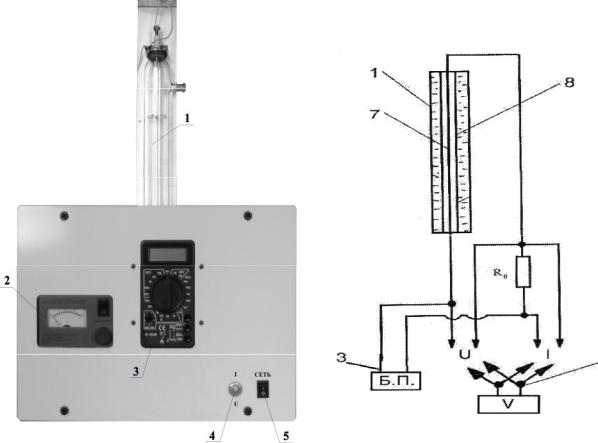
т.е. S 2 r L , где r – радиус (произволен в пределах стеклянной трубки), |
L |
|||
– длина цилиндра. Тогда из (1) имеем: |
|
|
|
|
dQ dT 2 r L dt |
dT |
2 L dt |
(5) |
|
(dr /r) |
||||
dr |
|
|
||
Рис.1 |
Рис.2 |
Общий вид экспериментальной |
Схема установки |
установки |
|
Учитывая, что dr/r = d(ln r), запишем соотношение (5) для мощности теплового потока q через поверхность цилиндра, равную q dQdt :
q dQ |
(r) |
dT |
2 L . |
(6) |
|
d(lnr) |
|||||
dt |
|
|
|
В (6) подчеркнут тот факт, что коэффициент теплопроводности зависит от радиуса выделенного цилиндра r.
5
