
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Питання для самоперевірки
Чим виражається склад розчину?
Скільки грамів
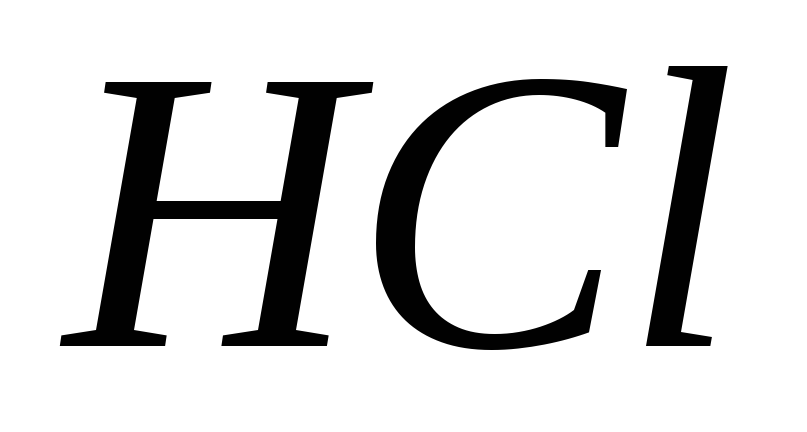 міститься в 100 мл 0,1 н розчину
міститься в 100 мл 0,1 н розчину
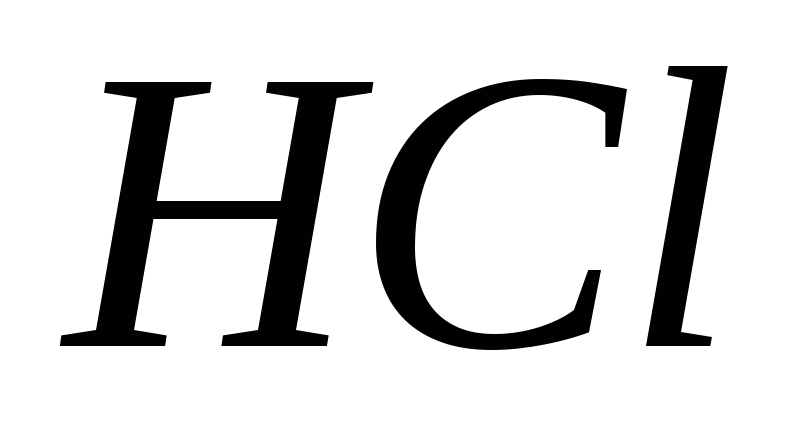 ?
?Визначити молярну і нормальну концентрації 30%-ного розчину сірчаної кислоти.
Що таке титр розчину? Які розчини називаються титрованими?
У чому полягає процес титрування?
Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
Мета роботи - вивчення хімічної рівноваги та можливості перебігу реакцій в розчинах електролітів.
Загальні вказівки
При виконанні лабораторної роботи студенти повинні знати, що електроліти – це речовини, які розпадаються в розчинах або розплавах на позитивно заряджені іони (катіони) і негативно заряджені іони (аніони). Процес розпаду молекул на іони – електролітична дисоціація – відбувається під дією полярних молекул розчинника. При цьому одні речовини розпадаються на іони повністю (сильні електроліти), а інші лише частково (слабкі електроліти).
До
сильних електролітів належать майже
всі солі, деякі мінеральні кислоти (![]() )
і основи, утворені лужними та лужноземельними
металами (
)
і основи, утворені лужними та лужноземельними
металами (![]()
![]() .
.
До
слабких електролітів належать вода,
практично всі органічні кислоти, деякі
мінеральні кислоти (![]() ),
а також основи, утворенні
),
а також основи, утворенні
![]() -
металами, та
-
металами, та
![]() .
.
Здатність
електролітів до дисоціації на іони
визначається ступенем дисоціації
![]() і константою дисоціаціїК.
і константою дисоціаціїК.
![]() ,
,
де
![]() -
число молекул, що розщепилися на іони;
-
число молекул, що розщепилися на іони;
![]() - загальне число розчинених молекул.
- загальне число розчинених молекул.
 (для електролітуКА)
(для електролітуКА)
Необхідно
звернути увагу на те, що більш універсальною
характеристикою сили електроліту є
константа дисоціації, оскільки К,
як і
![]() ,
залежить від природи розчиненої речовини
і розчинника та від температури, але на
відміну від
,
залежить від природи розчиненої речовини
і розчинника та від температури, але на
відміну від
![]() не залежить від концентрації розчину.
не залежить від концентрації розчину.
Слід мати на увазі, що багатоосновні кислоти і багатокислотні основи дисоціюють ступінчасто. Наприклад:
![]() /перший ступінь/
/перший ступінь/
![]() /другий ступінь/
/другий ступінь/
![]() /третій ступінь/
/третій ступінь/
У водних розчинах електролітів необхідно враховувати дисоціацію води як слабкого електроліту:
![]()
Іонний
добуток води [![]() ]
· [
]
· [![]() ]
для будь-яких водних розчинів є
постійною величиною, рівною 10-14(t=220C).
]
для будь-яких водних розчинів є
постійною величиною, рівною 10-14(t=220C).
Для
характеристики реакції
середовища доцільно користуватися
водневим показником
![]() У нейтральних розчинах
У нейтральних розчинах
![]() ,
в кислих
,
в кислих
![]() ,
у лужних
,
у лужних
![]() .
.
Для
якісного визначення реакції середовища
застосовують індикатори, колір яких
змінюється в залежності від величини
![]() розчину. Найчастіше використовують
такі індикатори: лакмус, фенолфталеїн
і метилоранж.
розчину. Найчастіше використовують
такі індикатори: лакмус, фенолфталеїн
і метилоранж.
Необхідно пам’ятати, що реакції обміну в розчинах електролітів практично відбуваються в бік утворення осаду (малорозчинних речовин), газів (летких речовин) і слабких електролітів (малодисоційованих сполук).
При складанні іонних рівнянь реакцій треба керуватися тим, що сильні розчинні електроліти, як практично повністю дисоційовані, пишуться у вигляді іонів, а речовини малодисоційовані, малорозчинні і газоподібні записують у молекулярній формі.
Порядок виконання роботи
Дослід 1. Хімічна рівновага в розчинах електролітів.
1.
Налити в дві пробірки по 5 мл дистильованої
води і додати в кожну з них по 2 краплі
метилоранжу. Одну з пробірок залишити
як контрольну. Для порівняння кольору
в другу пробірку додати одну краплю
концентрованої оцтової кислоти
![]() Відзначити зміну кольору в другій
пробірці. Розділити вміст другої пробірки
навпіл і до однієї частини додати трохи
кристалічного ацетату натрію
Відзначити зміну кольору в другій
пробірці. Розділити вміст другої пробірки
навпіл і до однієї частини додати трохи
кристалічного ацетату натрію
![]() добре перемішати і порівняти колір
розчинів у всіх трьох пробірках.
добре перемішати і порівняти колір
розчинів у всіх трьох пробірках.
2.
Налити в дві пробірки по 5 мл дистильованої
води і додати в кожну з них по 2 краплі
фенолфталеїну. Одну з пробірок залишити
як контрольну для порівняння кольору,
в другу додати одну краплю концентрованого
розчину гідроксиду амонію![]() .
Відзначити зміну кольору в другій
пробірці.
.
Відзначити зміну кольору в другій
пробірці.
Розлити
вміст другої пробірки навпіл і до однієї
частини додати трохи кристалічного
хлориду амонію
![]() ,
добре перемішати і порівняти колір
розчинів у трьох пробірках.
,
добре перемішати і порівняти колір
розчинів у трьох пробірках.
Дослід 2. Реакції в розчинах електролітів.
1. У пробірку налити 2-3 мл розчину нітрату калію і додати туди стільки ж розчину хлориду натрію. Відзначити, що відбувається.
2. Налити в одну пробірку 2 мл розчину сульфату магнію, в другу стільки ж розчину сульфату хрому, в третю – сірчаної кислоти. У кожну з пробірок додати по 3 мл хлориду барію. Відзначити, що відбувається.
3. Налити в одну пробірку 2 мл розчину сульфату хрому, в другу стільки ж розчину хромату калію і додати в кожну з них по кілька крапель розчину гідроксиду калію. Відзначити, що відбувається в кожній пробірці.
4. Налити в пробірку 2 мл розчину карбонату натрію і додати туди стільки ж розчину соляної кислоти. Відзначити, що відбувається.
Оформлення результатів роботи
Дослід 1.Написати рівняння дисоціації оцтової кислоти і гідроксиду амонію, вираз швидкостей прямої і зворотної реакцій, а також констант дисоціації для вказаних рівноважних систем. Записати рівняння дисоціації ацетату натрію і хлориду амонію.
Зробити висновок щодо причини зміни забарвлення розчинів.
Зробити загальний висновок про вплив додання однойменного іону на дисоціацію слабкого електроліту.
Дослід 2. Написати рівняння реакцій в молекулярній та іонній формах.
На якій основі можна зробити висновок про те, що реакції в розчинах електролітів відбуваються між іонами, а не між молекулами? Пояснити, в яких випадках відбуваються реакції в розчинах електролітів.
Питання для самоперевірки
Що таке електроліти та неелектроліти?
Який процес називається електролітичною дисоціацією?
Що таке ступінь та константа дисоціації? Від яких факторів вони залежать?
За якою ознакою електроліти поділяють на слабкі та сильні?
В яких випадках можуть відбуватися реакції в розчинах електролітів?
Написати рівняння ступінчатої дисоціації сірководневої кислоти і вираз для констант дисоціації.
Лабораторна робота № 8
