
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Хімічна кінетика та рівновага основні поняття та визначення
|
Хімічна кінетика |
- розділ хімії, в якому вивчається швидкість перебігу хімічних реакцій, залежність швидкості від різних факторів і механізми хімічних процесів.
|
|
Швидкість хімічної реакції (V)
|
- зміна кількості речовини за одиницю часу в одиниці об’єму (для гомогенних реакцій) або на одиниці площі поверхні поділу фаз (для гетерогенних реакцій). |
|
Гомогенні реакції |
- реакції, які відбуваються в одній фазі. |
|
Гетерогенні реакції
|
- реакції, які відбуваються на межі поділу фаз. |
|
Фактори, які визначають швидкість реакції |
- природа реагуючих речовин, їхня концентрація, тиск, температура, присутність каталізатора, властивості розчинника (для розчинів), площа поверхні дотику (для гетерогенних процесів).
|
|
Закон діючих мас |
-
швидкість хімічної реакції при сталій
температурі пропорційна добутку
концентрацій (С) реагуючих речовин у
степенях, що дорівнюють стехіометричним
коефіцієнтам. Для реакції
|
|
Константа швидкості (k)
|
- швидкість реакції за умови, що концентрації кожної з реагуючих речовин або їхній добуток дорівнюють 1 моль/л. |
|
Правило Вант-Гоффа |
- з підвищенням температури на кожні 100С (або 10К) швидкість більшості гомогенних реакцій збільшується у 2-4 рази.
γ – температурний коефіцієнт реакції, який показує, у скільки разів зростає швидкість реакції з підвищенням температури на 100С (або 10К).
|
|
Оборотні реакції |
- реакції, які одночасно відбуваються у двох взаємно протилежних напрямках.
|
|
Хімічна рівновага
|
- стан системи, за якого швидкість прямої реакції дорівнює швидкості зворотної реакції. |
|
Константа хімічної рівноваги К |
-
відношення константи швидкості прямої
реакції kпр
до константи швидкості зворотної
реакції kзв,
або відношення добутку
рівноважних концентрацій продуктів
реакції до добутку рівноважних
концентрацій вихідних речовин у
степенях, що дорівнюють їхнім
стехіометричним коефіцієнтам:
|
|
Зміщення хімічної рівноваги
|
- перехід реакційної системи з одного стану рівноваги в інший. |
|
Принцип Ле Шательє |
- якщо умови, за яких система знаходиться в рівновазі змінити, рівновага зміщується в напрямку процесів, які протидіють цій зміні. |
Приклади виконання завдань
Приклад 1. Написати вирази швидкостей прямої та зворотної реакцій
![]() .
.
Відповідь. Відповідно до закону діючих мас швидкість реакції прямо пропорційна добутку концентрацій реагуючих речовин у степенях, що дорівнюють стехіометричним коефіцієнтам:
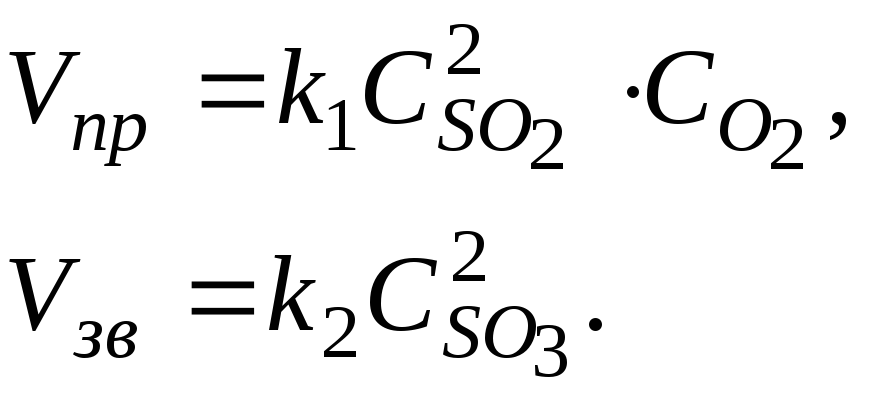
Приклад 2.
Як зміниться швидкість
прямої реакції
![]() ,
якщо збільшити тиск у 3 рази?
,
якщо збільшити тиск у 3 рази?
Розв’язання. Припустимо, що концентрації реагуючих речовин до збільшення тиску становили:
![]() .
.
Швидкість реакції до підвищення тиску виражається рівнянням:
![]() .
.
Збільшення тиску в 3 рази призводить до зменшення об’єму в 3 рази, що в свою чергу збільшує концентрації обох речовин у 3 рази.
Таким чином, після збільшення тиску концентрації речовин стають такими:
![]() .
.
Швидкість реакції після збільшення тиску дорівнює:
![]()
