
- •Міністерство освіти і науки україни
- •Передмова
- •Загальні методичні вказівки
- •Робоча програма
- •Додаткова література
- •Основні поняття та закони хімії основні поняття та визначення
- •Приклади виконання завдань
- •28 Г n2займають об’єм 22,4 л
- •Контрольні завдання
- •Термохімія та термохімічні розрахунки основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: 27822,2 кДж/кг
- •Відповідь: 25,12 кДж.
- •Можливість та напрямленість перебігу реакцій основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Відповідь: - 91,016 кДж
- •Відповідь: -131,58 кДж
- •Відповідь: -1235,18 кДж
- •Відповідь: - 35,75 кДж
- •Відповідь: 313,94 кДж
- •230. Користуючись значеннями стандартних теплот утворення та абсолютних стандартних ентропій, обчислити реакції, що відбувається за рівнянням
- •Хімічна кінетика та рівновага основні поняття та визначення
- •Приклади виконання завдань
- •Швидкість реакції зросла у
- •Контрольні завдання
- •Відповідь: 2,6.
- •Як зміняться швидкості прямої та зворотної реакцій і в якому напрямку зміститься рівновага при збільшенні об’єму системи вдвічі?
- •Розчини основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Властивості розчинів неелектролітів основні поняття і визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Розчини електролітів основні поняття та визначення
- •Приклади виконання завдань
- •У результаті гідролізу в розчині виникає надлишок іонів , які зумовлюють лужне середовище ().
- •Контрольні завдання
- •Будова атома основні поняття та визначення
- •Приклади розв’язання задач
- •Контрольні завдання
- •Періодична система елементів д.І.Менделєєва приклади розв’язання задач
- •Контрольні завдання
- •Хімічний зв’язок основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Окиcно-відновні реакції основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електродні потенціали. Гальванічні елементи основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання. Схема даного гальванічного елемента
- •Контрольні завдання
- •Корозія металів основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Електроліз основні поняття та визначення
- •Приклади виконання завдань
- •Контрольні завдання
- •Метали контрольні завдання
- •Неметали контрольні завдання
- •Твердість води основні поняття та визначення
- •Приклади виконання завдань
- •Розв’язання.Оскільки твердість води показує число ммоль еквівалентів солей в 1 л її, розрахуємо твердість води за формулою:
- •20 (Мг/ммоль).
- •5 (Ммоль е/л).
- •Приклад 3 Визначити масу фосфату натрію, необхідну для пом’якшення 1м3 води з загальною твердістю 8 ммоль е/л.
- •Контрольні завдання
- •2,3 Ммоль е/л.
- •Відповідь: 8 ммоль е/л
- •Неорганічні в’яжучі речовини основні поняття та визначення
- •Контрольні завдання
- •Елементи органічної хімії. Органічні полімерні матеріали основні поняття та визначення
- •Контрольні завдання
- •Правила техніки безпеки та перша допомога в нещасних випадках
- •Деякі основи та їхні залишки
- •Деякі кислоти та їхні залишки
- •Лабораторна робота № 2 визначення молярної маси еквівалента складної речовини
- •Питання для самоперевірки
- •Лабораторна робота № 3 визначення теплових ефектів хімічних реакцій
- •Порядок виконання роботи
- •Хімічна кінетика
- •Хімічна рівновага
- •Лабораторна робота № 6 приготування розчину даної концентрації і встановлення його титру
- •Питання для самоперевірки
- •Лабораторна робота № 7 електролітична дисоціація. Реакції в розчинах електролітів
- •Гідроліз солей
- •Лабораторна робота № 9 електрометричне визначення рН розчинів електролітів
- •Оформлення результатів роботи
- •Питання для самоперевірки
- •Адсорбція
- •Дослід 1. Приготування суспензії крейди у воді.
- •2 Процес окиснення
- •1. Які реакції називаються окисно-відновними?
- •Властивості алюмінію та заліза
- •Лабораторна робота № 16 комплексні сполуки
- •Корозія металів
- •Дослід 2. Електрохімічна корозія оцинкованого і лудженого заліза.
- •Визначення карбонатної твердості води
- •Лабораторна робота № 19 визначення агресивного діоксиду вуглецю
- •Визначення процентного вмісту оксидів кальцію та магнію у вапні
- •Обчислити процентний вміст у вапні за формулою:
- •Кремній та його сполуки
- •Спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Для прискореної форми навчання спеціальність 7.092101 “промислове і цивільне будівництво”
- •Спеціальність 7.092108 “теплогазопостачання і вентиляція”
- •Періодична система хімічних елементів д.І.Менделєєва
- •Деякі одиниці міжнародної системи (сі)
- •Значення деяких фундаментальних фізичних сталих
- •Термодинамічні константи деяких речовин
- •Растворимость солей, кислот и оснований в воде
- •Відносна електронегативність деяких елементів (таблиця полинга)
- •Стандартні потенціали металевих і газових електродів
Розчини електролітів основні поняття та визначення
|
Електроліти
|
- речовини, які в розчинах та розплавах розпадаються на іони, внаслідок чого їхні розчини та розплави проводять електричний струм. |
|
Електролітична дисоціація (або іонізація)
|
- процес розщеплення електролітів на іони в середовищі полярних розчинників. |
|
Ступінь електролітичної дисоціації (α)
|
- відношення числа молекул, які розщепилися на іони (Nдис) до загального числа розчинених молекул (N):
|
|
Сильні електроліти
|
- електроліти, які у
розчинах практично повністю дисоціюють
на іони; для них
|
|
Слабкі електроліти
|
- електроліти, які
під час розчинення у воді лише частково
дисоціюють на іони, а основне число
їхніх молекул перебуває в розчині в
недисоційованому стані; для них
|
|
Кислоти
|
- електроліти, що
дисоціюють з відщепленням іонів
|
|
Основи
|
- електроліти, що
дисоціюють з відщепленням іонів
|
|
Амфотерні електроліти
|
- електроліти, які дисоціюють і як кислоти, і як основи. |
|
Константа дисоціації (Кд) |
- константа рівноваги для оборотного процесу дисоціації слабкого електроліту
де
|
|
Закон розведення Оствальда
|
- при розведенні розчинів слабких електролітів ступінь дисоціації збільшується
|
|
Іонний добуток води
|
- добуток концентрацій
іонів
|
|
Водневий показник (рН)
|
- від’ємний десятковий логарифм молярної концентрації іонів Н+ в розчині
|
|
Гідроксидний показник (рОН)
|
- від’ємний десятковий
логарифм молярної концентрації іонів
|
|
Скорочені іонні рівняння
|
- рівняння реакцій, в яких сильні розчинні електроліти записують у вигляді іонів, а слабкі розчинні електроліти, важкорозчинні та газоподібні речовини – у молекулярній формі. |
|
Гідроліз солей |
- реакція обмінної взаємодії між водою і розчиненими в ній солями, що супроводжується зміною рНсередовища внаслідок утворення слабкої кислоти (її кислої солі) або слабкої основи (її основної солі). |
Приклади виконання завдань
Приклад 1. Визначити ступінь дисоціації вугільної кислоти за першим ступенем у 0,1 М розчині, якщо константа дисоціації для цього ступеня дорівнює 4,5·10 -7.
Розв’язання. Константа дисоціації і ступінь дисоціації слабкого електроліту зв’язані між собою співвідношенням (закон розведення Оствальда):
![]() ,
,
де
![]() -
константа дисоціації;С – концентрація
електроліту, (моль/л).
-
константа дисоціації;С – концентрація
електроліту, (моль/л).
Для розчинів слабких
електролітів, які дуже малою мірою
дисоціюють на іони, ступінь електролітичної
дисоціації набагато менший одиниці
(![]() ).
Тому рівняння закону розведення Оствальда
можна спростити (оскільки за таких умов
).
Тому рівняння закону розведення Оствальда
можна спростити (оскільки за таких умов![]() ):
):
![]() ,
,
звідки
![]() .
.
Вугільна кислота дуже слабка, тому для обчислення ступеня дисоціації скористаємося спрощеним виразом закону розведення
![]() .
.
Відповідь. Ступінь дисоціації вугільної кислоти за першим ступенем дорівнює 6,7·10-3або 0,67%.
Приклад
2. Визначити концентрацію
іонів
![]() в 0,1 М розчині гідроксиду амонію, якщо
Кдис=1,77·10
-5.
в 0,1 М розчині гідроксиду амонію, якщо
Кдис=1,77·10
-5.
Розв’язання.
Концентрація іонів
![]() в розчині електроліту
залежить від молярної концентрації
електроліту СМ,
ступеня його дисоціації α
і числа іонів
n
даного виду, що утворюються при дисоціації
електроліту, тобто
в розчині електроліту
залежить від молярної концентрації
електроліту СМ,
ступеня його дисоціації α
і числа іонів
n
даного виду, що утворюються при дисоціації
електроліту, тобто
![]()
Для
визначення концентрації іонів
![]() в розчині
в розчині![]() спочатку знаходимо ступінь дисоціації
спочатку знаходимо ступінь дисоціації![]() :
:
![]() .
.
Запишемо
рівняння дисоціації
![]() :
:
![]() .
.
Оскільки
з одного моль
![]() утворюється 1 моль іонів
утворюється 1 моль іонів![]() ,
то концентрація іонів
,
то концентрація іонів![]() дорівнює
дорівнює
![]() (моль/л).
(моль/л).
Відповідь: 1,33·10-3 моль/л.
Приклад 3. Скласти молекулярні і іонні рівняння реакцій взаємодії між хлоридом барію та сульфатом натрію.
Відповідь. Обмінні реакції між електролітами необоротні і відбуваються до кінця в таких випадках, коли утворюються малорозчинні або газоподібні речовини, а також слабкі електроліти.
В іонних рівняннях сильні електроліти записують у вигляді іонів, на які вони дисоціюють, а малорозчинні і газоподібні речовини, а також слабкі електроліти – у вигляді молекул.
1. Складаємо рівняння реакції в молекулярній формі:
![]()
2. Речовини
![]() і
і![]() - розчинні у воді солі, які практично
цілком дисоціюють на іони, тому в іонному
рівнянні ці речовини слід зобразити у
вигляді іонів, на які вони дисоціюють.
Сіль
- розчинні у воді солі, які практично
цілком дисоціюють на іони, тому в іонному
рівнянні ці речовини слід зобразити у
вигляді іонів, на які вони дисоціюють.
Сіль![]() практично нерозчинна у воді, тому її
формулу залишаємо без змін. Тоді маємо:
практично нерозчинна у воді, тому її
формулу залишаємо без змін. Тоді маємо:
![]()
3. Виключаємо з
правої та лівої частин однакові кількості
однойменних іонів (![]() і
і![]() )
і одержуємо рівняння реакції в скороченій
іонній формі:
)
і одержуємо рівняння реакції в скороченій
іонній формі:
![]() .
.
Приклад 4. Скласти два різних рівняння в молекулярній формі, які відповідають рівнянню в скороченій іонній формі:
![]()
Відповідь. 1. Запишемо під формулами іонів лівої частини рівняння такі іони протилежного заряду, які б утворювали з вихідними іонами розчинні сильні електроліти (дописані іони мають утворювати розчинний сильний електроліт також між собою). Такі самі іони записуємо під формулами іонів правої частини рівняння:
2. Підсумовуючи обидва рівняння, одержуємо рівняння в іонній формі:
![]() .
.
3. Об’єднуючи іони, записуємо рівняння в молекулярній формі:
![]() .
.
4. Підбираємо інші відповідні іони й одержуємо друге рівняння реакції:
![]()
![]()
![]()
або
![]() .
.
Приклад 5. Між
якими з наведених речовин відбуватиметься
реакція обміну в розчині:а)![]() б)
б)![]() .
.
Відповідь. а) Реакція
між розчинами![]() і
і![]() в молекулярній формі виражається
рівнянням
в молекулярній формі виражається
рівнянням![]()
Оскільки всі солі, що приймають участь у цій реакції – сильні електроліти, то в іонному вигляді рівняння реакції можна записати так:
![]()
Як
показує це рівняння, в розчині утворюється
тільки суміш іонів
![]() При зливанні розчинів
При зливанні розчинів![]() і
і![]() не утворюється ані малорозчинних або
газоподібних речовин, ані слабких
електролітів. Тому між
не утворюється ані малорозчинних або
газоподібних речовин, ані слабких
електролітів. Тому між![]() і
і![]() реакція не відбувається.
реакція не відбувається.
б) При зливанні
розчинів
![]() та
та![]() утворюється малорозчинна сіль
утворюється малорозчинна сіль![]() :
:
![]() .
.
В іонному вигляді це рівняння записується так:
![]()
Концентрації
іонів
![]() та
та![]() в процесі реакції залишаються незмінними,
тому з рівняння реакції їх можна
виключити. Тоді рівняння матиме вигляд:
в процесі реакції залишаються незмінними,
тому з рівняння реакції їх можна
виключити. Тоді рівняння матиме вигляд:![]() Таким чином, реакція відбувається між
іонами
Таким чином, реакція відбувається між
іонами![]() з утворенням осаду
з утворенням осаду![]() .
.
Приклад 6. Скласти молекулярні і іонні рівняння реакцій взаємодії між: а) гідроксидом амонію і соляною кислотою; б) гідроксидом цинку і гідроксидом натрію.
Відповідь. Якщо вихідними речовинами реакції є малорозчинні речовини або слабкі електроліти, то крім реакцій зв’язування тих чи інших іонів відбуваються реакції поступової дисоціації слабкого електроліту або переходу іонів малорозчинної сполуки в розчин
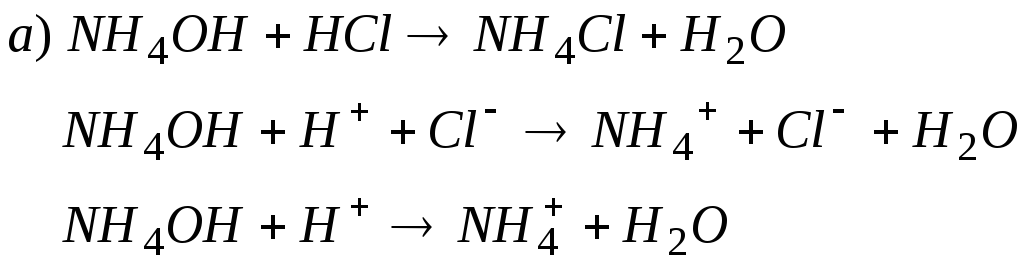

Приклад 7. Визначити
концентрацію іонів
![]() і
і![]() 0,01
М розчину гідроксиду натрію, якщо ступінь
дисоціації
0,01
М розчину гідроксиду натрію, якщо ступінь
дисоціації![]() .
.
Розв’язання. Запишемо рівняння дисоціації гідроксиду натрію
![]()
Із рівняння
дисоціації видно, що з 1 моль
![]() утворюється 1 моль іонів
утворюється 1 моль іонів![]() ;
отже концентрація іонів
;
отже концентрація іонів![]() в 0,01 М розчині
в 0,01 М розчині![]() дорівнює:
дорівнює:
![]() моль/л.
моль/л.
Виходячи з
іонного добутку води
![]() ,
знаходимо концентрацію іонів водню:
,
знаходимо концентрацію іонів водню:
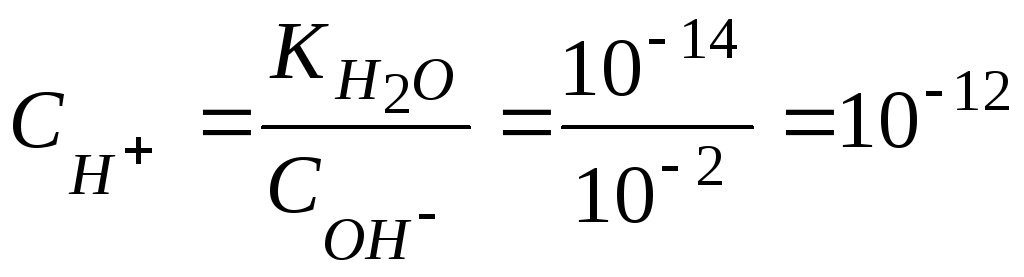
Водневий показник
розчину
![]() дорівнює:
дорівнює:
![]() .
.
Приклад 8.
Визначити рН 0,17 М розчину
![]() ,
константа дисоціації якої дорівнює
1,75·10-5.
,
константа дисоціації якої дорівнює
1,75·10-5.
Розв’язання. Кислотність даного розчину обумовлена дисоціацією кислоти
![]()
Константа і ступінь дисоціації слабкого електроліту зв’язані між собою співвідношенням
![]() .
.
Визначаємо концентрацію іонів
![]() :
:
![]() .
.
Звідси водневий
показник розчину
![]() дорівнює:
дорівнює:
![]() .
.
Приклад
9. Скласти молекулярні
та іонні рівняння гідролізу солей:
![]() .
.
Відповідь.
а) Ціанід калію –
сіль, утворена слабкою одноосновною
кислотою
![]() та сильною однокислотною основою
та сильною однокислотною основою![]() .
При розчиненні у воді молекули
.
При розчиненні у воді молекули![]() повністю дисоціюють на катіони
повністю дисоціюють на катіони![]() та аніони
та аніони![]() .
Катіони
.
Катіони![]() не можуть зв’язувати іони
не можуть зв’язувати іони
![]() води, бо
води, бо
![]() ─
сильний електроліт. Аніони
─
сильний електроліт. Аніони![]() зв’язують іони
зв’язують іони![]() води, утворюючи молекули слабкого
електроліту
води, утворюючи молекули слабкого
електроліту![]() .
Сіль гідролізує за аніоном. Скорочене
іонне рівняння гідролізу:
.
Сіль гідролізує за аніоном. Скорочене
іонне рівняння гідролізу:
![]()
Додаючи до правої і лівої частин рівняння іони калію, одержуємо повне іонне рівняння реакції:
![]()
Рівняння реакції гідролізу в молекулярній формі:
![]() .
.
