
- •0,5% Раствор гидрокарбоната натрия внутрь по 1 ч. Л. Х 3 раза в день
- •6) Дать рекомендации по уходу, режиму и вскармливанию.
- •10. Афо костной системы у детей. Рост и формирование скелета. Порядок и сроки прорезывания зубов молочных и постоянных.
- •7. Афо почек у детей. Количество и состав мочи у детей различного возраста, методы исследования функции почек.
- •0,5% Раствор гидрокарбоната натрия внутрь по 1 ч.Л. Х 3 раза в день
- •4.1. Геморрагический синдром новорожденных
- •25.О. И хр гипоксия плода и нр. Опр, прич, патоген, клин, Дс. Шкала Апгар. Леч и Дс в о и востановит периоде.
- •I группа-дети с риском развития патологии цнс
- •3) По распространенности — локализованное, диссеминированное. Одновременно целесообразно выделение стадий по Мачабели.
3) По распространенности — локализованное, диссеминированное. Одновременно целесообразно выделение стадий по Мачабели.
|
Показатели и их нормальные величины у взрослых и детей старше 1 года |
Нормальные величины у здоровых доношенных новорожденных |
Геморрагическая болезнь новорожденных (витамин-К-дефицит) |
Патология печени (печеночная коагулопатия) |
ДВС-синдром (II, III стадии) |
Тромбоцитопения без ДВС |
Гемофилия |
|
Количество тромбоцитов (200-400х109/л) |
150-400х109 |
Нормальное |
Нормальное |
Снижено |
Снижено |
Нормальное |
|
Протромбиновое время (12-14 с) |
13-16 |
Увеличено |
Увеличено |
Увеличено |
Норма |
Норма |
|
Тромбиновое время (10—12 с) |
0-16 |
Нормальное |
Увеличено |
Увеличено |
Норма |
Норма |
|
Парциальное тромбопластиновое время (35—45 с) |
45-65 |
Увеличено |
Увеличено |
Увеличено |
Норма |
Увеличено |
|
Фибриноген (2,5-4,0 г/л) |
1,5-3,0 |
Норма |
Норма или немного снижен |
Снижен |
Норма |
Норма |
|
ПДФ (0,7 мг/мл) |
0-7 |
Норма |
Норма или немного выше |
>10 мг/мл |
Норма |
Норма |
Диагноз Распознание стадии гиперкоагуляции возможно лишь при лабораторном исследовании на основании укорочения времени свертывания венозной крови (норма 4-8 мин), времени рекальцификации (норма 80-120 с); могут быть повышены уровни тромбоцитов, фибриногена и других факторов свертывания, положительны тесты паракоагуляции (этаноловый и протаминсульфат-ный), снижена активность свободного гепарина. Во II стадии закономерным изменением общих коагуляционных тестов является их разнонаправленность, но типичным является увеличение времени активированного парциального тромбопластинового, протромбинового и тромбинового тестов, тромбоцито-пения, спонтанная агрегация тромбоцитов, положительные тесты на наличие продуктов паракоагуляции (этаноловая и протаминсульфатная пробы) и растворимые комплексы фибрин-мономера, повышение уровня ПДФ в сыворотке крови и снижение уровня антитромбина III. В III стадии ДВС-синдрома дефицит факторов свертывания в крови резко выражен (особенно фибриногена и факторов V, VIII, XIII), резко повышены фибринолитическая активность и время свертывания венозной крови, имеется глубокая тромбоцитопения, а увеличенное тромбиновое время не корригируется добавлением плазмы здорового донора. Очень характерно наличие в мазке венозной крови шиловидных, фрагментированных эритроцитов (шистоциты). Этот признак всегда есть у больных ГУС и ТТП.
Лечение Сводят прежде всего к терапии тех заболеваний и состояний, которые привели к ДВС-синдрому: инфекции, шока, ацидоза, гипоксии и др. Как правило, прибегают к инфузионной терапии. Показаны антиагреганты (курантил, трен-тал), инотропные препараты. Если устранить причину ДВС не удается и поступление тромбопластина в кровь продолжается, или имеются клинические доказательства развития тромбозов, целесообразно назначить гепарин в дозе 10-15 ЕД/кг в час внутривенно капельно или 200-300 ЕД/кг в сутки, разделив дозу на 4-6 инъекций под кожу живота. Контролируют гепаринотерапию, определяя каждые 4 ч активированное частичное (парциальное) тромбоплас-тиновое время (АЧТВ), поддерживая его на величинах в 1,5-2 раза больших, чем в норме (или до начала гепаринотерапии у больного). Если АЧТВ избыточно удлинено — дозу гепарина снижают, если нормализуется — дозу увеличивают.
В зарубежной литературе, тем не менее, подчеркивают, что гепарин надо применять лишь при строго лабораторно доказанном ДВС-синдроме и клинически доказанных тромбозах и лишь после переливания свежезамороженной плазмы как источника антитромбина III. Указывают также на то, что в мировой литературе нет публикаций о рандомизированных исследованиях, доказывающих пользу гепаринотерапии при остром ДВС-синдроме. Эффективность гепарина отмечалась, в основном, при самоограничивающемся ДВС-синдроме, который разрешается спонтанно. Гепарин может повысить склонность к возникновению кровотечений. В последние годы стали применять низкомолекулярные гепарины, но тактика лечения ими при ДВС-синдроме у детей пока не разработана. Есть публикации о пользе плазмафереза, плазмацитофе-реза на начальных стадиях острого ДВС-синдрома при тяжелых токсикозах.
ТТП и ГУС основой лечения должна быть не гепаринотерапия, а плазмаферез и/или переливания свежезамороженной плазмы, назначение преднизолона, дезагрегантов (дипиридамол, ацетилсалициловая кислота и др.). Дозы свежезамороженной плазмы могут быть очень велики, вплоть до 50 мл/кг в сутки, но в таких случаях все же лучше использовать плазмаферез. При неэффективности указанной терапии рекомендуют добавлять к ней винкристин. Эффект винкристина — в нарушении функции тромбоцитов и влиянии на иммунопатологический процесс. Трансфузии тромбоцитной массы при ТТП не рекомендуют.
Прогноз зависит от причины ДВС-синдрома и его тяжести. В литературе есть указания на то, что даже при ТТП при активном переливании свежезамороженной плазмы и повторных плазмаферезах со свежезамороженной плазмой в сочетании с преднизолонотерапией летальность составляет около 10%.
ГЕМОРРАГИЧЕСКИЙ СИНДРОМ У НОВОРОЖДЕННЫХ
Гемостаз - биологическая система, обеспечивающая с одной стороны жидкое состояние крови, а с другой - предупреждение и остановку кровотечений путем поддержания целостности сосудистой стенки и быстрого тромбирования ее при повреждениях. Основными функционально-структурными компонентами системы гемостаза являются:
сосудистая стенка, в особенности ее эндотелиальная выстилка и субэндотелий
клетки крови - тромбоциты
плазменные ферментные системы - свертывающая, фибринолитическая, калликреин-кининовая, комплемента
Гемостаз подчинен нейрогуморальной регуляции и обладает способностью к саморегуляции, то есть к самоактивации и самоограничению.
По современным представлениям, свертывание крови - цепная ферментная реакция, в которой происходит взаимодействие и последовательная активация ряда ферментов на фосфолипидных матрицах. Она делится на следующие фазы:
- Образование активного тромбопластина - осуществляется двумя путями: а) внешним (тканевым) путем - происходит при освобождении и поступлении в кровь тканевого тромбопластина, на котором активируются VII и X факторы. Длительность этого пути 20-40 секунд. В лабораторных условиях этот путь оценивается протромбиновым тестом Квика (ПТ). б) внутренним (кровяным) путем - от контактной активации XII фактора при повреждении эндотелия сосудов до образования активного X фактора с участием плазменных факторов XI, VIII, V. Длительность его 5-7 минут. Этот путь оценивается в лабораторных условиях временем свертывания цельной крови или более чувствительным микрокоагуляционным тестом (МКТ). После образования этого комплекса внешний и внутренний пути свертывания совпадают, взаимодействуя между собой, причем VII фактор занимает одно из центральных мест. I фаза свертывания заканчивается образованием активного X фактора.
- Образование активного тромбина из протромбина под влиянием активированного X фактора в присутствии ионов кальция. Длительность этого этапа около 10 секунд.
- Образование фибрина ферментным (тромбин отщепляет от фибриногена пептиды с образованием фибрин-мономеров и активацией VIII и V факторов), а затем неферментным этапом (полимеризация фибрин-мономеров под влиянием ионов кальция и XIII фактора). Длительнсоть этапа около 5 секунд.
- Ретракция (уплотнение) фибринового сгустка
- Фибринолиз - ферментная реакция, направленная на лизис (асептическое растворение сгустка) и деградацию фибрина под влиянием активного фермента и плазмина. При расщеплении молекулы фибрина образуются продукты деградации фибрина (ПДФ), оказывающие антикоагулянтное действие. Низкомолекулярные ПДФ угнетают адгезивно-агрегационные свойства тромбоцитов.
В периоде новорожденности система гемостаза имеет свои особенности (см. тему «Геморрагическая болезнь»), поэтому новорожденные могут быть склонны как к тромбозам, так и к геморрагиям. Особенности гемостаза новорожденных являются проявлением физиологической нормы, необходимой для жизнедеятельности в этом периоде, и не являются проявлением неполноценности системы гемостаза.
Согласно классификации Гладера (1976 г.), у новорожденных выделяют первичные и вторичные геморрагические расстройства:
Первичные отмечаются у клинически здоровых детей (доношенных и недоношенных I степени). К ним относятся геморрагическая болезнь новорожденных, наследственные коагулопатии, врожденные и наследственные тромбоцитопенические пурпуры и врожденные медикаментозные тромбоцитопатии.
Вторичные (симптоматические) геморрагические расстройства обусловлены асфиксией плода, недоношенностью, инфекционно-септическими заболеваниями, респираторным дистресс-синдромом и вторичной тромбоцитопенией потребления. К ним относятся ДВС-синдром, геморрагический синдром при инфекциях, гепатитах, механических желтухах, интенсивном лечении беременной антикоагулянтами, противосудорожными препаратами, салицилатами и др.
ДВС - синдром
Синдром диссеминированного внутрисосудистого свертывания развивается у новорожденных при тяжелом течение целого ряда патологических состояний - это неспецифический общепатологический процесс с поражением системы микроциркуляции в результате поступления в кровяное русло активаторов свертывания крови (тканевого тромбопластина, тромбина) с одновременным истощением и активацией плазменных ферментных систем (антитромбина III, протеинов C и S, ингибиторов фибринолиза). В результате срыва регуляторных механизмов поддержания жидкого состояния крови происходит преобладание процессов микротромбирования с потреблением в них прокоагулянтов и тромбоцитов, патологическим фибринолизом и одновременное развитие кровоточивости из-за дефицита гемостатических факторов. Возникает блокада микроциркуляторного русла с последующей гипоксией, ацидозом и нарушением функции внутренних органов.
Причины ДВС-синдрома следующие:
активация свертывания, обусловленная
активацией тромбоцитарного звена (повышение агрегации тромбоцитов медикаментами, при гипоксии, местной механической ишемии, сосудистой катетеризации, гемодиализе, артерио-венозном шунтировании, при шоке любой этиологии, сладж-синдроме при сепсисе, сердечно-сосудистом коллапсе, переливании несовместимой крови, некротизирующем энтероколите)
активацией внешнего пути свертывания (попадании в циркуляцию большого количества тканевого тромбопластина при ожогах, операциях на паренхиматозных органах, массивных трансфузиях, осложненных родах - предлежании и отслойке плаценты, внутриутробной смерти одного из плодов, эклампсии, эмболии околоплодными водами, а также при прорыве гнойных очагов в кровь).
активацией внутреннего пути свертывания (хронических и затяжных инфекциях с повреждением сосудов).
уменьшение антикоагулянтного потенциала (при длительном применении больших доз гепарина, врожденном дефиците антитромбина III).
Предрасполагающие факторы к развитию ДВС-синдрома у новорожденных следующие: низкая способность РЭС удалять из крови активированные факторы свертывания и ПДФ, незрелость белково-синтетической функции печени по синтезу прокоагулянтов и антикоагулянтов, трудность поддержания адекватной перфузии в мелких сосудах.
ДВС-синдром рассматривается как непосредственная причина смерти у 75% новорожденных, а летальность при нем достигает 70-90%, особенно среди недоношенных детей. У недоношенных детей выявляются очень низкие уровни протромбина и плазминогена.
Классификация ДВС-синдрома:
Стадийность процесса (по М.С. Мачабели)
Стадия гиперкоагуляции
Стадия нарастающей коагулопатии потребления и фибринолитической активности
Стадия афибриногенемии и патологического фибринолиза
Восстановительная стадия (но паренхиматозные поражения могут стать причиной гибели)
По течению - острое, подострое (несколько недель), хроническое (несколько месяцев)
По распространенности - локальный и диссеминированный.
А.В. Папаян и Э.К. Цыбулькин предложили рассматривать периоды гемокоагуляционных сдвигов в комплексе с изменениями сосудистого компонента системы микроциркуляции:
компенсированная стадия включает гиперкоагуляцию крови (I стадия) с явлениями централизации кровообращения
субкомпенсированная стадия - стадия коагулопатии потребления (II стадия) с переходными изменениями периферической гемодинамики
декомпенсированная стадия - стадия афибриногенемии (III стадия) с явлениями децентрализации кровообращения.
ДВС-синдром является компонентом синдрома системной воспалительной реакции как инфекционной, так и неинфекционной патологии. Выделяют 3 варианта неонатального ДВС-синдрома: гипоксического, септического, операционного генеза. При всех вариантах ДВС-синдрома на фоне массивного и чрезмерного образования тромбина и плазминогена, патологического фибринолиза происходит «протеолитический взрыв», поражение сосудистого эндотелия, блокада микроциркуляции тромбами, гипоксия и деструкция клеток органов, то есть формирование полиорганной недостаточности.
Клиника.
Клиническая картина специфических черт не имеет и зависит от причины, приведшей к ДВС-синдрому, стадии заболевания и степени декомпенсации периферического кровотока.
Типичные геморрагические расстройства следующие:
длительные кровотечения из мест инъекций, венепункций, хирургических травм с одновременным тромбированием иглы или катетера в вене
разной степени выраженности кожный геморрагический синдром (от петехий до экхимозов)
спонтанные кровотечения (из носа, легких, пупочной ранки, мелена) и кровоизлияния во внутренние органы и мозг
тромбозы сосудов с последующим некрозом тканей (кожи, почек, надпочечников)
В генезе кровоточивости при ДВС-синдроме сочетаются два типа кровоточивости - петехиальный из-за нарушений в тромбоцитарном звене и гематомный из-за нарушений плазменного звена гемостаза.
Общепринятым морфологическим критерием ДВС-синдрома является наличие в сосудистом русле (чаще в венах) фибриновых, эритроцитарных и смешанных тромбов. Основными органами-мишенями тромбоза у новорожденных являются легкие, головной мозг, надпочечники, почки, сердце, печень, вилочковая железа, селезенка. В отличие от взрослых у новорожденных почки и селезенка поражаются значительно реже.
Особенностями ДВС-синдрома у новорожденных являются скоротечность, развитие кровоточивости уже в фазе гиперкоагуляции, молниеносность течения и высокая летальность даже при рациональном лечении.
Лабораторная диагностика.
В стадию гиперкоагуляции отмечается
укорочение времени свертывания (менее 4 минут) и времени рекальцификации плазмы (менее 80 секунд)
нормальное или повышенное количество тромбоцитов с увеличением их адгезии
повышение активности факторов свертывания (I, V, VIII, IX, X) со снижением активности свободного гепарина
положительные паракоагуляционные тесты (этаноловый, протаминсульфатный и др.)
фрагментация эритроцитов из-за повреждения их мембраны нитями фибрина
В стадию начавшейся коагулопатии потребления отмечается разнонаправленность коагуляционных тестов
тромбоцитопения на фоне спонтанной их агрегации
снижение уровня факторов свертывания (I, II, V, VIII, XIII) и антитромбина III (природного ингибитора тромбина) на фоне положительных паракоагуляционных тестов
В стадию афибриногенемии отмечается
удлинение времени свертывания цельной крови (удлинение протромбинового и тромбинового времени)
значительное снижение количества тромбоцитов, их повреждение
резкое снижение ряда факторов свертывания (I, II, V, VII, VIII, IX, X, XI, XII) и антитромбина III
положительные паракоагуляционные тесты и большое количество ПДФ (более 10 мг/мл при норме 0,7 мг/мл)
Лабораторные данные при наиболее распространенных приобретенных геморрагических синдромах у новорожденных:
Лечение ДВС-синдрома:
Заключается в обязательном лечении основного заболевания, осложнившегося развитием ДВС-синдрома. Поэтому необходимо следующее лечение:
гипоксемии, ацидоза (кислородотерапия, введение гидрокарбоната натрия),
гиповолемии и анемии (переливание свежезамороженной плазмы, альбумина, физ.раствора, реополиглюкина, гемодеза, эритромассы),
артериальной гипотензии (допамин, глюкокортикоиды),
инфекции (антибиотики, специфическая иммунотерапия),
токсикоза (инфузионная терапия, гемосорбция на фоне антиагрегантов, антикоагулянтов и вазодилятаторов).
Кроме этого, необходимо лечение геморрагического синдрома. Для восполнения дефицита прокоагулянтов, антикоагулянтов, фибринолизинов (так как типичным для ДВС-синдрома у новорожденных является дефицит плазменных факторов, антитромбина III и плазминогена) показаны переливания свежезамороженной или нативной плазмы, альбумина из расчета 10-15 мл/кг капельно 2-3 раза в сутки, введение викасола. В отдельных случаях показаны переливания тромбоцитарной массы.
После восполнения уровня антитромбина III у детей с клиническими признаками развития тромбозов (гангренозно-некротические изменения кожи, ОПН) показана гепаринотерапия. Гепарин (антикоагулянт прямого действия) тормозит все фазы свертывания (препятствует образованию активного тромбопластина, превращению протромбина в тромбин, активирует фибринолитические свойства крови), а также уменьшает агрегацию тромбоцитов и разрушение эндотелия сосудов. Оптимально в/в капельное введение гепарина в дозе 10-15 ЕД/кг/час. Критерием хорошей гепаринизации является увеличение времени свертывания крови в 2—3 раза по сравнению с исходными данными. Если время свертывания не удлиняется, то доза гепарина увеличивается до 25 ЕД/кг/час. Отмена гепаринотерапии производится с постепенным уменьшением дозы в течение 1-2 суток или на фоне назначения тромбоцитарных ингибиторов (ноотропил, никотиновая кислота, дипиридамол).
Для уточнения возможной передозировки гепарина используют протаминсульфатный тест (этот антагонист гепарина нейтрализует отрицательно заряженные сульфогруппы гепарина своими положительно заряженными аминогруппами). Если происходит укорочение времени свертывания крови после добавления в пробирку протаминсульфата, это указывает на передозировку гепарина.
При наличие признаков патологического фибринолиза (лизис тромба чужой крови при добавлении испытуемой несвернувшейся крови) дополнительно вводят ингибиторы фибринолиза. Предпочтение отдается антипротеазам (трасилол, контрикал) по сравнению с - АКК, которая подавляет только фибринолиз без блокады других видов протеолиза, что усиливает нарушения микроциркуляции и тканевую гипоксию. Контрикал вводят в дозе 500 ЕД/кг.
Особо нужно отметить, что при ДВС-синдроме следует избегать в/в введения фибриногена, несмотря на выраженный его дефицит, так как вводимый извне фибриноген может подвергнуться коагуляции, усилить тромбирование сосудов и блокаду микроциркуляции в органах, усилив легочную и почечную недостаточность. Помимо этого, фибриноген в большей степени, чем другие препараты крови, таит в себе опасность заражения больного вирусным гепатитом.
Доказана опасность использования фибринолитических (фибринолизин) и тромболитических (стрептокиназа, урокиназа) препаратов, которые ведут к интенсивной деструкции не только фибрина, но и циркулирующего фибриногена, нарастанию в крови ПДФ, резкому снижению активности V и VIII факторов. Также отказались от переливаний цельной крови, которая усиливает внутрисосудистое тромбообразование.
После купирования геморрагического синдрома начинается поддерживающая терапия антиагрегантами (дипиридамол, курантил, трентал, компламин, эуфиллин, тиклид), антикоагулянтами на фоне адекватной инфузионной терапии для лечения осложнений и компенсации функции пострадавших органов.
Тромбоцитопении
Это частая группа заболеваний и синдромов, при которых кровоточивость обусловлена значительным снижением числа тромбоцитов в крови (менее 150 х 109/л).
В неонатальном периоде их возникновение может быть связано со следующими механизмами:
нарушением образования тромбоцитов в костном мозге (амегакариоцитозы)
повышенным разрушением тромбоцитов антитромбоцитарными антителами (иммунные формы)
повышенным потреблением тромбоцитов при ДВС-синдроме, массивных тромбозах, ИВЛ, гемолитико-уремическом синдроме, синдроме Казабаха-Мерритта, синдроме Вискотта-Олдрича, синдроме Бернара-Сулье, синдроме Мая-Хегглина
вторичные тромбоцитопении при употреблении матерью медикаментов или в результате инфекционных заболеваний, гипоксии, шока
Иммунные тромбоцитопении в периоде новорожденности встречаются чаще других. Различают первичные (у клинически здоровых новорожденных) и вторичные (при гипоксии, ацидозе, инфекциях, шоке). Иммунные тромбоцитопении делятся на 3 группы:
Трансиммунные - возникают вследствие поступления к плоду материнских антитромбоцитарных антител или сенсибилизированных к аутотромбоцитам лимфоцитов от матери, болеющей идиопатической тромбоцитопенической пурпурой, системной красной волчанкой, синдромом Эванса. Чем позднее после рождения появляется кровоточивость, тем легче протекает болезнь.
Изоиммунные (аллоиммунные) - возникают при несовместимости крови плода и матери по тромбоцитарным антигенам (плод имеет отцовский PLA1-антиген). Принципиально механизм развития этой формы тот же, что и при несовместимости по эритроцитарным антигенам (ГБН), но встречается значительно реже, так как 98% всей популяции людей содержат этот тромбоцитарный антиген. Чем позднее после рождения появляется кровоточивость у этих детей, тем он тяжелее протекает.
Гетероиммунные тромбоцитопении обусловлены нарушением антигенной структуры тромбоцитов вирусами, лекарствами, прививочным материалом, которые являясь гаптенами, вызывают выработку антитромбоцитарных антител.
При всех перечисленных формах болезни на фоне гибели тромбоцитов и выработки к ним антител происходит лишение из-за тромбоцитопении эндотелиальных клеток ангиотрофических воздействий. Эндотелий подвергается дистрофии, что ведет к повышению проницаемости сосудов, скоплению эритроцитов вокруг капилляров и образованию петехий. Повышается ломкость сосудов, возникают положительные эндотелиальные пробы, от малейших травм - экхимозы на коже и кровоизлияния на слизистых.
Клинически для всех иммунных форм тромбоцитопений характерен геморрагический синдром по петехиально-пятнистому (микроциркуляторному) типу в виде петехий, экхимозов, кровоизлияний в мозг, на слизистые, из матки, носа, кишечника. Характерными чертами этого геморрагического синдрома являются полихромность, полиморфность, несимметричность и спонтанное их возникновение или после легких травм.
Клинически изоиммунный вариант тромбоцитопении протекает более тяжело, чем трансиммунный: обильный кожный геморрагический синдром часто сочетается с желудочно-кишечными кровотечениями, гематурией, внутричерепными кровоизлияниями и кровоточивостью слизистых.
Лабораторно для всех форм иммунных тромбоцитопений характерно:
увеличение длительности кровотечения (более 4 минут), так как кровотечения капиллярного типа останавливаются за счет первичных тромбоцитарных тромбов
снижение количества тромбоцитов (менее 150 х 109/л)
нормальное время свертывания и рекальцификации плазмы
отчетливое понижение ретракции кровяного сгустка (более 2 часов)
при трансиммунных формах отмечается выявление на поверхности тромбоцитов матери большого количества Ig G или антитромбоцитарных антител, а при изоиммунных формах - выявление антитромбоцитарных антител в сыворотке крови матери при нормальном количестве Ig G на ее тромбоцитах или агглютинацию тромбоцитов ребенка сывороткой крови матери.
Лечение тромбоцитопений.
При изо- и трансиммунных формах новорожденного кормят донорским грудным молоком в течение 2-3 недель, а затем прикладывают к груди под контролем количества тромбоцитов в крови ребенка. При других формах кормят обычно, в соответствии с возрастом ребенка.
При обильном геморрагическом синдроме, кровоточивости слизистых, количестве тромбоцитов 10 х 109/л и менее, кровоизлиянии во внутренние органы рекомендовано назначение с патогенетической целью глюкокортикоидов. Преднизолон назначают в дозе 2 мг/кг на 1-2 недели с дальнейшим снижением дозы препарата и отменой препарата через неделю.
Показания к переливанию тромбоцитарной массы у новорожденных следующие (заседание Европейской школы гематологов. Москва, 1992 год):
число тромбоцитов менее 20 х 109/л
число тромбоцитов менее 50 х 109/л у недоношенных и кровоточащих новорожденных
число тромбоцитов менее 100 х 109/л у больных недоношенных, при инвазивных процедурах, ДВС-синдроме
Новорожденному переливают одну дозу тромбоцитарной массы (30-50 мл тромбоконцентрата), но на длительный эффект от этого переливания рассчитывать не приходится, так как тромбоцит - короткоживущая клетка. В тяжелых случаях рекомендованы заменное переливание крови, плазмоферрез. В последние годы с успехом применяют в/в введения больших доз высокоочищенного -глобулина (Ig G)в дозе 0,4-1,0 г/кг ежедневно в течение 5 дней. Он конкурентно ослабляет действие специфических антител на тромбоциты, повышает эффективность трансфузий тромбоцитарных концентратов.
В большинстве случаев тромбоцитопении протекают лишь с кожными геморрагиями. В таких случаях рекомендована симптоматическая терапия:
-АКК в дозе 0,05 г/кг 4 раза в день (для угнетения фибринолитической активности и снижения проницаемости капилляров).
назначение препаратов, улучшающих адгезивно-агрегационные свойства тромбоцитов: пантотенат кальция 0,01 г х 3 раза в день внутрь, этамзилат натрия (дицинон) 0,05г х 3 раза внутрь, адроксон, АТФ, хлорофиллин натрия, рутин, карбонат лития и другие.
Наследственные тромбоцитопенические пурпуры у новорожденных встречаются редко и связаны с недостаточным образованием тромбоцитов в костном мозге или с их повышенным разрушением.
Гипопластические тромбоцитопенические пурпуры обусловлены изолированной гипоплазией мегакариоцитарного ростка костного мозга (с амегакариоцитозом или мегакариоцитарной гипоплазией), как правило, сочетаются с другими пороками развития (фокомелией или отсутствием лучевых костей - синдром Ландольта). Реже они обусловлены гипоплазией всех ростков кроветворения (апластическая анемия, панцитопения Фанкони, врожденный лейкоз), хромосомными аномалиями - трисомии по 13-15, 18 парам хромосом, сочетающиеся с различными нарушениями пигментации, врожденными аномалиями скелета, глаз, ушей, сердца. Наследование аутосомно-рецессивное. Кровоточивость и тромбоцитопения в типичных случаях появляются в первые дни жизни. Прогноз неблагоприятный: более половины больных умирает в возрасте до года.
Повышенное разрушение тромбоцитов может также происходить, помимо действия антитромбоцитарных антител, вследствие повышенного потребления в тромбах и агрегатах клеток крови (при ДВС-синдроме , болезни Мошковица, гемолитико-уремическом синдроме) или в больших кавернозных гемангиомах (синдром Казабаха-Меррита).
Из наследственных тромбоцитолитических пурпур наиболее изучены синдром Вискотта-Олдрича (рецидивирующие гнойные инфекции, геморрагический синдром из-за тромбоцитопении, экзема), синдром Бернара-Сулье (тяжелая кровоточивость с первых месяцев из-за снижения количества и функциональной активности тромбоцитов), синдром Мая-Хегглина (умеренная кровоточивость на фоне тромбоцитопении).
Указанные синдромы могут проявиться уже в период новорожденности из-за патологических процессов в перинатальном периоде, приводя к появлению кровоточивости у детей с наследственным дефектами тромбоцитов.
Наследственные коагулопатии
Это заболевания, при которых отмечается кровоточивость гематомного или смешанного типа, обусловленная наследственным дефектом или молекулярной аномалией плазменных факторов свертывания. Около 83-90% коагулопатий приходится на две разновидности дефицита VIII фактора - гемофилию А (70%) и болезнь Виллебранда (9-18%), а также на гемофилию В (6-13%). Дефицит факторов VII и V регистируется в 0,5-1,5%, фактора X - в 0,3-0,5% случаев. В периоде новорожденности кровоточивость при наследственных коагулопатиях чаще всего появляется при отсутствии XIII фактора (афибриназемии) в 80-100%, I фактора (афибриногенемии) - в 67%, дефиците X фактора (болезнь Стюарта-Пауэра) - в 39%, дефиците VII фактора (гипоконвертинемии) - в 18%, дефиците VIII, IX, II факторов (гемофилия А, В и гипотромбинемия) - в 10%, дефиците V, XI факторов (гипоакцелеринемия, гемофилия С) - в 5% случаев (Кюнзер В., 1968 г.). Редкому проявлению наследственных гемофилий в периоде новорожденности способствуют гемостатические свойства материнского молока, особенности реактивности организма и гемостаза новорожденных. Однако, любая неонатальная патология (асфиксия, родовая травма, инфекции и др.) увеличивают риск выявления наследственного дефекта гемостаза.
Коагулопатии подразделяют на:
гемофилии - при дефиците факторов I фазы свертывания (VIII, IX, XI ф.)
псевдогемофилии - при дефиците факторов II фазы свертывания (VII, V, XIII, II ф.)
Тяжесть геморрагических проявлений связана с уровнем коагулянтной активности антигемофильных факторов (ВОЗ, 1975 г.):
крайне тяжелое течение - если активность их от0 до1%,
тяжелое течение - активность факторов от1 до 2%,
среднетяжелое течение - активность от 2 до 5%,
легкое течение - активность от 5 до 10-15%,
латентное течение - активность факторов более 15-20%
Клиническая картина.
Общими проявлениями наследственных коагулопатий в периоде новорожденности могут быть длительные кровотечения у здоровых детей после подрезания короткой уздечки языка или обрезания крайней плоти, после инъекций, сильных травм, из пупочной ранки. У таких детей могут выявляться большие кефалогематомы, гематомы в местах инъекций на ягодицах. Для афибриноземии (XIII ф.) типично также медленное заживление пупочной ранки и другие ран с образованием келоидных рубцов. Кровотечения обычно возникают не в момент травмы или операции, а через некоторое время после них и характеризуются длительностью, обильностью и высокой частотой возникновения после нарушения целостности кожи и слизистых. Кровоточивость носит гематомный или смешанный характер и чаще у новорожденных проявляется кефалогематомами, желудочно-кишечными кровотечениями (мелена, кровавая рвота), а в более старшем возрасте - кровоизлияниями в клетчатку, мышцы, полости, суставы, в мозг.
Диагностика наследственных коагулопатий.
Основывается, прежде всего, на семейном геморрагическом анамнезе (кровоточивость по материнской линии по гематомному типу).
При лабораторном исследовании выявляются:
удлинение времени свертывания (более 8 минут) по Ли-Уайту
нормальное количество тромбоцитов
нормальная длительность кровотечения
снижение (менее 50%) уровней факторов свертывания (VIII, IX, XI, XIII и др.)
снижение (менее 80%) потребления протромбина на фоне нормального содержания фибриногена и протромбина (то есть, нарушение I фазы свертывания)
Лечение.
Наличие кровоточивости требует экстренной заместительной терапии. Поэтому еще до окончательного установления вида дефицита приступают к струйному введению нативной или свежезамороженной плазмы, в которой содержатся все факторы свертывания крови ( в том числе VIII, IX, X факторы) в дозе10-15 мл/кг. Однако, эта доза плазмы повышает уровень VIII фактора лишь на 15-20%, что часто недостаточно для остановки кровотечения.
При гемофилии А и болезни Виллебранда более эффективен препарат плазмы - криопреципитат, содержание в котором VIII фактора колеблется от 20 до 50%. Доза криопреципитата 15-50 ЕД/кг в/в струйно 1-2 раза в сутки (сразу после размораживания и без смешивания с другими растворами). Переливание 1 ЕД криопреципитата повышает уровень VIII фактора на 2%.
Доказано, что для остановки и предотвращения «малой» кровоточивости необходимо повышение уровня VIII фактора до 15-20%, а при более выраженной кровоточивости - выше 30-40%.
Ребенку ни при каких обстоятельствах не должны проводиться в/м инъекции, а все хирургические вмешательства должны выполняться под прикрытием антигемофильных препаратов и адекватном лабораторном контроле. Таким детям недопустимо назначение нестероидных противовоспалительных средств, а в качестве жаропонижающего рекомендован парацетамол.
При носовых и желудочных кровотечениях вместе с криопреципитатом используют внутрь -АКК, аналог вазопрессина - адиуретин, а также грудное молоко. Тромбин на место кровотечения на кожу или слизистые. Тугая тампонада носа при носовых кровотечениях не рекомендована.
При тяжелой степени постгеморрагической анемии, снижении уровня гемоглобина менее 70 г/л применяют переливание эритромассы, а в остальных случаях - оральные препараты железа.
Деструктивные пневмонии у детей раннего возраста. Причины, клиника, лечение, неотложная помощь при плевральных осложнениях. Прогноз. . Факторами риска развития деструктивных осложнений являются очагово-сливная пневмония или лобарный пневмонический инфильтрат, особенно слева (без признаков ателектаза), лейкоцитоз (выше 20хЮ9/л), СОЭ более 40 мм в час, анемия, наличие сдвига в лейкоцитарной формуле влево. Из клинических особенностей отмечают выраженную клинику токсикоза: бледность кожных покровов, адинамию, негативизм, полное отсутствие аппетита, тахикардию, стойкую лихорадку более 39 °С. Из лабораторных данных у таких детей в разгаре процесса обнаружили выраженное снижение уровней иммуноглобулинов А и G, признаки угнетения Т-лимфоидной системы. Как правило, при гнойных осложнениях в легких возбудителем пневмонии является стафилококк (реже пневмококк), но в настоящее время все чаще стали выделять палочку сине-зеленого гноя, клебсиеллу, стрептококк и анаэробных возбудителей.
Буллы — воздушные полости, пневмоцеле. Количество полостей обычно 1-5, диаметр их от 0,5 до 5 см, хотя за короткое время количество и размер полостей могут меняться. Чаще эти полости не проявляются какими-либо клиническими симптомами и диагностируются лишь рентгенологически. Обычно буллезные полости на фоне стихания воспалительного процесса в
легких самопроизвольно исчезают на 2-м месяце болезни, но иногда могут прослеживаться на рентгенограмме и спустя 3-4 мес. У некоторых детей из-за затруднения выдоха при нарушении проходимости приводящего бронха полости внезапно увеличиваются в размере за счет клапанного механизма. Клинически в таком случае нарастают симптомы дыхательной недостаточности без усиления явлений интоксикации: ребенок становится беспокойным, у него увеличиваются одышка и цианоз; грудная клетка принимает бочкообразную форму, а половина ее на стороне поражения отстает в акте дыхания. На стороне поражения перкуторно находят высокий тимпанический звук. Аускультативно — ослабление дыхательных шумов. Нередко амфорическое дыхание. Средостение смещено в противоположную половину грудной клетки.
При инфицировании булл или гнойном расплавлении участка инфильтрации легкого развивается абсцесс (реже) или несколько мелких абсцессов легкого (чаще).
Абсцессы легкого. Различаются две фазы процесса:
гнойная инфильтрация и формирование абсцесса;
вскрытие абсцесса в бронх или плевральную полость.
Клинически при формировании абсцесса отмечается ухудшение и без того тяжелого общего состояния больного: нарастают вялость, апатия, анорексия, повышается температура тела, появляются землистая бледность кожи, проливной пот, сухость слизистых оболочек. Заостряются черты лица, появляется одышка с участием вспомогательных мышц в акте дыхания; пульс становится частым, малого наполнения, тоны сердца приглушены. Над очагом поражения при недренирующемся абсцессе перкуторный тон укорочен. Выслушиваются разнокалиберные влажные хрипы. После вскрытия абсцесса в бронх (дренирующий абсцесс) при обследовании находят типичные признаки полости: амфорическое дыхание, звучные влажные хрипы металлического оттенка, тимпанический оттенок перкуторного тона над полостью. Больной откашливает большое количество гнойной мокроты с неприятным запахом. Мокрота при отстаивании принимает двухслойный вид: нижний слой — гомогенный, более густой, верхний — слизисто-пенистый. Дети раннего возраста заглатывают мокроту, поэтому гной у них иногда можно видеть в рвотных массах; типично развитие стафилококковых поражений кишечника. После вскрытия абсцесса общее состояние больного обычно несколько улучшается, уменьшаются лихорадка, явления интоксикации.
Особенно тяжело протекает заболевание при формировании множественных мелких абсцессов в обоих легких. Состояние больного крайне тяжелое, температурная кривая гектического характера, сознание затемнено. Дыхание становится аритмичным, прерывистым, выдох удлиняется, наблюдаются периодические задержки дыхания, имеется упорный, болезненный кашель, нередко сопровождающийся рвотой.
Решающее значение в диагностике абсцессов и булл принадлежит рентгенологическому исследованию. При стафилококковой деструкции легких на рентгенограмме находят (рис. 19) одну или несколько полостей, обычно расположенных субплеврально, четко контурирующихся и имеющих горизонтальный уровень жидкости, который изменяется при перемене положения больного. Для более четкого представления о размерах и месте расположения абсцесса проводят томографическое исследование (эти сведения необходимы для выбора тактики хирургического лечения). В период формирования абсцесса на рентгенограмме видно интенсивное ограниченное гомогенное затемнение. Важно подчеркнуть, что абсцесс легких обычно вызывается анаэробами, такими как бактероиды, фузобактерии, анаэробные стрептококки, хотя у детей раннего возраста он может вызываться и золотистым стафилококком, клебсиеллой. Возбудители у старших детей (пневмококки, анаэробы) иногда хорошо чувствительны к пенициллину, который назначают в дозе 400 000-500 000 ЕД/кг в сутки в течение месяца. При стафилококковой инфекции назначают оксациллин или метициллин (при резистентности — ван-комицин), в сочетании с аминогликозидами (амикацин), клебсиеллезной — цефалоспорины III поколения и уреидопенициллины в сочетании с аминогликозидами. Таким образом, наличие у больного деструктивных изменений в легких требует срочной консультации с детским хирургом, спешить с хирургическим лечением не следует, антибиотикотерапия может быть очень эффективна.
Прогрессирующая медиастинальная эмфизема относится к редким вне-легочным осложнениям деструкции легких. Для нее клинически характерно появление у больного симметричной подкожной эмфиземы в области шеи, лица, плечевого пояса, осиплого голоса, нарастание симптомов дыхательной недостаточности (одышка, цианоз и др.); могут развиваться признаки нарушения гемодинамики. Рентгенологическое исследование подтверждает наличие воздуха в клетчатке средостения, шеи, плеча. При стафилококковой деструкции легкого необходимо использовать разные пути введения антибиотика: внутривенный, внутримышечный, аэрозольный, а по показаниям и местно — в полость плевры или абсцесс. Четкий положительный эффект оказывает при стафилококковой пневмонии применение антистафилококкового иммуноглобулина в дозе 20 АЕ/кг ежедневно или через день, 5-7 инъекций. На высоте тяжелого токсикоза в ряде клиник с успехом используют гемосорбцию и плазмаферез, способствующие удалению токсинов бактерий и возникших в ходе болезни аутотоксических веществ из крови больного.
Благодаря способности подавлять ферментативную активность микроорганизмов и повышать их антибиотикочувствительность, широкое применение при лечении гнойных инфекций нашли ингибиторы протеолиза. С этой целью применяют трасилол в дозе 500-1000 калликреиновых ингибирующих единиц или контрикал в дозе 250-500 антитриптических единиц на 1 кг массы тела внутривенно капельно 2 раза в день на протяжении первых 5-6 дней ежедневно, а в дальнейшем по показаниям.
Больного со стафилококковой деструкцией легких наблюдают совместно педиатр и детский хирург. Тактика хирургов сводится к следующему: при буллах в большинстве случаев хирургической помощи не требуется; напряженные воздушные полости пунктируют и удаляют воздух. При дренирующихся абсцессах, когда ребенок хорошо отхаркивает мокроту, лечебные мероприятия складываются из создания дренажного положения, проведения дыхательной гимнастики, назначения щелочных аэрозолей с антибиотиками 4-6 раз в сутки. При плохо дренирующихся абсцессах показана бронхоскопия с промыванием бронхиального дерева растворами антисептиков или антибиотиков. Большие недренирующиеся абсцессы пунктируют, и полость абсцесса промывают растворами антибиотиков, фурацилина, новоиманина, хлорофиллипта.
При гигантских («провисающих») абсцессах имеется постоянная угроза прорыва его и инфицирования плевральной полости, причем пункция лишь ускоряет этот процесс. Рекомендуют в этих случаях срочное оперативное вмешательство (торакотомия и удаление пораженной доли легкого вместе с абсцессом). При острой прогрессирующей медиастинальной эмфиземе прибегают к экстренной супраюгулярной медиастинотомии.
При всех легочно-плевральных осложнениях требуется экстренная хирургическая помощь: плевральные пункции (эмпиема плевры), дренаж плевральной полости с активной аспирацией содержимого. Детям с напряженным («клапанным») пневмотораксом необходима экстренная помощь уже в терапевтическом отделении: производят прокол грудной стенки толстой инъекционной иглой, тем самым переводя закрытый напряженный пневмоторакс в открытый. Эта простая манипуляция сохраняет жизнь ребенку, позволяет перевести его в хирургическое отделение и приступить к дальнейшему лечению — дренированию плевральной полости или радикальной операции.
ДЗСТ (СКВ, ДЕРМАТОМИОЗИТ, СКЛЕРОДЕРМИЯ, УЗЕЛКОВЫЙ ПЕРИАРТЕРИИТ) КЛИНИКА ДИФДИАГНОЗ, ЛЕЧЕНИЕ, ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ. Склеродермия В основе заболевания лежит поражение соединительной ткани с преобладанием фиброза и сосудистая патология по типу своеобразного облитерирующего эндартериита. Чаще болеют девочки. Этиология заболевания неизвестна. В патогенезе обсуждают два возможных механизма — иммунный и сосудистый. В первом случае образование антител к коллагену вызывает цикличный аутоиммунный процесс, аналогичный другим диффузным заболеваниям соединительной ткани. При сосудистой гипотезе патогенеза основную роль придают измененным эндотелиальным клеткам. Нельзя исключить, что оба механизма могут иметь место при данном заболевании. Классификация Наиболее распространенным является деление склеродермии на: системную; очаговую. Последнюю, в свою очередь, подразделяют на: бляшечную, линейную.
Клиника
Очаговая склеродермия. При бляшечной форме на ранних стадиях наблюдают появление желтовато-розовых эритематозных бляшек, которые эволюционируют в твердые, восковидные или желто-белые (цвета слоновой кости) очаговые поражения, иногда с фиолетовым ободком. Локализация на конечностях и туловище. В начальной фазе быстро появляется линейная конфигурация, которая выглядит как широкая полоса, часто располагаясь вдоль сосудисто-нервного пучка любой из конечностей. Особая локальная форма склеродермии располагается на лбу и волосистой части головы и носит название «удар саблей». Линейная склеродермия не ограничивается поражением только кожи. В патологический процесс вовлекаются все лежащие под ней ткани (клетчатка, мышцы, фасции и даже кости), что приводит к большим деформациям. Поражение лица и головы может сопровождаться увеитом и эпилептическими припадками. Кроме поражения кожи могут наблюдаться артриты с утренней скованностью, ограничением движений, но без выраженных воспалительных изменений, кожные проявления линейной склеродермии могут появляться позднее. Системная склеродермия встречается у детей редко. Начальным проявлением является синдром Рейно, Могут отмечаться и другие проявления: чувство онемения, парастезии конечностей, лица, туловища, особенно после переохлаждений; скованность в кистях, контрактура пальцев рук, чувство дискомфорта в суставах; «необоснованная лихорадка», первоначально субфебрильная; «беспричинная» потеря массы тела.
Диагноз устанавливают, когда появляется диффузное утолщение кожи пальцев кистей и стоп, и эти изменения становятся проксимальными к мето-карпо-, метотарзофалангеальным суставам. Этот признак практически патогномоничен для отличия системной и локальной формы склеродермии. Постепенно развивается диффузное поражение всех кожных покровов, которое сопровождается появлением телеангиоэктазий и подкожных кальцификатов, в пальцах и локтевых суставах. Цвет кожных покровов может меняться от бледного (алебастрового) до коричневого, бронзового. Как правило, в патологический процесс вовлекаются и внутренние органы —эзофагита, фиброз легочной ткани, перикардита и миокардита, поражение почек с развитием злокачественной гипертензии.
Диагноз. При наличии типичных изменений кожи диагноз не труден. В плане дифференциальной диагностики напоминают склеродермию следующие заболевания (состояния) — склеродерма (синдром Чайна—Дола, синдром Бушке). Одномоментное развитие индуративного отека шеи, плечевого пояса, лица, реже туловища, еще реже проксимальных и никогда дистальных отделов конечностей, обратное развитие без атрофии кожи помогает поставить правильный диагноз. Эозинофильный фасциит отличает высокая эозинофилия в крови и в биоптате кожи и подкожной клетчатки, гипергаммаглобулинемия и высокая СОЭ.
Лечение основную терапию ограничивают местным использованием средств, улучшающих микроциркуляцию. Может быть показано использование гепариновой мази, димексида или димексида с добавлением гепарина. При наличии синдрома Рейно и при больших площадях поражения антиагреганты — аспирин в дозах 10-15 мг/кг, курантил, нифедипин. При прогрессировании кожного процесса могут быть использованы глюкокортикоиды в 0,5 мг/кг/сут , возможно применение D-пеницилламина.
СИСТЕМНАЯ КРАСНАЯ ВОЛЧАНКА болеют исключительно девочки. СКВ может наиболее поражаемым явл препубертатный и пубертатный периоды.
Клиник начинается остро с повышения температуры тела, нарушения общего состояния. Характерным для данного заболевания может считаться полисистемность поражения. Изменения со стороны кожи проявляются в разнообразных сыпях по типу аллергических; типичное расположение сыпи на лице в виде бабочки встречается у детей довольно редко. Может наблюдаться полиартрит, по своему характеру приближающийся к ревматическому. Из внутренних органов в патологический процесс наиболее часто вовлекаются почки в виде стойкого нефрита с альбуминурией и гематурией. Нередко наблюдают поражение сердца, поражаться могут все три оболочки — эндокард, миокард и перикард. Более часто отмечается поражение именно перикарда по типу выпотного или фибриноидного перикардита. Наиболее характерное поражение легких — серозный плеврит.
Системная красная волчанка всегда сопровождается высокой лабораторной активностью —повышением СОЭ, диспротеинемией, высоким С-реактив-ным белком и т. д. Часто наблюдается анемия, лейкопения, тромбоцитопения. Даже в ранних стадиях заболевания приблизительно у половины детей в крови обнаруживают LE клетки и практически у всех больных — антинуклеар-ный фактор.
Диагноз СКВ основывают на многосистемности поражения (особенно характерным можно считать сочетание поражения суставов и почек); высокой, плохо поддающейся терапии лабораторной активности, обнаружении в крови LE клеток и антинуклеарного фактора. Дифференциальный диагноз с ревматизмом, субсепсисом Висслера— Фанкони и узелковым периартериитом. Ряд лекарственных препаратов — п\судорожные (фенобарбитал, мезактоин и др.), а\б (сульфаниламиды, изониазид), контрацептивы, а\депрессанты (феноптиазиды), антигипертензивные (гидралазин, хапидин и др.), пеницилламин — могут вызвать СКВ-подобный синдром.
Для постановки диагноза системной красной волчанки у детей в клинической практике могут быть полезны критерии:1-экзантема над скуловой костью, 1-дискойдные изменения кожи (эритематозные изм-я с кератойдными чешуйками, 3-светочувствительность, 4-изьязвления в полости рта, 5-артрит, 6-серозит(плеврит, перикардит), 7-изм-я в почках (протеинурия, цилиндрурия, 8-неврологич растр-ва (судороги, психозы), 9-гематология(гемолит анемия, лейкопения, лимфопения, тр-пения), 10-иммун данные (ЛЕкл, а\т к ДНК), 11-антинуклеарные а\т. Лечение глюкокортикоиды 1-3 мг/кг При положительной динамике со стороны пораженных внутренних органов дозу уменьшают, подбирая ее индивидуально. Отсутствие эффекта от ГКК - применение гормонально-цитостатической терапии. П циклофосфан (3-5 мг/кг массы тела в сутки). При острейшем течении и волчаночных кризах с самого начала показана гормонально-цитостатическая терапия.
ДЕРМАТОМИОЗИТ хар-ся негнойным воспалением поперпол мускулатуры и наличием типичных кожных высыпаний. Клиника— лиловая окраска верхних век (гелиотропные веки), периорбитальная эритема и отечность век и супраорбитальной области, сыпи над межфаланговыми, локтевыми и коленными суставами (симптом Готтрона), вертикальные ногтевые телеан-гиэктазии, реже наблюдаются генерализованные сыпи, артралгии. на частые падения и неустойчивость ребенка, невозможность сделать большой шаг. Острое начало сопр-ся высокой лихорадкой, прострацией. Ха-на выраженная мыш слабость, уплотнение мышц, их болезненность. Наиболее грозным осложнением является поражение мышц нёба и дыхательной мускулатуры с появлением невозможности глотания и резким уменьшением объема экскурсий грудной клетки. При всех вариантах начала в последующем возможна атрофия пораженных мышц и их кальцификация.
повышение СОЭ, лейкоцитоз и др. В связи с поражением мышц в крови повышаются такие ферменты, как КФК и трансаминаза. При ЭМГ признаки миозита. Критерии диагностики дерматомиозита Симметричная проксимальная мышечная слабость, Повышение уровня мышечных энзимов в сыворотке крови, ЭМГ находки, типичные для миозита, Классическая дерматомиозитная сыпь, Типичные для дерматомиозита находки в мышечных биоптатах (мышечную биопсию проводят только при отсутствии 1, 2 или 3 признаков).
Для постановки диагноза требуется наличие основного критерия — характерной сыпи в сочетании с любым из 3 других критериев.
При дифференциальной диагностике наиболее часто приходится встречаться с транзиторными вирусными миозитами. Отсутствие типичных кожных изменений, признаки острого вирусного заболевания, доброкачественное течение позволяют правильно поставить диагноз. Реже затруднения возникают при разграничении дерматомиозита с такими заболеваниями, как миастения, мышечная дистрофия, трихинеллез и др.- Использование выше приведенных критериев позволяет достаточно надежно провести дифференциальную диагностику.
Лечение Препаратом выбора при дерматомиозите является преднизолон, его назначают из расчета 1-2 мг/кг в сутки. Контролем его эффективности является уровень мышечных ферментов и уменьшение клинических проявлений. При остром течении, особенно при поражении мышц нёба и дыхательной мускулатуры, его доза может быть увеличена до 3-5 мг/кг в сутки и даже использована пульс-терапия. При получении эффекта дозу снижают до поддерживающей, которую подбирают индивидуально. Отсутствие эффекта в течение 2-4 нед или поддерживающая доза выше 0,5 мг/кг в сутки служат показанием для назначения цитостатической терапии, из препаратов можно рекомендовать циклофосфан и метотрексат. Для предупреждения контрактур и атрофии с самого начала назначают лечебную физкультуру в виде пассивных, а затем и активных движений.
При поражении мышц нёба пища должна быть жидкой и протертой, в редких случаях показано питание через зонд. При ограничении объема дыхательных движений может быть использована искусственная вентиляция легких.
Узелковый периартериит. Клиника. Начало заболевания обычно острое. Лихорадка носит неправильный характер. У детей различают две формы — кожную и системную. Типичным для первой формы является поражение кожи в виде самых разнообразных высыпаний, чаще геморрагического характера, в последующем на месте поражений могут возникать некрозы, атрофии и даже гангрена. При системной форме наряду с кожными высыпаниями наблюдаются боли в животе, конечностях. Достаточно быстро присоединяется поражение внутренних органов. Характерным является поражение почек в виде гематурической формы нефрита со стойкой гипертензией, вовлечение в патологический процесс сердца (миокардиты), желудочно-кишечного тракта (язвенные поражения с возможными кишечными кровотечениями). Заболевание всегда сопровождается высокой лабораторной активностью.
Дифференциальный диагноз проводят с вторичными системными васку-литами (инфекционные, при злокачественных новообразованиях, гипокомп-лементемии и др.), а также васкулитами при других ревматических заболеваниях, особенно при системной красной волчанке. В дифференциальной диагностике может помочь тот факт, что узелковым периартериитом болеют преимущественно мальчики.
Лечение Препаратом выбора являются кортикостероиды в высоких дозах (2-3 мг/кг в сутки). При присоединении поражения внутренних органов уже на ранних стадиях может быть показано сочетанное использование кортикостероидов и циклофосфана, а также плазмаферез.
Диабетическая кома. Клиника, диагностика, неотложная помошь. Диспансеризация детей, больных диабетом. ДИАБЕТИЧЕСКАЯ КОМА Причины: поздняя госпитализация больного сахарным диабетом; введение инсулина в недостаточной дозе; замена одного из препаратов инсулина на другой;нарушение техники введения инсулина; увеличение потребности в инсулине
Увеличение потребности в инсулине может быть обусловлено следующими факторами: инфекционные заболевания (сепсис, пневмония, синусит, менингит, панкреатит, инфекции мочевыделительной системы), травмы и хирургические вмешательства, стрессы (особенно у подростков), сопутствующие эндокринные заболевания (тиреотоксикоз, синдром Кушинга, акромегалия) а также медикаментозная терапия (глюкокортикостероиды).
Патогенез диабетического кетоацидоза: Дефицит инсулина приводит к гипергликемии, в результате которой развивается дегидратация и происходит потеря электролитов плазмы крови. Усиление процессов гликогенолиза и глюконеогенеза, а также активация процесса липолиза, что приводит к нарастанию уровня свободных жирных кислот и глицерина, что в свою очередь способствует усилению продукции глюкозы. Снижение утилизации глюкозы тканями из-за дефицита инсулина. Свободные жирные кислоты поступают в печень, где из них образуются кетоновые тела. Кетонемия приводит к кетонурии, которая сопровождается потерей катионов, то есть усиленной экскрецией электролитов, в результате чего наступает истощение щелочного резерва, - развивается ацидоз. Немало важную роль в развитии комы играют контринсулярные гормоны: адреналин, кортизол, соматотропный гормон.
Классификация диабетической комы Кетоацидотическая. Гиперосмолярная (высокая гипергликемия, повышенная осмолярность крови, задержка натрия в организме, дегидратация). Гиперлактатацидотическая (накопление в крови молочной кислоты более 0,2г/л).
Гипогликемическая.
Клиника диабетической комы Нарастающая жажда, полидипсия, полиурия, учащенное мочеиспускание в ночное время, усиление ночного диуреза. Возможна гипотермия. Быстрая утомляемость, повышенная раздражительность. Могут быть боли в животе, потеря калия может вызвать кишечную непроходимость. Характерный фруктовый запах изо рта («прелых яблок»), Дыхание типа Куссмауля. Снижение тургора кожи опережает степень дегидратации. Кожа сухая, бледная. Язык сухой, «малиновый». Может отмечаться гипорефлексия, вызванная гипокалиемией. Тахикардия. В тяжелых случаях - артериальная гипотония, сопор, кома. Возможны неврологические нарушения.
Стадии комы: Кома I - эректильная фаза (головная боль, тошнота, боли в животе, так как кетоновые тела нейротоксичны). Кома II - а) сомнолентность, рефлексы сохранены; б) сопор, адинамия, сохранена реакция на свет, появляются рефлексы орального автоматизма и пирамидные рефлексы. Кома Ш - потеря сознания, адинамия, холодный пот, исчезают безусловные рефлексы, «плавающий» взор, мидриаз, аритмия, дыхательная недостаточность.
Осложнения комы: Отек мозга. Шок. Присоединение инфекции. Артериальный тромбоз. Отек легких.
Результаты лабораторных методов:Повышение уровня глюкозы в плазме крови свыше 13-16 ммоль/л. Дисэлектролитемия. Повышение гематокрита. Концентрация кетоновых тел (ацетона, бета-оксимасляной и ацетоуксусной кислот в сыворотке крови превышает 3 ммоль/л, иногда может достигать 30 ммоль/л при норме до 0,15 ммоль/л.) Метаболический ацидоз. Уровень мочевины повышен. Возможно повышение уровня АЛТ и ACT, амилазы.
План обследования: Глюкоза ркови, Кетоновые тела; Мочевина; глюкоза мочи, Креатинин, ЭЭГ, ЭКГ, УЗИ печени, почек, КЩС;Протеинограмма; сердца; Липиды крови;Консультации специалистов (невролога, окулиста, нефролога, кардиолога и др.), Электролиты крови;
Лечение диабетической комы
Легкоусвояемая диета: каша, картофельное пюре, соки, чай.
Инсулин короткого действия 0,1 ЕД/кг/час. Повторная доза через 4-6 часов.
Физ р-р 50-150 мл/кг/сут. В первые 6 ч-50% объема жидкости, затем через 6 часов 25% суточной дозы.
Коррекция гипокалиемии.
Антибиотики по показаниям.
Сердечные гликозиды.
Кокарбоксилаза, витаминотерапия.
Гипогликемическая кома
Теоретически гипогликемия - это тот уровень сахара в крови, при котором появляются симптомы нейрофизиологической дисфункции. Как лабораторный показатель, гипогликемией считается уровень сахара в крови 2,2-2,8 ммоль/л, у новорожденных - менее 1,7 ммоль/я, у недоношенных -менее 1,1 ммоль/л. В большинстве случаев уровень сахара в крови, при котором наблюдается ухудшение самочувствия, колеблется от 2,6 до 3,5 ммоль/л (в плазме - от 3,1 до 4,0 ммоль/л).
Клиника гипогликемической комы
Первые симптомы гипогликемических состояний являются результатом нейрогликопении (снижение интеллектуальной деятельности, растерянность, дезориентация, вялость, сонливость либо наоборот, агрессивность, немотивированные поступки, эйфория, а также головная боль, головокружение, «туман» или мелькание «мушек» перед глазами, резкое чувство голода, либо у маленьких детей, категорический отказ от еды). К ним очень быстро присоединяются проявления гиперкатехоламинемии (тахикардия, повышение АД, потливость, бледность кожных покровов, тремор конечностей и чувство внутренней дрожи, тревоги, страха).
При отсутствии своевременной помощи у ребенка могут развиться спутанное сознание, тризм, судороги, истощающие последние энергетические запасы в ЦНС, коматозное состояние. Симптомы гипогликемии развиваются очень быстро, и клиническая картина может сводиться к «неожиданной», со слов родителей, потере сознания. Все случаи внезапной потери сознания у ребенка с сахарным диабетом требуют экстренного исследования сахара крови. В состоянии сна тяжелую гипогликемию у ребенка можно заподозрить по наличию потливости, стонущего дыхания, гипертонуса и судорожного подергивания мышц. При длительном коматозном состоянии развиваются симптомы поражения ствола головного мозга - нарушение ритма дыхания и нестабильной сердечной деятельности.
Различают 3 степени тяжести гипогликемических состояний:
1 -я степень - легкая. Ребенок или подросток хорошо осознает свое состояние и самостоятельно купирует гипогликемию.
2-я степень - средняя. Дети или подростки не могут самостоятельно купировать гипогликемию и нуждаются в посторонней помощи, однако, в состоянии принимать углеводы per os.
3-я степень - тяжелая. Ребенок или подросток находятся в полубессознательном, бессознательном или коматозном состоянии, нередко в сочетании с судорогами, и нуждаются в парентеральной терапии (глюкагон в/м или в/в введение глюкозы).
Причины развития гипогликемической комы:
неправильно подобранная доза инсулина;
ошибки при введении инсулина перед сном;
не проконтролированный низкий сахар крови перед сном;
большая физическая нагрузка в дневные или вечерние часы.
Отсутствие легкоусвояемых углеводов у ребенка во время игр, занятий спортом, прогулок,
прием алкогольных напитков и отсутствие знаний о действии алкоголя на углеводный обмен.
Интеркуррентные заболевания, сопровождаемые рвотой, в том числе пищевая токсикоинфекция.
Намеренно индуцированные большими дозами экзогенно вводимого инсулина гипогликемии.
Дифференциальный диагноз гипогликемической и кетоацидотической комы
|
Симптомы |
Гипогликемическая кома |
Кетоацидотическая кома |
|
Скорость развития |
Внезапно, несколько минут |
Постепенно, чаще несколько дней |
|
Кожные покровы |
Влажные |
Сухие |
|
Тошнота, рвота |
Иногда у маленьких детей при наличии сопутствующей патологии |
Постоянно, полифагия переходит в анорексию |
|
Мышцы |
Гипертонус, судороги |
Гипотонус, возможны судороги в более поздних стадиях |
|
Тонус глазных мышц |
Нормальный |
Снижен |
|
Зрачки |
Расширены |
Расширены редко |
|
Дыхание |
Спокойное |
Куссмауля, «фруктовый» запах изо рта |
|
Сахар крови |
Низкий (ниже 2,5 ммоль/л) |
Высокий (выше 16 ммоль/л) |
|
Ацетон в моче |
Не более + |
+++ |
|
Сахар в моче |
Отсутствует |
3-5% и выше |
У женщин, страдающих сахарным диабетом, во время беременности потребность в инсулине меняется: в 1триместре она уменьшается, во 2 и 3-ем значительно повышается, а перед родами вновь заметно снижается. Следовательно, инсулинозависимый диабет во время беременности, как правило, протекает с осложнениями - периоды гипергликемии и кетоацидоза сменяются периодами гипогликемии, что ведет к прогрессированию сосудистых поражений. Течение беременности у женщин, больных сахарным диабетом, почти всегда патологическое. Из-за возникновения в плаценте дистрофических и дегенеративных изменений (маточно-плацентарная недостаточность) нередко наступает гибель плода, тяжелая хроническая внутриутробная гипоксия, отмечается недонашивание, многоводие, поздние токсикозы, раннее отхождение околоплодных вод. Даже при оптимальной, на сегодняшнем уровне знаний и возможностей, коррекции диабета у беременной примерно треть детей рождается с симптомокомплексом, названным диабетическая эмбриофетопатия.
Диабетическая эмбриопатия развивается при наличии у матери декомпенсированного или субкомпенсированного диабета с тяжелыми сосудистыми осложнениями или тяжелой соматической патологией, при лечении беременной пероральными противодиабетическими препаратами (тератогенный эффект) или у женщин, имевших гестационный диабет, потребовавший инсулинотерапии в 1 триместре. Диабетическая эмбриопатия проявляется множественными или изолированными пороками развития костно-мышечной системы, сердца и сосудов, головного мозга, почек, а также ЗВУР. Чаще всего отмечаются: синдром каудальной регрессии (гипоплазия крестца, копчика, бедер, поясничных позвонков), пороки развития мозга ( микро- или гидроцефалия, анэнцефалия), почек (аплазия почек, удвоение мочеточников), пороки сердца (дефекты перегородок), обратное расположение органов. Кроме того, встречаются дефекты губы и неба, микрофтальмия, гидронефроз, колобомы, атрезии кишечника.
В патогенезе состояния значительную роль играет недостаточное образование гликогена при гипоинсулинемии у матери и возникающая у плода тяжелая гипогликемия, приводящая к нарушению первых фаз дифференцировки зародыша, повышению повреждающего действия гипоксии из-за возрастания внеклеточной концентрации глютамата, вызывающего цитотоксический эффект и гибель нейронов.
При декомпенсации диабета у матери в фетальный период или при наличие у нее латентного диабета у плода развивается диабетическая фетопатия - особый случай неонатальной гипогликемии, развивающейся из-за компенсаторного ги- перинсулинизма ребенка при сахарном диабете у матери.
Клиническая картина в типичных случаях характеризуется большой массой тела при рождении, масса плаценты и пуповины также увеличена. Характерно ожирение туловища (псевдокушингоид) из-за внутриутробного гиперкортицизма, лунообразное лицо, багрово-синюшные кожные покровы, гипертрихоз, отеки на ногах и пояснице. Отмечается типичная для этих детей органомегалия - увеличены сердце, печень, надпочечники, но функциональная активность их снижена. Поэтому, у части детей развивается сердечная недостаточность по лево- или правожелудочковому типу, конъюгационная гипербилирубинемия, сосудистая недостаточность как проявления функциональной незрелости этих органов. Уже в первые часы жизни у детей с диабетической фетопатией отмечается и неврологические нарушения: снижение мышечного тонуса, угнетение сосательного и физиологических рефлексов новорожденного, что отражает задержку морфофункционального созревания ЦНС. Через некоторое время синдром угнетения ЦНС сменяется синдромом гипервозбудимости. Типичными проявлениями диабетической фетопатии в ранний неонатальный период являются также тахипноэ, одышка, приступы апноэ, а также гипогликемия. Причиной тахипноэ чаще всего являются синдром дыхательных расстройств (болезнь гиалиновых мембран), полицитемия, кардиопатия и метаболические расстройства.
Через 1-2 часа после рождения у ребенка отмечается снижение уровня глюкозы в крови ниже 2,2 ммоль/л. Первыми клиническими проявлениями гипогликемии могут быть судороги, глазная симптоматика (снижение тонуса глазных мышц, плавающие глазные яблоки, нистагм), бледность, потливость, тахипноэ, тахикардия, дрожание, срыгивания, быстро сменяющиеся вялостью, апатией, мышечной гипотонией, приступами апноэ, гипотермией.
Проявления диабетической фетопатии часто обратимы у новорожденных, не имеющих врожденных пороков и переживших неонатальный период, так как после рождения ребенка прекращается действие основного этиологического фактора - материнской гипергликемии. К 2-3 месяцем жизни обычно все указанные патологические симптомы исчезают и при правильном ведении беременности с соблюдением режима инсулинотерапии и лечебного питания они у новорожденных поражений ЦНС не вызывают. Однако, нужно помнить, что летальность среди детей с диабетической фетопатией в 5-6 раз превышает смертельные исходы у новорожденных, родившихся у здоровых женщин. У 1/3-1/4 детей в дальнейшем выявляются церебральные дисфункции (в том числе, детский церебральный паралич, эпилепсия, судорожный синдром), у половины детей выявляются функциональные отклонения со стороны сердечно-сосудистой системы, у 1/3 детей выявляются нарушения углеводного обмена (риск ювенильного сахарного диабета у таких детей - 2%).
Лечение.
Новорожденные с диабетической фетопатией ведутся как недоношенные дети из-за своей функциональной незрелости (независимо от массы тела). Они помещаются под источник лучистого тепла и затем в кювез с дозированной подачей кислорода и температурой 33-34ОС на 1-2 суток. Если позволяет состояние новорожденного, то первое прикладывание к груди проводят в родильном зале. Затем через час после рождения после определения уровня глюкозы в крови новорожденному дают выпить 5% раствор глюкозы в дозе 3-5 мл/кг. Далее каждые 2 часа ребенок кормится сцеженным молоком или прикладывается к груди. Если сосательный рефлекс снижен или отсутствует, то через зонд вводится 5% раствор глюкозы из расчета 4 кап/кг/мин, то есть глюкоза вводится из расчета 8-10 мг/кг/мин. Если уровень гликемии ниже 2,2 ммол/л, то глюкозу начинают вводить в/в капельно лучше по следующему методу: дают глюкозу в дозе 0,2 г/кг/мин (2 мл 10% раствора в течение 1 минуты) в/в струйно, а затем ее вливают в/в капельно в дозе 6-8 мг/кг/мин (3,6-4,8 мл/кг/час 10% раствора глюкозы). Гипогликемия исчезает через несколько минут и опасность гипергликемии низка.
Если на фоне введения глюкозы гипогликемии не ликвидирована в течение 6 часов, то целесообразно назначение медикаментов, способствующих увеличению уровня глюкозы в крови, то есть антагонистов инсулина. Кроме метаболического антагониста инсулина (глюкозы), необходимо вводить гормональные антагонисты: гидрокортизон 5-10 мг/кг/сут за 2 введения, преднизолон 2-3 мг/кг/сут, глюкагон 0,1-0,5 мг/кг в/м 2 раза в сутки, АКТГ 2 ЕД/кг в/м 2 раза в сутки, диазоксид 5-15 мг/кг/сут с возможным увеличением до 20-25 мг/кг за 3 приема внутрь, соматостатин 2-8 мкг/кг/мин в/в капельно.
В первые 3 суток уровень глюкозы в крови надо определять каждые 3-4 часа и кормить ребенка без ночного перерыва через 2-2,5 часа. Учитывая исходы этого состояния, необходимо обязательно сохранить первую беременность у женщин с сахарным диабетом I типа, так как последующие дети будут менее жизнеспособны.
Организм человека постоянно окружен во внешней среде огромным количеством микробов, которые способны проникать в дыхательные пути, пищеварительный тракт, мочеполовые органы. В процессе филогенеза сложилось динамическая система равновесия между организмом человека и микробными ассоциациями, заселяющими его кожу и органы, сообщающиеся с внешней средой. Микроэкологическая система желудочно-кишечного тракта является открытым биоценозом, то есть между микрофлорой окружающей среды и микрофлорой пищеварительного тракта происходит постоянная циркуляция микроорганизмов.
Выделяют 3 фазы становления биоценоза у новорожденных:
Асептическая фаза - длится 10-20 часов с момента рождения и для нее характерен стерильный меконий. Первоначальное микробное заселение организма плода происходит в родовых путях матери, в которых в норме преобладают лактобациллы, бифидобактерии, а спектр остальной флоры очень сходен с микрофлорой кишечника.
Фаза нарастающего инфицирования - с конца первых суток происходит заселение желудочно-кишечного тракта ребенка разнообразной микрофлорой, попадающей извне. Преимущественно это аэробы - кокки, но могут быть и энтеробактерии, дрожжи, условно-патогенные и патогенные микроорганизмы. Развивается так называемый транзиторный дисбактериоз. Эта колонизация и размножение в кишечнике любых микроорганизмов объясняется слабым развитием местной иммунологической защиты желудочно-кишечного тракта у новорожденных (низкая продукция иммуноглобулинов G, M, лизоцима, лактоферрина, комплемента, пропердина, интерферона). Стадия транзиторного дисбактериоза продолжается в норме до 5-8 дня.
Фаза трансформации (стабилизации) кишечного микробиоценоза - происходит нормализация кишечной микрофлоры с вытеснением бифидобактериями всей другой микрофлоры из-за их высокой ферментативной (антагонистической) активности. Нормализация биоценоза кишечника быстрее происходит у детей, находящихся на грудном вскармливании, особенно с первого часа жизни. Только в этих случаях уже к 7-8 дню жизни происходит своевременная нормализация кишечной микрофлоры.
Грудное молоко является не только незаменимым продуктом питания для новорожденных, но и важнейшим иммунозаместительным субстратом, содержащим практически все иммунные факторы. Молоко и молозиво содержат целый ряд факторов, способствующих формированию нормальной микрофлоры:
Секреторный иммуноглобулин А (с молоком матери ребенок получает в сутки 1000 мг SIg A), иммуноглобулины G (20 мг), M (10 мг), A (150 мг). Секреторный Ig A выстилает слизистую кишечника антисептической пленкой и стабилизирует кишечную флору, препятствуя присоединению микробов к эпителию, нейтрализуя вирусы, задерживая проникновение в кровь растворимых антигенов.
Лактоферрин - доминирующий железосодержащий белок молока, оказывающий бактериостатическое действие на многие патогенные и условно-патогенные бактерии (связывает ионы железа и лишает бактерии ферментных солей железа).
Лизоцим повреждает структурные элементы бактерий и вызывает их лизис.
Комплемент, осуществляющий «стыковку» специфического и неспецифического иммунитета. В нейтральной среде желудочного сока новорожденных он не разрушается и в сочетании с Ig M, G он образовывает иммунные комплексы и оказывает бактерицидное действие.
Бифидогенные факторы (термостабильные гликопротеиды, стимулирующие рост бифидобактерий) I и II, которые способствуют более быстрому заселению кишечника бифидобактериями.
Живые термолабильные клетки - нейтрофилы, макрофаги, лимфоциты, которые способствуют синтезу иммуноглобулинов и антител, продукции интерферона и комплемента. Лимфоциты грудного молока проходят своеобразное «обучение» в лимфатической ткани кишечника, сенсибилизированы именно к кишечной микрофлоре и осуществляют не только местную защиту, но и способны проникать в кровь и участвовать в общем иммунном ответе.
Высокое содержание лактозы, являющейся естественным субстратом для развития и сохранения бифидобактерий.
Термическая обработка грудного молока полностью инактивирует иммуноглобулины, все клеточные элементы, лактоферрин и значительно снижает содержание лизоцима, комплемента.
Особенно благотворно на становление нормального микробиоценоза кишечника сказывается раннее прикладывание (в первые 2 часа после родов) ребенка к груди матери, при котором содержание в кишечнике секреторного Ig A, бифидобактерий, пропердина и комплемента в 2 раза выше по сравнению с детьми, приложенными через 12-24 часа.
Тонкая кишка практически стерильна, в проксимальных отделах ее содержание микроогранизмов не превышает 103 КОЕ/г, в дистальных - 105 КОЕ/г. Основным местом обитания кишечной микрофлоры является толстая кишка, где количество микробов достигает 1010 - 1012 КОЕ/г (или lg 10-12/г). Микрофлора толстой кишки здорового ребенка представлена 3 группами микробов:
Облигатная (главная) микрофлора включает анаэробы (бифидобактерии, лактобактерии, бактероиды) и аэробы (кишечная палочка), которые и осуществляют основные физиологические функции. Количество этой анаэробной (могут жить без доступа кислорода) флоры, составляющей 95-99% биоценоза, равно 109 -1010 КОЕ/г (lg 9-10).
Факультативная (сопутствующая) флора представлена условно-патогенными и сапрофитными микроорганизмами: клостридиями, клебсиеллами, цитробактером, энтеробактером, непатогенными стафилококками, протеем, дрожжеподобными грибами. Эта флора составляет менее 1%.
Транзиторная (остаточная) микрофлора включает случайные микроорганизмы, попавшие в желудочно-кишечный тракт (неферментообразующие грамотрицательные палочки). Составляет не более 0,01% биоценоза.
Бифидобактерии являются наиболее значимыми представителями облигатных бактерий в кишечнике детей и взрослых. Они занимают к 5-20 дню после рождения доминирующее положение в микробном пейзаже кишечника у здоровых новорожденных, находящихся на естественном вскармливании. Среди различных видов бифидобактерий преобладают Bifidobacterium bifidum, breve, infantis, рост которых стимулируется бифидогенными факторами грудного молока. Кроме того, для этих детей характерно отсутствие микроорганизмов, осуществляющих протеолиз: условно-патогенных бактерий, энтеробактерий, клостридий, протея, а также золотистого стафилококка, хотя отмечается значительное количество дрожжевых грибков (но не кандид). При искусственном вскармливании количество бифидобактерий снижено, причем бифидогенный фактор коровьего молока стимулирует рост других штаммов бифидобактерий (B. Longum, infantis), а фактор, стимулирующий рост нормальной B. Bifidum, отсутствует. Выявляется повышенное количество кишечных палочек, появляются лактозонегативные штаммы, увеличивается количество стафилококков (коагулазопозитивных штаммов), энтерококков, протея. Особенно значительное снижение уровня бифидофлоры отмечается у новорожденных с перинатальной патологией, получивших интенсивную терапию в родильном стационаре. Характерным для них является преобладание условно-патогенной флоры, представленной грибами рода кандида, и грамотрицательными бактериями.
В норме количество бифидобактерий у грудных детей составляет 109 - 1010 КОЕ/г фекалий. Бифидобактерии выполняют разнообразные функции:
Осуществляют физиологическую защиту кишечного барьера от проникновения микробов и токсинов во внутреннюю среду организма. Это происходит за счет влияния бифидобактерий на структуру слизистой кишечника, на скорость ее регенерации и на функции пищеварения и всасывания.
Обладают высокой антагонистической активностью по отношению к патогенным и условно-патогенным микроорганизмам за счет выработки органических жирных кислот и высокой ферментативной активности.
Участвуют в утилизации пищевых субстратов и активизации пристеночного пищеварения (способны расщеплять клетчатку, лактозу, осуществлять деконъюгацию желчных кислот, трансформировать ненасыщенные жирные кислоты).
Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, тиамин (витамин В1), рибофлавин (В2), никотиновую кислоту (РР, В3), фолиевую кислоту (Вс), пиридоксин (В6), цианкобаламин (В12), а также способствуют усилению всасывания через стенку кишечника ионов кальция, железа и жирорастворимых витаминов А и D.
Обладают иммуномодулирующим действием: регулируют функцию гуморального и клеточного иммунитета, препятствуют деградации секреторного Ig A, стимулируют интерферонообразование и вырабатывают лизоцим.
Лактобактерии являются облигатной флорой желудочно-кишечного тракта и вульвовагинальной области. В норме количество лактобактерий в толстом кишечнике составляет 106-108 КОЕ/г фекалий. Лактобактерии подавляют гнилостные и гноеродные условно-патогенные микроорганизмы, в первую очередь протея и возбудителей острых кишечных инфекций, за счет образования молочной кислоты, перекиси водорода, продукции лизоцима и других веществ с антибиотической активностью (реутерина, плантарицина, лактоцидина, лактолина). Лактобациллы стимулируют фагоцитарную активность нейтрофилов, макрофагов, способствуют синтезу иммуноглобулинов, образованию - и -интерферона, интерлейкина-1, фактора некроза опухоли.
Кишечные палочки появляются в кишечнике новорожденного в первые дни после рождения в количестве 107-108 КОЕ/г фекалий. Основные их функции следующие:
Способствуют гидролизу лактозы
Участвуют в продукции витаминов К, группы В
Вырабатывают колицины - антибиотикоподобные вещества, тормозящие рост энтеропатогенных кишечных палочек
Оказывают мощное иммуномодулирующее действие, способствуя активации системного гуморального и местного иммунитета
Бактероиды - анаэробные неспорообразующие микроорганизмы, которые принимают участие в пищеварении, расщеплении желчных кислот, участвуют в процессах липидного обмена. Заселение кишечника бактероидами происходит постепенно, у детей раннего возраста их содержание не превышает 107-108 КОЕ/г фекалий.
Таким образом, нормальная микрофлора выполняет важную неспецифическую защитную функцию, способствуя поддержанию постоянства биохимической и биологической среды пищеварительного тракта.
Изменения микрофлоры кишечника, возникающие под влиянием всевозможных неблагоприятных факторов, обозначают термином «дисбактериоз».
Дисбактериоз - количественные и качественные изменения состава нормальной кишечной микрофлоры с расширением сферы ее обитания. Сдвиги в кишечной микрофлоре могут охватывать все основные группы микроорганизмов - как облигатных, так и факультативных.
Основными причинами дисбактериоза у новорожденных являются:
Осложненное течение беременности и родов, гнойно-септические заболевания матери до родов и после них (бактериальные вагинозы, маститы у матери). Изменение микроэкологии кишечника новорожденных в этих случаях обусловлено значительным дисбиоценозом влагалища и кишечника матери, персонала родильных домов, а также несоблюдением гигиенических требований при уходе за детьми.
Позднее прикладывание ребенка к груди матери, раздельное пребывание матери и ребенка с первых дней жизни или вскармливание пастеризованным женским молоком. Лишаясь иммунозаместительного эффекта молозива и женского молока, новорожденные всегда имеют микробиотические сдвиги в кишечнике.
Контакты с носителями госпитальных штаммов после рождения (от персонала или других матерей), вирусная или бактериальная инфекция новорожденных, большинство заболеваний периода новорожденности (асфиксия, родовая травма, ГБН, кровопотеря, недоношенность), а также антибактериальная терапия, подавляющая нормальную анаэробную флору кишечника (цефалоспорины 3 поколения, линкомицин, левомицетин).
Патогенез.
В результате действия различных неблагоприятных факторов в кишечнике развиваются различные дисбиотические сдвиги. Уменьшается количество анаэробов, кишечные палочки теряют свойство расщеплять лактозу, нарастает количество условно-патогенных штаммов с появлением их ассоциаций или вегетирования нескольких видов одного из родов, появляются не свойственные нормальному биоценозу штаммы ( клебсиеллы, синегнойная палочка, клостридии, кандида).
Происходит бактериальное заселение тонкой кишки, что негативно сказывается на ее функциях. Нарушается переваривание белков, жиров и углеводов в полости тонкой кишки, усиливаются процессы бактериального гниения и брожения, меняется рH кишечного химуса, что нарушает работу ферментов. Усиливается стеаторея, образуются нерастворимые мыла жирных кислот, нарушается абсорбция жирорастворимых витаминов из-за потребления их микроорганизмами и развивается эндогенный полигиповитаминоз.
В результате размножения микробов в тонкой кишке возникает воспаление ее слизистой оболочки и снижается регенерация эпителия, что нарушает абсорбционную способность эпителиальных клеток и пристеночное пищеварение. Атипичные и патогенные микроорганизмы своими токсическими, инвазионными и некротизирующими свойствами способствуют разрушению кишечной стенки, дистрофическим, деструктивным и некротическим изменениям слизистой оболочки.
Усиленное размножение бактерий оказывает стимулирующее воздействие на местную иммунную систему кишечника, вызывая усиление выработки антител (преимущественно Ig M, Ig G, которые связывают комплемент и образуют иммунные комплексы на поверхности эпителиоцитов). Это оказывает повреждающее действие на слизистую оболочку, приводит к изменению ее антигенной структуры и способствует выработке противокишечных аутоантител. Именно эти процессы и лежат в основе хронизации, способствуя углублению и более тяжелому течению дисбактериоза.
Клинические проявления.
Дисбактериоз является понятием микробиологическим, а не клиническим. Он является неотъемлемой частью многих заболеваний, сопровождающихся снижением общей или местной иммунологической реактивности. Клинические проявления дисбактериоза характеризуются исключительно большим разнообразием и неспецифичностью. Наиболее постоянными клиническими признаками дисбактериоза следует считать упорные диспептические расстройства, обусловленные нарушением процессов пищеварения и всасывания в тонкой кишке, усилением газообразования и моторики кишечника.
Различают 4 степени (фазы) дисбактериоза:
I степень (латентная фаза) - характеризуется появлением уже к концу первой недели метеоризма, срыгиваний, снижения аппетита, запора или разжиженного, учащенного стула с зеленью, непереваренными частицами (неравномерная окраска каловых масс), с неприятным запахом. На этом фоне отмечается медленное восстановление массы тела, плохие прибавки на первом месяце жизни. Однако, в ряде случаев клинические проявления могут отсутствовать. Микробиологически при этой степени выявляются стойкие изменения или в облигатной или в факультативной группе микроорганизмов на 1-2 порядка, но количество анаэробов всегда превышает количество аэробов.
II степень (пусковая фаза) - характеризуется появлением клинических симптомов гастрита и энтерита, что характеризуется появлением болей в животе после еды, диспептическими расстройствами в виде отрыжки, тошноты, рвоты, срыгиваний, снижения аппетита или отказа от еды, метеоризма, запоров или диареи. Микробиологически при этой степени выявляются более значительные изменения и в облигатной и в факультативной группе микроорганизмов, высокие титры лактозоотрицательной кишечной палочки. Количество анаэробов равно или несколько превышает количество аэробов.
III степень (фаза агрессии микробных ассоциаций) - характеризуется клиническими проявлениями гастрита, энтерита, энтероколита, колита с появлением спорадических аллергических реакций, синдрома анемии, гиповитаминоза, гипокальциемии. Происходит бактериальное заселение вышележащих отделов ЖКТ, вплоть до ротовой полости. Микробиологические изменения те же, что и при второй степени, но количество анаэробов равно или меньше количества аэробов.
IV степень (фаза ассоциированного дисбактериоза) - характеризуется выраженными клиническими проявлениями гастроэнтерита, энтероколита на фоне транзиторной бактериемии: кратковременного повышения температуры тела, очагов эндогенной инфекции, бактериурии. Это обусловлено выходом симбионтов за пределы ЖКТ и появлением их в других органах и субстратах (кровь, моча). Микробиологически выявляется наличие высокого титра условно-патогенных микроорганизмов как одного вида, так и в ассоциациях из 4-7 представителей, а также появляются несвойственные нормальному биоценозу штаммы (клебсиелла, синегнойная палочка, клостридии, кандида). Количество анаэробов всегда меньше количества аэробов.
Наряду с общими клиническими симптомами отмечается ряд клинических особенностей течения дисбактериоза при моноинфицировании. Так, при дисбактериозе, обусловленном ростом протея, в клинической картине заболевания обращает на себя внимание постоянное вздутие живота, светло-зеленый пенистый стул с большим количеством слизи, который носит ползучий характер. Аппетит снижен, язык сухой, покрыт белым налетом, характерны опрелости в низу живота и вокруг ануса, гнилостный запах стула.
При дисбактериозе, обусловленном ростом стафилококка, часто появлению кишечного синдрома по типу энтероколита (вплоть до развития эрозивно-язвенного энтероколита) предшествует появление других локализованных гнойно-воспалительных заболеваний (омфалитов, отитов, пневмоний). Характерно отсутствие эффекта от проводимой терапии, высокая температура, тяжелый и длительный токсикоз с эксикозом, озноб, потливость, нарушение сна. Стул ярко-желтого, оранжевого цвета, водянистый, со слизью, иногда с примесью крови и гноя.
Общими для дисбактериоза, обусловленного ростом грибов рода Candida и гемолитических форм кишечной палочки, являются отсутствие симптомов интоксикации, склонность к запору или бродильной диспепсии, значительное вздутие живота, стойкие опрелости. Стул при этом чаще пенистый, молочно-болотного цвета. Характерно появление молочницы на слизистой рта, явлений глоссита, анорексии, упорной диареи.
Дифференциальный диагноз.
Дисбактериоз, как проявление микроэкологических сдвигов в организме вследствие многочисленных экзо- и эндогенных причин, следует отличать от острых кишечных инфекций. Для кишечных инфекций характерно наличие симптомов интоксикации, дегидратации, электролитных нарушений, воспалительных изменений в гемограмме. В стуле выявляется обычно слизь, реже кровь, а в копрограмме - признаки воспаления (слизь, лейкоциты, эритроциты). Однако, при любой кишечной инфекции всегда отмечается дисбактериоз. С микробиологической точки зрения, «кишечная инфекция» и «дисбактериоз» - близкие понятия, отличие между которыми заключается в степени морфологических изменений слизистой кишечника и токсического воздействия на организм в целом, что и предопределяет клиническую симптоматику.
Диагностика.
Диагноз дисбактериоза подтверждается путем посева кала на различные среды с подсчетом количества анаэробных и аэробных представителей и отдельных штаммов (посев кала на дисбактериоз). Обычно выявляется уменьшение количества анаэробов, потеря кишечными палочками свойства расщеплять лактозу, нарастание количества условно-патогенных штаммов или их ассоциации.
Критерии диагностики различных степеней дисбактериоза (lg КОЕ/г):
Лечение больных с дисбактериозом должно проводиться комплексно, с учетом основного заболевания, характера клинических симптомов и обязательной коррекции нарушения микрофлоры кишечника.
Учитывая непосредственное влияние и отдаленные эффекты естественного вскармливания, именно грудное молоко является наилучшей пищей для ребенка с дисбактериозом. При естественном вскармливании через материнское молоко и системы психофизиологических контактов осуществляется комплексное воздействие на развитие и адаптационные возможности ребенка, регуляция темпа и стадийности созревания различных органов, адаптация к той среде, которая в ближайшем будущем станет средой обитания ребенка.
При отсутствии у матери молока предпочтительным методом обработки донорского молока является щадящая пастеризация (при температуре 62,5С в течение 30 минут) и дальнейшее хранение его при низких температурах.
При невозможности обеспечить ребенка грудным молоком показаны смеси с биоактивными добавками или обогащенные защитными факторами:
Смеси с биоактивными добавками (БАД) готовят на основе сухого обезжиренного стерилизованного коровьего молока с введением различных защитных факторов: лизоцима (БАД-1Л), бифидобактерина (БАД-1Б), лизоцина и бифидобактерий (БАД-2) или специфических иммуноглобулинов (БАД-ИГ).
Обогащенные защитными факторами молочные смеси - адаптированные по составу смеси на основе коровьего молока с добавками ацидофильной палочки, лакто- или бифидобактерий, лизоцима, иммуноглобулинов: ацидофильные «Малютка» и «Наринэ», «Балбобек», «Крошечка», «Росток-1», «Виталакт кисло-молочный», «Бифилин», «Бифидок», «Бифидолакт», «Биолакт с лизоцимом». Из обычных адаптированных смесей наиболее благоприятны для формирования нормального кишечного биоценоза «Детолакт» и «Симилак».
Медикаментозное лечение дисбактериоза заключается в назначении иммуномодулирующей терапии, включающей пробиотики, пребиотики и иммуностимуляторы, а также биологически активных препаратов, поливитаминов, адаптогенов, фитотерапии и других средств.
Пробиотики представляют собой высушенные препараты, состоящие из живых микроорганизмов или продуктов микробного происхождения, обычно обитающих в кишечнике и создающих в нем нормальный биоценоз, препятствующий размножению патогенных микроорганизмов (бифидумбактерин, лактобактерин, бактисубтил, ацилакт, аципол, линекс, кипацид и другие).
Пребиотики представляют собой вещества немикробного происхождения, стимулирующие рост и развитие нормальной микрофлоры кишечника. К ним относятся пантотенат кальция, парааминобензойная кислота (памба), хилак-форте, нормазе, лизоцим. За счет понижения pH содержимого кишечника и концентрации гнилостных бактерий, стимуляции перистальтики кишечника, эти препараты способствуют росту бифидобактерий, лактобактерий и кишечных палочек.
При выраженных степенях дисбактериоза медикаментозное лечение необходимо начинать с подавления роста условно-патогенной микрофлоры. При одновидовом дисбактериозе (например, преимущественном росте стафилококка или кишечной палочки, протея) предпочтительнее назначение соответствующего бактериофага: стафилококкового, коли-протейного, синегнойного, клебсиеллезного, поливалентного пиобактериофага или интести-бактериофага.
При ассоциированном дисбактериозе, когда отмечается рост нескольких видов микроорганизмов, показаны нитрофураны (фуразолидон, фурадонин, эрцефурил), метронидазол, гентамицин, макролиды (эритромицин, рокситромицин, кларитромицин), хлорофиллипт. Но антибиотики назначаются в редких случаях и только с учетом чувствительности высеваемой флоры. При кандидозе назначают противогрибковые препараты: флуконазол (дифлюкан), кетоконазол (низорал), пимафуцин (натамицин).
Широкое распространение нашли энтеросорбенты (активированный уголь, карболен, ваулен, полифепан, каолин, смекта, энтеродез, холестирамин), ферменты (мезим-форте, панкреатин, панзинорм, фестал) и иммуномодулирующие препараты (адаптогены растительного происхождения - женьшень, элеутерококк, левзея, а также миелопид, левамизол, нуклеинат натрия, лейкинферон, реаферон, КИП - комплексный иммуноглобулиновый препарат).
Лечение компенсированного дисбактериоза (I степень): начинают с назначения бифидумбактерина по 2,5-5 доз 2-3 раза в день за полчаса до кормления или во время кормления (смешав с материнским молоком) в течение 3-4 недель. Для получения более стойкого эффекта рекомендованы кислотообразующие препараты, не содержащие живых бактерий: синтетический дисахарид нормазе по 0,25-0,5 мл/кг за 2 приема, концентрат продуктов метаболизма бактерий тонкого и толстого кишечника хилак-форте по 10-15 капель 3 раза в день в течение 2-4 недель. Назначение бифидумбактерина и кислотообразующих препаратов часто сочетают с приемом фермента белковой природы лизоцима по 0,05 г 3 раза в день в разведении с водой в соотношении 1 : 3 в течение 2-4 недель или бифилиза (вигела) по 5 доз 2-3 раза в день в течение 5-20 дней во время кормления. При снижении содержания лактобацилл через 3-5 дней от начала лечения бифидумбактерином назначают лактобактерин или аципол по 3 дозы 2 раза в день за 30-40 минут до еды в течение 2-3 недель. Количество курсов бифидо- и лактотерапии составляет 1-3.
Лечение субкомпенсированного дисбактериоза: начинают проводить с назначения бифидумбактерина, кислотообразующих препаратов и лактобактерина по той же схеме. Наряду с лизоцимом, как средством защиты слизистого барьера кишечника, при данной степени рекомендуется назначение иммунокоррегирующего препарата КИП , содержащего человеческие антитела к антигенам патогенных и условно-патогенных энтеробактерий, а также к другим грамотрицательным микроорганизмам. Он содержит иммуноглобулины трех основных классов (Ig G, Ig M, Ig A). Назначается по 1 дозе 1-2 раза в сутки за 30 минут до еды в течение 5 дней. При наличии повышенного количества кишечной палочки и присутствии ее измененных форм необходимо назначение бактериофагов: коли-протейного (по 10 мл внутрь 2 раза в день за 1 час до еды в течение 4 дней, через 3 дня курс повторяют), интестифага (по 3-5 мл 3 раза в день за 1 час до еды в течение 5-6 дней), поливалентного пиобактериофага (в аналогичных дозах) или комбинированного бактериофага. При отсутствии чувствительности стафилококковой флоры к бактериофагам назначают хлорофиллипт внутрь, из расчета 1 капля неразведенного 1% спиртового раствора на 1 кг массы 3 раза в день за 30-40 минут до еды (развести в 15-20 мл воды) или ректально (1 мл 1% раствора развести в 50 мл воды). В отдельных случаях, при отсутствии эффекта от бактериофагов, возможно назначение антагониста аэробной флоры - бактисубтила (по 1 капсуле 3 раза в день за 30 минут до кормления в течение 3-15 дней), споробактерина, биоспорина. Назначение антибиотиков проводится лишь в случаях развития выраженного энтероколита или при упорном и длительном выделении из кала условно-патогенных микроорганизмов, если исчерпаны возможности вышеперечисленных препаратов.
Лечение декомпенсированного дисбактериоза - терапия начинается с краткосрочного назначения сорбентов, затем проводят подавление роста условно-патогенной микрофлоры, а потом назначают пробиотики, иммуномодулирующие препараты, ферменты, поливитамины, отвары трав. Из сорбентов назначают активированный уголь, карболен в виде порошка (0,5 г 3-4 раза в сутки), полифепан и другие препараты лигнина (0,5 г/кг 3 раза в сутки), смекту (1/3 пакета или 1 г 3 раза в день в течение 5 дней) или каолин (0,5 г 3 раза в день в течение 4-5 дней). Фаготерапия осуществляется комбинированным или поливалентным фагами по схеме аналогичной лечению субкомпенсированного дисбактериоза. После окончания фаготерапии назначают комбинированное лечение бифидо- и лактосодержащими пробиотиками в возрастных суточных дозах, количество курсов может достигать 3-6. Из иммунных препаратов показано назначение интерферона (per rectum), реаферона, лейкинферона (по 1/2 свечи 2-3 раза в неделю в течение 4-5 недель), левамизола (по 0,001 мг/кг 1 раз в неделю в течение 1-1,5 месяцев), нуклеината натрия (0,005 г 3 раза в день в течение 10-20 дней). Из ферментных препаратов рекомендованы мезим-форте, панзинорм, фестал, энзистал (по 1/4 - 1/2 таблетки в виде порошка 3-4 раза в день после кормления), панкреатин (по 0,1 г 3 раза в день) в течение 1-3 недель в зависимости от сроков купирования клинических проявлений дисбактериоза. При необходимости можно проводить повторные курсы. При наличии гнойных инфекционных очагов внекишечной локализации, токсикоза, стойкого диарейного синдрома показана кратковременная (5-7 дней) антибактериальная терапия с учетом вида условного патогена, преобладающего в биоценозе, и его индивидуальной чувствительности к антибактериальному препарату. Для защиты нормальной микрофлоры кишечника антибиотикотерапию рекомендуется осуществлять на фоне раннего (на 3-5 день от начала лечения антибиотиками ) подключения лактобактерина, так как антибиотики не подавляют лактобактерии. После окончания курса антибиотикотерапии назначается бифидумбактерин, 1 доза которого содержит 108 живых бифидобактерий.
Возможными последствиями нелеченного дисбактериоза могут быть гипотрофия, анемия, гиповитаминозы, ферментопатии, а также генерализация процесса с развитием сепсиса, хронический энтероколит, поражение печени, развитие аллергических процессов.
Основные направления профилактики включают выявление и лечение дисбиоценозов влагалища , мочевыделительной системы и кишечника у женщин до беременности и во время беременности, раннее прикладывание к груди, назначение антибиотиков только при наличии соответствующих показаний и разумное ограничение длительности их курсов.
ДЖВП. ЭТИОЛОГИЯ РОЛЬ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ В ПАТОГЕНЕЗЕ ДЖВП. КЛИНИКА, ДИАГНОЗ. ЛЕЧЕНИЕ. РПОФИЛАКТИКА. ДИСКИНЕЗИИ
Дискинезия желчевыводящих путей — нарушение поступления желчи в двенадцатиперстную кишку из-за расстройства моторики мышечного аппарата желчевыводящих путей, приводящее к появлению болей в правом подреберье. Различают два вида этой патологии: гипертоническую, при которой тонус сфинктеров желчевыводящих путей (рис. 51) повышен, и гипотоническую (гипотонически-гипокинетическую), при которой тонус и двигательная активность желчных путей снижены. Подразделение дискинезий на первичные и вторичные неправомерно, ибо они практически всегда вторичные.
Этиология
Выделяют следующие факторы, приводящие к дискинезии желчевыводя-щих путей (ЖП): нейроциркуляторная дисфункция различного генеза;
перенесенный острый вирусный гепатит; конституциональные особенности ребенка с вегетативной дистонией и малоподвижный образ жизни; неврозы; пищевая аллергия; любая хроническая патология желудочно-кишечного тракта (особенно воспалительная); паразитозы желудочно-кишечного тракта, особенно лямблиоз; наследственная предрасположенность, хотя она все же чаще сводится к семейным особенностям образа жизни, в частности, питания; хронические очаги инфекции в организме (ЛОР-патология и др.); отравления, экопатология, длительное злоупотребление в питании продуктами промышленного консервирования; эндокринные заболевания (ожирение, тиреотоксикоз, сахарный диабет).
Патогенез
Представление о дискинезиях желчного пузыря как чисто функциональных расстройствах в настоящее время пересматривается. Не только при гипо-моторных, но и при гипермоторных формах дискинезии имеют место органические изменения на уровне гепатоцита, что является своего рода первичным фактором, способствующим нарушению деятельности не только внутри-, но и внепеченочных желчных путей, включая желчный пузырь [Галкин В. А., 1996]. Эта патология представляет собой определенный тип холестаза. Однако не исключают роль вегетососудистой (нейроциркуляторной) дистонии в развитии дискинезии билиарной системы. Итак, два основных фактора приводят к расстройству моторики ЖП:
нарушение функционального состояния гепатоцита и отсюда — дисхолия (изменение состава желчи);
нарушения неврогенной регуляции мышечной стенки ЖП как центрального (нейроциркуляторная дисфункция, неврозы), так и периферического (при патологии желудочно-кишечного тракта по типу висцеро-висцеральных рефлексов с интероцепторов) генеза. Установлено, что к дискинезиям ЖП может привести и нарушение секреции энтеральных гормонов (холецистокинин, мотилин и др.) при хронической патологии двенадцатиперстной и тонкой кишки, а также апудопатиик дискинезии желчевыводяого генеза;с вегетативной дистониеи и шшечного тракта (особенно шатоцита и отсюда — дисхо-
Нарушение ритмики поступления желчи в кишечник уменьшает бактерицидные свойства верхних отделов желудочно-кишечного тракта, ведет к дис-бактериозам, дискинезиям кишечника. Длительно текущая дискинезия, вызывая застой и инфицирование желчи, заброс кишечного содержимого в желчный пузырь (рефлюкс), приводит к холециститу. При преобладании тонуса симпатического отдела нервной системы у больного характерны гипотонические дискинезии (80% всех дискинезии), при парасимпатикотонии — гипертонические.
Клиника определяется причиной, приведшей к дискинезии, и видом ее. У большинства больных имеются симптомы нейроциркуляторной дисфункции: повышенная утомляемость, раздражительность, плаксивость, вспыльчивость, головные боли, сердцебиение, потливость. Наряду с этим, дети жалуются на боли в правом подреберье, эпигастрии. При гипертонической дискинезии боли приступообразные, острые, но кратковременные. Чаще они связаны с эмоциональным или физическим перенапряжением, приемом жирной пищи. При гипотонической дискинезии боли тупые, ноющие, с чувством распирания в правом подреберье. Боли чаще постоянные, сочетающиеся с тошнотой, снижением аппетита, отрыжкой. Температура тела у детей нормальная, при клиническом анализе крови отклонений от возрастных норм, как правило, нет.
Диагноз
Наиболее важны для диагностики результаты осмотра — обнаружение болезненности при пальпации в области желчного пузыря (место пересечения правого края прямой мышцы живота с реберной дугой), что особенно четко выявляют при глубокой пальпации в момент вдоха. При нечетких результатах необходим осмотр в динамике. Очень важно тщательно оценить состояние ЦНС и вегетативного ее отдела. Обязательно также обследовать болевые точки, характерные для солярита, искать очаги хронической инфекции, яйца глистов и цисты лямблий в стуле (не менее 5 дней подряд).
При
дуоденальном зондировании (нормативы
см. табл. ПО) у больных с гиперкинетической
и гипертонической формой дискинезии
пузырный рефлекс лабилен и иногда
возникает до введения сульфата магния,
а иногда — через 2-3 ч или совсем не
проявляется. Количество желчи порции
В чаще увеличено, течет она медленно,
концентрированная (спастический
холестаз). У больных с гипокинетической
формой пузырный рефлекс непостоянен,
часто ослаблен и наблюдается лишь
при применении сильного раздражителя.
При ослаблении тонуса сфинктера
печеночно-поджелудочной ампулы желчь
вытекает сразу после введения зонда,
дифференцировка порций А, В, С затруднена.
Порция В выделяется в повышенном
количестве (более 60 мл) и длительно
(время выделения желчи В свыше 25 мин)
из-за атонического хо-лестаза, но время
закрытого сфинктера Одди мало (менее
3 мин). Дифферен-цировке видов дискинезии
помогают результаты УЗИ с холецистокинином.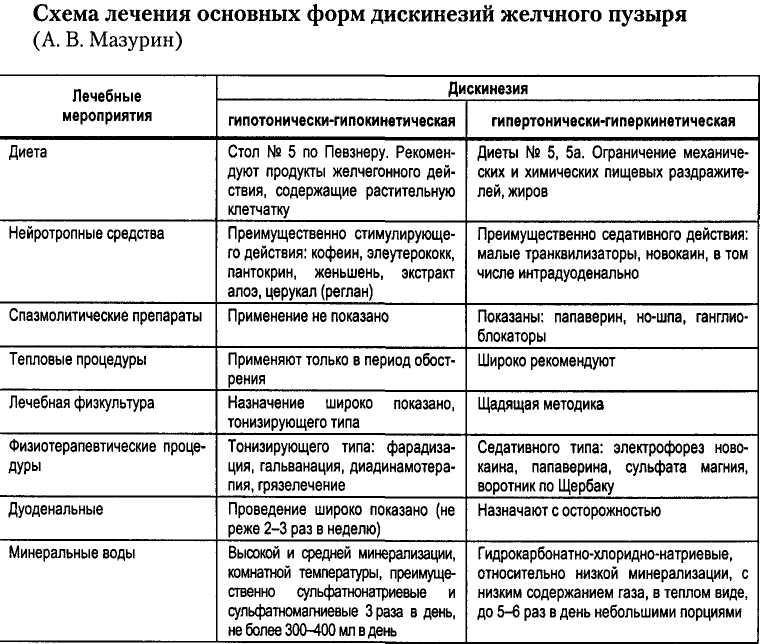
ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ
При дискинезии желчных путей, когда диагноз уже поставлен и больной обследован в стационаре, лечение можно проводить на дому по схеме, приведенной в табл. 111.
После выписки из стационара (при отсутствии последующих обострений) диспансерное наблюдение за детьми, перенесшими холецистит, осуществляется в течение 3 лет, а при дискинезии — 1-1,5 года. Его проводят по следующему плану.
Диета. Соблюдение диеты необходимо после перенесенного обострения холецистита в течение 3 лет, после дискинезии — 1,5 года. Переход на общий стол должен быть постепенным. Однако лучше, если родители, учитывая хронический характер заболевания, способствуют созданию отрицательного отношения ребенка к продуктам, не рекомендуемым больным холециститом.
Курсы специфического лечения (желчегонная терапия) проводят после выписки из стационара на первом году 4 раза (через 1,3,6 и 12 мес), а в последующие 2 года — 2 раза в год. Курс лечения продолжается 1 мес и включает слепые зондирования 1-2 раза в неделю, минеральные воды, комбинированное назначение холекинетиков (например, сорбит в виде 20% раствора из расчета 0,3 г сухого вещества на 1 кг массы тела в день за 3 приема или сульфат магния по 1 чайной, десертной или столовой ложке 5% раствора 3 раза в день) и холеретиков (аллохол, хологон, циквалон и др.). При симптомах хронического очага инфекции (субфебрилитет, слабость, бледность, потливость, увеличенная СОЭ, нейтрофилез) целесообразно назначить курс антибактериального лечения (оксафенамид, никодин, пролонгированные сульфаниламидные препараты).
Профилактика и лечение дисбактериоза — 1 раз в год трехнедельный курс лактобактерина или бификола. Фитотерапия — по 1 мес каждые 3 мес (с учетом вида дискинезии).
Поиски и санация очагов инфекции. Два раза в год обследовать ребенка на наличие гельминтов и лямблий (не менее чем троекратные анализы кала) и консультировать ребенка с отоларингологом, стоматологом, проводить биологические пробы на туберкулез (не менее 1 раза в год). Физкультура. Освобождение от физкультуры (и то непродолжительное) необходимо только после тяжелого приступа болей. Больные холециститом должны заниматься физкультурой. Занятия спортом, требующие больших физических нагрузок и напряжения, лучше ограничить. В то же время малоподвижный образ жизни способствует застою желчи, а, значит, и длительному течению заболевания. Очень полезна больным холециститом утренняя зарядка. Режим. Санаторно-курортное лечение. Показаны курорты для больных холециститом, которые имеют детские отделения: Трускавец, Ессентуки, Железно-водск, Старая Русса, оз. Шира. В санаторном лечении нуждаются дети с длительным течением болезни, с частыми обострениями.
Профилактика
Своевременная санация очагов инфекции, так как именно они в большинстве случаев являются предпосылкой для оседания и развития инфекции в желчном пузыре. Не менее важно и лечение в семье ребенка взрослых, страдающих холециститом. С учетом роли алиментарного фактора в развитии холецистита целесообразно предохранять ребенка от избытка в пище углеводов и жиров, консервов, колбас, жареных пирожков. Дети должны избегать малоподвижного образа жизни, способствующего застою желчи.
Все дети, переболевшие инфекционным гепатитом, особенно в раннем возрасте, должны находиться на диспансерном учете в течение 3 лет. В комплексе мероприятий при наблюдении за ними необходимы и периодические курсы желчегонной терапии (в течение 1 года после перенесенного заболевания более целесообразно давать холекинетики, а не холеретики). У всех детей с болями в животе неясного происхождения, субфебрилитетами, стойкими лейкопениями при клиническом обследовании следует подозревать и холецистит. У детей с неблагоприятными условиями быта, а также склонных к аллергии, неврозам, часто возникают дискинезий желчных путей, поэтому для предупреждения развития холецистита необходимо своевременно диагностировать дискинезий желчных путей и рационально лечить их.
