
- •19.Елементи атомної фізики та квантової механіки.
- •19.1. Борівська теорія атома водню та її обмеженість
- •19.2. Хвильова -функція Луї де Бройля та її фізичний зміст
- •19.3. Рівняння Шредінгера
- •19.4. Суперпозиція станів у квантовій механіці
- •19.5. Рух вільної частинки
- •19.6. Частинка у нескінченно глибокій потенціальній ямі
- •19.7. Гармонічний осцилятор
- •19.8. Потенціальний бар’єр та його прозорість
- •19.9. Квантування моменту імпульсу
- •19.10. Воднеподібні атоми
- •19.11. Дослід Штерна-Герлаха. Спін електрона
- •19.12. Механічний момент імпульсу та магнітний момент електрона
- •19.13. Механічний та магнітний момент атома
- •19.14. Принцип Паулі
- •19.15. Періодична система хімічних елементів
- •1S22s22p63s,
- •1S22s22p63s23p63d104s24p6.
- •19.16. Хімічний зв’язок у молекулах, валентність
- •19.17. Рентгенівські спектри. Закон Мозлі
- •19.18. Молекулярні спектри
- •19.20. Люмінесценція
- •19.21. Комбінаційне розсіювання
- •19.22. Вимушене випромінювання. Лазери
- •19.23.Контрольні питання
19.16. Хімічний зв’язок у молекулах, валентність
Природа сил, що об’єднують
атоми в молекули, має квантово-механічне
пояснення. Валентність
характеристика здатності атомів до
взаємного об’єднання в молекулу.
Валентність чисельно дорівнює подвоєному
спіну (в одиницях
![]() )
атома в основному або низько лежачому
збудженому стані. Коли таких станів
декілька, то атом може проявляти різні
валентності. Спін заповнених оболонок
і підоболонок дорівнює нулю, тому в
утворенні хімічного зв’язку приймають
участь електрони зовнішніх незаповнених
підоболонок, які називаються валентними.
)
атома в основному або низько лежачому
збудженому стані. Коли таких станів
декілька, то атом може проявляти різні
валентності. Спін заповнених оболонок
і підоболонок дорівнює нулю, тому в
утворенні хімічного зв’язку приймають
участь електрони зовнішніх незаповнених
підоболонок, які називаються валентними.
Лужні елементи мають спін
рівний
![]() і по одному валентному електрону. Їх
валентність дорівнює одиниці. Для
елементів другої підгрупи спін елементів
в основному стані дорівнює нулю, а в
збудженому стані з конфігурацією
оболонки s1p1
спін дорівнює одиниці й атом має
валентність два. По дві валентності
мають ті атоми, в яких спіни основного
стану та низько лежачого збудженого
відрізняються на одиницю. До них,
наприклад, відносяться атоми головної
підгрупи періодичної системи: вуглець
С, кремній Sі, германій Ge і т.п. В основному
стані з конфігурацією незаповненої
s2p2
оболонки спін дорівнює 1, а в збудженому
стані з конфігурацією s1p3
2. Тому ці атоми можуть бути двох та
чотиривалентними.
і по одному валентному електрону. Їх
валентність дорівнює одиниці. Для
елементів другої підгрупи спін елементів
в основному стані дорівнює нулю, а в
збудженому стані з конфігурацією
оболонки s1p1
спін дорівнює одиниці й атом має
валентність два. По дві валентності
мають ті атоми, в яких спіни основного
стану та низько лежачого збудженого
відрізняються на одиницю. До них,
наприклад, відносяться атоми головної
підгрупи періодичної системи: вуглець
С, кремній Sі, германій Ge і т.п. В основному
стані з конфігурацією незаповненої
s2p2
оболонки спін дорівнює 1, а в збудженому
стані з конфігурацією s1p3
2. Тому ці атоми можуть бути двох та
чотиривалентними.
Суттєво інша валентність в атомах перехідних елементів (металів), розташованих у побічних підгрупах періодичної системи. В цих атомах відбувається забудова підгрупи d глибоко лежачої оболонки з нижчим квантовим числом. У зв’язку з цим їх хімічні властивості визначаються валентними електронами атомів із меншим зарядовим числом (порядковим номером). При створенні цими атомами молекул спіни d-електронів можуть не компенсуватися, а конфігурація оболонок суттєво відрізняється від атомних. У зв'язку з тим, що в атомах таких молекул порушується симетричний розподіл заряду електрона, в них утворюється іонний (гетерополярний) зв’язок.
Якщо симетрія розподілу заряду електронів в атомах молекули не порушується або залишається близькою до сферичної симетрії, то виникає гомеополярний (ковалентний) зв’язок між атомами, наприклад, при утворенні молекули з однакових атомів. Такий зв’язок має квантово-механічне тлумачення і не має аналогів у класичній теорії. Суть його полягає у тому, що електрони різних атомів тотожні і при утворенні молекули електронні оболонки атомів перекриваються. В області перекриття електрони належать одночасно обом атомам (атоми в цій області обмінюються електронами) і це зумовлює виникнення обмінної енергії зв’язку між ними.
19.17. Рентгенівські спектри. Закон Мозлі
Розподіл електронів на
оболонках атомів знайшов підтвердження
при дослідженні спектрів рентгенівського
випромінювання атомів (відкрите Рентгеном
у 1895 р.). Прискорюючись електричним
полем із високою напругою U, електрони
бомбардують анод (вольфрамовий чи з
інших важких металів) рентгенівської
трубки. Під час бомбардування електрони
сповільнюються й випромінюють
електромагнітні хвилі, які мають
неперервний спектр (гальмівне рентгенівське
випромінювання) і на
його фоні вузький характеристичний
лінійчатий спектр із достатньо малими
ширинами ліній
(див.Мал.203). Гальмівний спектр має
граничну максимальну частоту max,
яка визначається енергією електрона
і не залежить від матеріалу анода. Ця
частота відповідає тому випадку, коли
електрон не збуджує електронні рівні
атомів анода і вся його енергія переходить
у квант випромінювання Еmax=eU=hmax.
Виявляється, що характеристичні спектри
різних елементів однотипні і містять
декілька серій (див.Мал.204). Вони
визначаються матеріалом анода і виникають
при збудженні глибинних електронних
оболонок K,L,M,N,O. При вириванні одного
електрона з цих оболонок, на вакансію
можуть перейти електрони з більш високих
енергетичних рівнів. При цьому виникають
серії в ипромінювання
ипромінювання
K(LK), K(MK), K(NK); 2) L(ML), L(NL)
і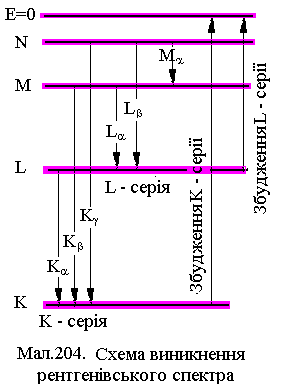 т.п. В ряду,
,
... частоти ліній збільшуються, а
інтенсивність, що визначається ймовірністю
переходів із більш високих рівнів,
зменшується. У 1913 році Г.Мозлі
(1887-1915) установив закон, що визначає
частоту характеристичного випромінювання
в залежності від серії n (n=1K,
n=2L,
...) та номера лінії у серії m (m=n+1, n+2,...)
т.п. В ряду,
,
... частоти ліній збільшуються, а
інтенсивність, що визначається ймовірністю
переходів із більш високих рівнів,
зменшується. У 1913 році Г.Мозлі
(1887-1915) установив закон, що визначає
частоту характеристичного випромінювання
в залежності від серії n (n=1K,
n=2L,
...) та номера лінії у серії m (m=n+1, n+2,...)
![]() (1)
(1)
де R стала Рідбергера для визначення частоти
![]() ,
(2)
,
(2)
стала екранування, що визначає послаблення взаємодії електронів із ядром при збільшенні номера серії. Так для K-серії (n=1) =1. Для визначення довжин хвиль формула Мозлі буде мати вид
![]() (3)
(3)
де
![]() (4)
(4)
стала Рідбергера для визначення довжин хвиль.
