
- •19.Елементи атомної фізики та квантової механіки.
- •19.1. Борівська теорія атома водню та її обмеженість
- •19.2. Хвильова -функція Луї де Бройля та її фізичний зміст
- •19.3. Рівняння Шредінгера
- •19.4. Суперпозиція станів у квантовій механіці
- •19.5. Рух вільної частинки
- •19.6. Частинка у нескінченно глибокій потенціальній ямі
- •19.7. Гармонічний осцилятор
- •19.8. Потенціальний бар’єр та його прозорість
- •19.9. Квантування моменту імпульсу
- •19.10. Воднеподібні атоми
- •19.11. Дослід Штерна-Герлаха. Спін електрона
- •19.12. Механічний момент імпульсу та магнітний момент електрона
- •19.13. Механічний та магнітний момент атома
- •19.14. Принцип Паулі
- •19.15. Періодична система хімічних елементів
- •1S22s22p63s,
- •1S22s22p63s23p63d104s24p6.
- •19.16. Хімічний зв’язок у молекулах, валентність
- •19.17. Рентгенівські спектри. Закон Мозлі
- •19.18. Молекулярні спектри
- •19.20. Люмінесценція
- •19.21. Комбінаційне розсіювання
- •19.22. Вимушене випромінювання. Лазери
- •19.23.Контрольні питання
19.18. Молекулярні спектри
Молекула являє собою найменшу
частинку речовини і складається з
багатьох однакових чи різних атомів.
Хімічні властивості молекул визначаються
взаємодією зовнішніх електронів атомів,
які називаються валентними електронами.
Найпростішими молекулами є двоатомні
з гомеополярним зв'язком:
![]() а також молекули з гетерополярним
звязком:
а також молекули з гетерополярним
звязком:
![]() .
У 1927 році Гайтлер та Лондон розв'язали
рівняння Шредінгера для двоатомної
молекули водню. У результаті було
виявлено, що енергія молекули залежить
від відстаніr
між молекулами та напрямками їх спінів.
Для
.
У 1927 році Гайтлер та Лондон розв'язали
рівняння Шредінгера для двоатомної
молекули водню. У результаті було
виявлено, що енергія молекули залежить
від відстаніr
між молекулами та напрямками їх спінів.
Для
![]() молекула має мінімум енергії, а в околиці
молекула має мінімум енергії, а в околиці
![]() вона здійснює гармонічні коливання
(див.Мал.205). На м
вона здійснює гармонічні коливання
(див.Мал.205). На м алюнку
представлена залежність енергії молекули
водню від відстані між атомами в основному
стані для випадку паралельних та
антипаралельних спінів електронів. У
першому випадку молекула є стійким
утворенням, а у другому випадку енергія
не має мінімуму й молекула не може бути
утворена взагалі. При електронному
збудженні енергія молекули змінює криву
залежності електронної енергії від
відстані між атомамиr,
як це показано на малюнку. При заданій
електронній конфігурації молекула може
здійснювати коливальний та обертовий
рух, які визначаються відповідними
енергіями. Будова молекул та їх властивості
виявляються з молекулярних спектрів,
які утворюються електронними, коливальними
та обертовими збудженнями атомів. Крім
названих складових також розрізнюють
електронно-коливальні (не змінюється
коливальне квантове число v) та
коливально-обертові (не змінюється
обертове квантове число, яким є квантове
число імпульсу J). Типові молекулярні
спектри
смугасті, що представляються сукупністю
вузьких смуг в інфрачервоній, видимій
та ультрафіолетовій областях. Чим
більше атомів у молекулі, тим складніший
її спектр випромінювання. Розглянемо
докладніше енергетичні стани молекул.
Повна енергія молекули Е є сумою енергії
Ее
електронної конфігурації, енергій
коливального
Еv
та енергії
обертового руху
Еr,
причому
алюнку
представлена залежність енергії молекули
водню від відстані між атомами в основному
стані для випадку паралельних та
антипаралельних спінів електронів. У
першому випадку молекула є стійким
утворенням, а у другому випадку енергія
не має мінімуму й молекула не може бути
утворена взагалі. При електронному
збудженні енергія молекули змінює криву
залежності електронної енергії від
відстані між атомамиr,
як це показано на малюнку. При заданій
електронній конфігурації молекула може
здійснювати коливальний та обертовий
рух, які визначаються відповідними
енергіями. Будова молекул та їх властивості
виявляються з молекулярних спектрів,
які утворюються електронними, коливальними
та обертовими збудженнями атомів. Крім
названих складових також розрізнюють
електронно-коливальні (не змінюється
коливальне квантове число v) та
коливально-обертові (не змінюється
обертове квантове число, яким є квантове
число імпульсу J). Типові молекулярні
спектри
смугасті, що представляються сукупністю
вузьких смуг в інфрачервоній, видимій
та ультрафіолетовій областях. Чим
більше атомів у молекулі, тим складніший
її спектр випромінювання. Розглянемо
докладніше енергетичні стани молекул.
Повна енергія молекули Е є сумою енергії
Ее
електронної конфігурації, енергій
коливального
Еv
та енергії
обертового руху
Еr,
причому
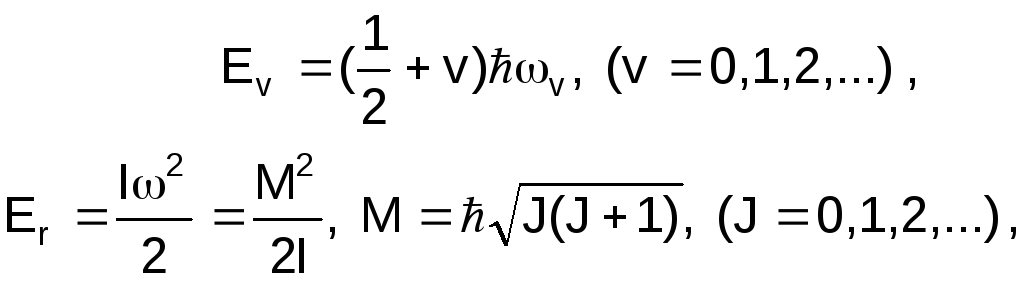 (1)
(1)
де І момент інерції молекули, М момент імпульсу, J квантове число момента імпульсу і
![]() .
(2)
.
(2)
Запишемо тепер повну енергію Е у вигляді
![]() .
(3)
.
(3)
П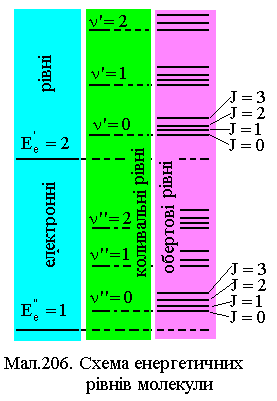 ринципова
схема енергетичних рівнів молекули
показана на Мал.206.
ринципова
схема енергетичних рівнів молекули
показана на Мал.206.
![]() Закономірність
переходу між енергетичними рівнями (3)
молекули задається правилами відбору
Закономірність
переходу між енергетичними рівнями (3)
молекули задається правилами відбору
L=1 для електронних рівнів (L орбітальне квантове число),
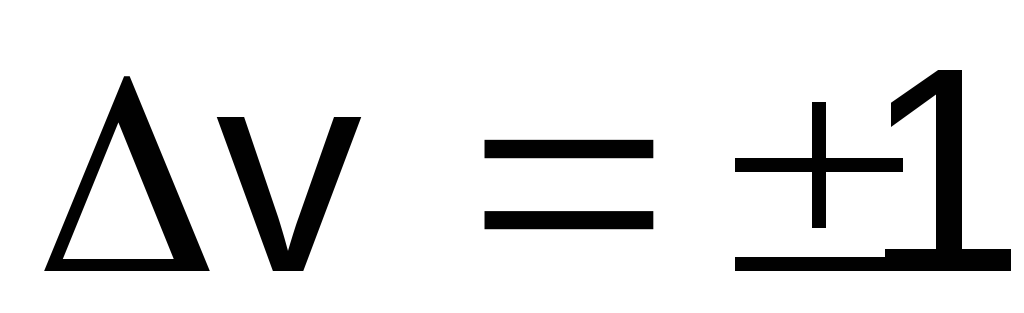 для коливальних рівнів (v
коливальне квантове число),
для коливальних рівнів (v
коливальне квантове число),J=1 для обертових рівнів.
 На
відміну від лінійчатих спектрів
випромінювання атомів молекулярні
спектри складаються зі смуг, кожна з
яких складається з тісно розташованих
ліній, структура яких показана на
Мал.207. смуги молекулярного спектра
азоту. З цієї причини молекулярні спектри
мають назву смугастих. Розрізнюють три
види смуг: обертові, коливально-обертові
та електронно-коливальні. Останні мають
різко виражений кант з одного боку, як
згусток близько розташованих ліній, а
з другого кінця край спектра є розмитим.
На
відміну від лінійчатих спектрів
випромінювання атомів молекулярні
спектри складаються зі смуг, кожна з
яких складається з тісно розташованих
ліній, структура яких показана на
Мал.207. смуги молекулярного спектра
азоту. З цієї причини молекулярні спектри
мають назву смугастих. Розрізнюють три
види смуг: обертові, коливально-обертові
та електронно-коливальні. Останні мають
різко виражений кант з одного боку, як
згусток близько розташованих ліній, а
з другого кінця край спектра є розмитим.
19.20. Люмінесценція
Випромінювання, надмірне
над тепловим, тривалість якого
![]() називається люмінесценцією.
Таке випромінювання може народжуватися
називається люмінесценцією.
Таке випромінювання може народжуватися
при бомбардуванні тіл швидкими електронами та іншими, розігнаними до певних енергій, частинками,
пропусканні електричного струму ударна фотолюмінісценція,
дії достатньої величини напруженості електричного поля (електричний розряд) електролюмінісценція,
опроміненні іншим випромінюванням фотолюмінісценція
при протіканні деяких хімічних реакцій хемілюмінесценція з частинним випадком біологічних перетворень (наприклад, гниття дерева) біолюмінесценція .
При всіх названих джерелах виникнення люмінесценції, відбувається перехід атомів або іонів речовини у збуджений стан із наступним переходом їх в основний. При цьому може виникати люмінесцентне випромінювання електромагнітних хвиль. Поряд із цим можуть відбуватися і безвипромінювальні переходи. В залежності від тривалості люмінесцентного випромінювання , люмінесценцію розділяють на
флуоресценцію ( ~ 10-8c 10-9c) фотолюмінісценція рідин та газів, та
фосфоресценцію, коли атоми тіла мають метастабільні збуджені рівні (10-4c >> 10-8c).
Для фотолюмінісценції встановлено правило: при фотолюмінісценції під дією видимого та рентгенівського випромінювання тіло випромінює світло на частотах s менших частоти збуджуючого випромінювання о стоксове випромінювання й випромінювання малої інтенсивності на частоті аs більшій ніж частота збуджуючого випромінювання антистоксове випромінювання. Це правило віддзеркалює той факт, що при утворенні фотона з s, частина енергії W кванта ho йде на неоптичні процеси, а в другому випадку до енергії джерела ho долучається енергія теплового руху атомів, величина якої пропорційна kT.
Сфери застосування
створення економічних джерел освітлення (натрієві жовта лінія, ртутні жовта, зелена, синя та фіолетова лінії);
люмінесцентний аналіз для виявлення речовин із відносною масовою концентрацією до 10-11.
