
- •19.Елементи атомної фізики та квантової механіки.
- •19.1. Борівська теорія атома водню та її обмеженість
- •19.2. Хвильова -функція Луї де Бройля та її фізичний зміст
- •19.3. Рівняння Шредінгера
- •19.4. Суперпозиція станів у квантовій механіці
- •19.5. Рух вільної частинки
- •19.6. Частинка у нескінченно глибокій потенціальній ямі
- •19.7. Гармонічний осцилятор
- •19.8. Потенціальний бар’єр та його прозорість
- •19.9. Квантування моменту імпульсу
- •19.10. Воднеподібні атоми
- •19.11. Дослід Штерна-Герлаха. Спін електрона
- •19.12. Механічний момент імпульсу та магнітний момент електрона
- •19.13. Механічний та магнітний момент атома
- •19.14. Принцип Паулі
- •19.15. Періодична система хімічних елементів
- •1S22s22p63s,
- •1S22s22p63s23p63d104s24p6.
- •19.16. Хімічний зв’язок у молекулах, валентність
- •19.17. Рентгенівські спектри. Закон Мозлі
- •19.18. Молекулярні спектри
- •19.20. Люмінесценція
- •19.21. Комбінаційне розсіювання
- •19.22. Вимушене випромінювання. Лазери
- •19.23.Контрольні питання
19.10. Воднеподібні атоми
До воднеподібних атомів
відносяться власне водень та група
одновалентних лужних елементів,
однократно іонізований атом гелію
![]() ,
двічі іонізований атом літію
,
двічі іонізований атом літію![]() і т.п. Потенціальна енергія електрона
у таких атомах у полі ядра із зарядом
Ze записується у вигляді
і т.п. Потенціальна енергія електрона
у таких атомах у полі ядра із зарядом
Ze записується у вигляді
![]() ,
,
де r відстань електрона від ядра. При цьому рівняння Шредінгера запишеться так
![]() .
(1)
.
(1)
Зважаючи на сферичну симетрію воднеподібних атомів, вводяться сферична система координат і в ній рівняння Шредінгера записується у виді
![]() .
(2)
.
(2)
Не приводячи у явному вигляді
вираз лапласіана
![]() у сферичній системі координат, вкажемо,
що розв’язок рівняння (2) знаходиться
у вигляді
у сферичній системі координат, вкажемо,
що розв’язок рівняння (2) знаходиться
у вигляді
![]() (3)
(3)
В (3)
![]()
радіальна хвильова функція,
радіальна хвильова функція,
![]()
сферична хвильова функція. Числа n,l,m
мають назву квантових чисел:
сферична хвильова функція. Числа n,l,m
мають назву квантових чисел:
n=1,2,3,… головне квантове число, що визначає енергію електрона у атомі та ймовірність знаходження електрона на відстані r від ядра. Усі електрони атома з однаковим головним квантовим числом формують його енергетичну оболонку.
l=0,1,2,…,n-1 – азимутальне (орбітальне) квантове число, що визначає момент імпульсу електрона у атомі. Азимутальне квантове число формує підоболонку електронів з однаковим моментом імпульсу.
m=0, 1, 2, ... , l – магнітне квантове число, що визначає проекцію моменту імпульсу на вісь
 ,
яку ототожнюють із напрямком вектора
магнітної індукції
,
яку ототожнюють із напрямком вектора
магнітної індукції зовнішнього електромагнітного поля.
зовнішнього електромагнітного поля.
а). Власні значення енергії. Власне значення енергії електрона в полі ядра дискретне і має вигляд
![]() ,
(1)
,
(1)
а
для електрона не зв’язаного з ядром
енергія Е>0 і неперервна. Найменша
величина енергії водню
![]() буде при n=1 і
буде при n=1 і
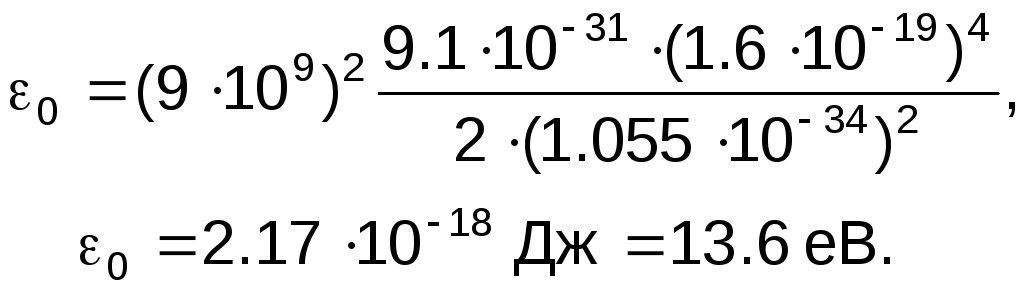 (2)
(2)
Використовуючи (2) можна записати
![]() .
(3)
.
(3)
Число N можливих станів у межах енергетичної оболонки визначається сумою Nm по всім можливим значенням l
![]() (4)
(4)
і знаходиться як сума n членів арифметичної прогресії з різницею d=3, першим членом а1=1 та n-м членом аn=2n-1
![]() .
.
Усі можливі стани атома водню класифікуються умовними позначеннями через позначення енергетичних оболонок n та їх підоболонок l за схемою, поданою в таблиці. Випромінювання та поглинання світла атомом відбувається з певними обмеженнями, які ще називають правилами відбору.
|
Номер оболонки |
Підоболонкичисло станів з урахуванням значення спіна |
число станів в оболонці | |||
|
n |
l=1 |
l=2 |
l=3 |
l=4 |
|
|
1 |
1s2 |
|
|
|
2 |
|
2 |
2s2 |
2p6 |
|
|
8 |
|
3 |
3s2 |
3p6 |
3d10 |
|
18 |
|
4 |
4s2 |
4p5 |
4d10 |
4f14 |
32 |
В иявляється,
що при переходах електрона між
енергетичними рівнями, у першому
наближенні, повинно відбуватися таке
обмеження на азимутальне квантове число
l
иявляється,
що при переходах електрона між
енергетичними рівнями, у першому
наближенні, повинно відбуватися таке
обмеження на азимутальне квантове число
l
l=1, (5)
яке пов’язане із законом збереження імпульсу, коли враховані імпульси атома й фотона, що випромінюється чи поглинається. Таким чином в атомі можливі переходи
nsmp, npmd і т.п.
б). Власні функції. Власні
функції
![]() є добутком двох множників
є добутком двох множників![]() .
Множник
.
Множник![]() є розвязком
радіальної частини рівняння Шредінгера,
ядром якого є функція Лагерра.
Цей множник залежить від квантових
чисел n, l. Сферична функція
є розвязком
радіальної частини рівняння Шредінгера,
ядром якого є функція Лагерра.
Цей множник залежить від квантових
чисел n, l. Сферична функція
![]() є розвязком
частини рівняння Шредінгера, яка залежить
від кутів
є розвязком
частини рівняння Шредінгера, яка залежить
від кутів
![]() і визначається квантовими числами l, m.
Можна показати, що функція
і визначається квантовими числами l, m.
Можна показати, що функція![]() є власною функцією квадрата моменту
імпульсу
є власною функцією квадрата моменту
імпульсу![]() і його проекції
і його проекції![]() .
Густина ймовірності знаходження
електрона на відстані r від ядра задається
виразом
.
Густина ймовірності знаходження
електрона на відстані r від ядра задається
виразом![]() і для декількох функцій на малюнку 13
наведена відповідна її залежність від
r у мірилі борівського радіуса
і для декількох функцій на малюнку 13
наведена відповідна її залежність від
r у мірилі борівського радіуса![]() .
З малюнка видно, що найбільш імовірними
є відстані від ядра, що співпадають із
радіусами відповідних борівських орбіт.
.
З малюнка видно, що найбільш імовірними
є відстані від ядра, що співпадають із
радіусами відповідних борівських орбіт.
Наведемо декілька значень
радіальної та сферичної функцій, поклавши
![]() (див.Мал.199)
(див.Мал.199)
![]() ,
,
![]() ,
,
![]() .
.
![]() ,
,
![]() ,
,![]() ,
,![]() .
.
в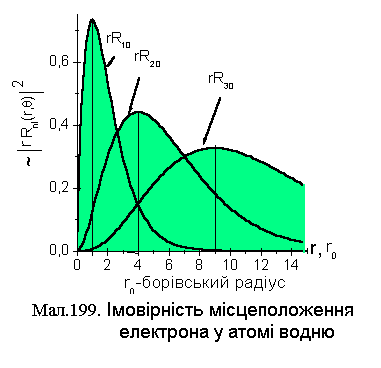 ).
Принцип відповідності Бора.
Розглянемо одну спільну властивість
енергій електрона, що знаходиться у
потенціальній ямі, електрона, що здійснює
гармонічні коливання (осцилятор) та, на
кінець, електрона у воднеподібному
атомі. Знайдемо відносні проміжки
енергій електронів для перелічених
випадків.
).
Принцип відповідності Бора.
Розглянемо одну спільну властивість
енергій електрона, що знаходиться у
потенціальній ямі, електрона, що здійснює
гармонічні коливання (осцилятор) та, на
кінець, електрона у воднеподібному
атомі. Знайдемо відносні проміжки
енергій електронів для перелічених
випадків.
1. Для частинки у глибокій потенціальній ямі для енергії справджуються такі співвідношення
![]() ,
,![]() ,
,![]() .
.
2. Для гармонічного осцилятора можна записати
![]() ,
,![]() ,
,![]()
3. Для воднеподібних атомів. У випадку n+1-го енергетичного рівня маємо
![]() ,
,
а відносний проміжок становитиме
![]() .
.
В усіх перелічених випадках
при великих числах
n
(n>>1)
маємо
![]() й енергія стає
неперервною. Це означає, що починаючи
з деяких значень квантових чисел, енергія
частинки може розглядатися як класична.
й енергія стає
неперервною. Це означає, що починаючи
з деяких значень квантових чисел, енергія
частинки може розглядатися як класична.
Одержаний
результат є окремим випадком загального
принципу відповідності Бора, який він
установив в 1923 році стосовно квантової
механіки. За цим принципом будь-яка
нова, більш узагальнена теорія природних
явищ у фізиці, що є розвитком класичної
теорії, не відкидає останньої узагалі,
а містить її у собі у певних межах
застосування, причому у граничних
випадках нова теорія переходить у
попередню. Так, наприклад, при малих
швидкостях тіл V<<c,
релятивістська механіка переходить у
класичну, а при
![]() квантова
механіка переходить у класичну.
квантова
механіка переходить у класичну.
