
- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
Идеальные расворы-
растворы, у которых теплота растворения
=0. Ясно, что в этих растворах характер
взаимодействия м\у молекулами
растворенного вещества и растворителя
такой же, как и м\у молекулами растворителя.
Это означает, что взаимодействие м\у
молекулами в растворе не меняется, если
заменить некоторое число молекул
растворенного вещества на такое же
число молекул растворителя, и наоборот.
Давление насыщенных паров растворителя
должно быть меньше их давления над
чистым растворителем во столько же
раз, во сколько плотность молекул
растворителя меньше, чем когда он
является чистым, без растворенного в
нем вещества. Иначе говоря, давление
насыщенных паров уменьшается во столько
раз, во сколько уменьшается концентрация
растворителя (закон Рауля):
![]() ,
,
где P1 – давление
насыщенных паров растворителя над
раствором; P1(0) – давление насыщенных
паров над чистым растворителем; ν1 –
количество молей растворителя; ν2 –
количество молей растворенного вещества.
Аналогично для давления насыщенных
паров растворенного вещества получим:
![]() ,
,
где P2 – давление
насыщенных паров растворенного вещества
над раствором; P2(0) – давление насыщенных
паров над чистым растворенным веществом.
Закон Рауля справедлив для идеальных
растворов. когда з-н характеризует
относительную концентрацию вещества
в растворе, если над раствором
поддерживается давление P2 насыщенных
паров этого вещества (закон Генри),то:
![]()
Из закона Генри следует, что для увеличения относительной концентрации растворенного вещества в растворе необходимо увеличить давление насыщенных паров растворенного вещества над растворителем; а для уменьшения концентрации – уменьшить давление.Отсюда следует, что при повышении Т растворимость веществ с положительной теплотой растворения убывает,а при понижении Т растворимость веществ с отрицательной теплотой растворения убывает, а с повышением Т возрастает.
46. Диаграмма состояния раствора. Кипение жидких растворов.
Рассмотрим диаграммы состояния жидких бинарных смесей при атмосферном давлении.
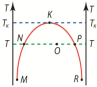
Данная диаграмма
соответствует жидкостям, смешивающимся
в произвольном количестве лишь при
достаточно высокой Т. Линия MNK
характеризует насыщенный раствор
жидкости A в жидкости В а линия RPK
соответствует насыщенному раствору
жидкости B в жидкости A. При температуре
T>Tк (критической температуры смешивания)
жидкости A и B смешиваются в любых
пропорциях. Область ниже кривой MNKPR –
соответствует состоянию двухфазной
системы с насыщенными растворами
жидкости A в жидкости B, и жидкости B в
жидкости A. Область, расположенная левее
линии MNK, соответствует ненасыщенному
раствору жидкости A в жидкости B. Область,
расположенная правее линии RPK,
соответствует ненасыщенному раствору
жидкости B в жидкости A. Для характеристики
состояния двухфазной системы действует
правило рычага.Например, в состоянии
характеризуемом точкой O, массы
насыщенного раствора жидкости A в
жидкости B (mАВ)
и раствора жидкости B в жидкости A (mАВ)
обратно пропорциональны длинам отрезков
OP и ON:
![]()
Существуют диаграммы с двумя критическими температурами смешивания.
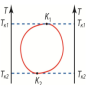 Данная диаграмма
соответствует жидкостям,смешивающимся
в произвольном количестве лишь при
достаточно высоких (T>Tк1) и достаточно
низких
Данная диаграмма
соответствует жидкостям,смешивающимся
в произвольном количестве лишь при
достаточно высоких (T>Tк1) и достаточно
низких
(T<Tк2) тем-х.Область ограниченная линией соответствует области двухфазных состояний, а сама линия соответствует насыщенным растворам.
47.
Диаграмма состояния бинарных смесей.
Осмотическое давление.
Рассмотрим
диаграммы
состояния системы пар- жидкий раствор
при постоянном атмосферном давлении.
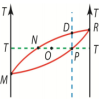 Данная
диаграмма соответствует бинарной смеси,
компоненты которой смешиваются в любых
пропорциях. Область, ограниченная
замкнутой кривой MNDRPM,
соответствует двухфазным состояниям,
когда в объеме имеются одновременно и
насыщенный пар и раствор. Ниже кривой
MPR находится однофазное состояние,
когда имеется только раствор. Область
выше кривой MNDR соответствует однофазным
состояниям системы в виде пара. В
состоянии, которое соответствует точке
P, имеется чистый раствор при температуре
T, концентрация которого задается
абсциссой этой точки (проекцией на
горизонтальную ось). Точка M характеризует
парообразное состояние при температуре
T. Точка O определяет двухфазную систему.
При этом, полная концентрация компонент
в системе дается абсциссой этой точки,
а массы жидкой и газообразной фаз
относятся друг к другу обратно
пропорционально длинам отрезков OP и
ON.
Данная
диаграмма соответствует бинарной смеси,
компоненты которой смешиваются в любых
пропорциях. Область, ограниченная
замкнутой кривой MNDRPM,
соответствует двухфазным состояниям,
когда в объеме имеются одновременно и
насыщенный пар и раствор. Ниже кривой
MPR находится однофазное состояние,
когда имеется только раствор. Область
выше кривой MNDR соответствует однофазным
состояниям системы в виде пара. В
состоянии, которое соответствует точке
P, имеется чистый раствор при температуре
T, концентрация которого задается
абсциссой этой точки (проекцией на
горизонтальную ось). Точка M характеризует
парообразное состояние при температуре
T. Точка O определяет двухфазную систему.
При этом, полная концентрация компонент
в системе дается абсциссой этой точки,
а массы жидкой и газообразной фаз
относятся друг к другу обратно
пропорционально длинам отрезков OP и
ON.
Существуют и более сложные диаграммы состояния системы пар-жидкий раствор при атмосферном давлении.
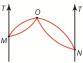 Точка O характерна
тем, что в ней состав жидкости и
насыщенного пара одинаков. Кроме того,
она соответствует состоянию, к которому
придет кипящий раствор, если пары над
ним удаляются. Разность давлений,
которая возникает между областями,
занятыми чистым растворителем и
раствором, разделенными полупроницаемой
перегородкой, называется осмотическим
давлением. Осмотическое давление равно
давлению разреженного газа этих молекул,
т.е. может быть рассчитано по формуле
для идеальных газов:
Точка O характерна
тем, что в ней состав жидкости и
насыщенного пара одинаков. Кроме того,
она соответствует состоянию, к которому
придет кипящий раствор, если пары над
ним удаляются. Разность давлений,
которая возникает между областями,
занятыми чистым растворителем и
раствором, разделенными полупроницаемой
перегородкой, называется осмотическим
давлением. Осмотическое давление равно
давлению разреженного газа этих молекул,
т.е. может быть рассчитано по формуле
для идеальных газов:
![]() ,
где ν -число молей молекул растворенного
вещества в объеме V. Данное выражение
называется законом Вант-Гоффа.
,
где ν -число молей молекул растворенного
вещества в объеме V. Данное выражение
называется законом Вант-Гоффа.
