
- •6.Биноминальное распределение. Распределения Пуассона и Гаусса. Флуктуации.
- •8.Распределение Максвелла по абсолютному значению скорости. Характерные скорости.
- •12.Процессы переноса в газах. Теплопередача, диффузия и трение. Взаимодиффузия в газе из различных молекул. Основные особенности явлений переноса в твердых телах и жидкостях.
- •13.Физические явления в разреженных газах. Явления в сосудах, сообщающихся через пористую перегородку.
- •16.Броуновское движение.Вращательное броуновское движение
- •17 Степени свободы молекул. Теорема о равнораспределении энергии по степеням свободы. Внутренняя энергия идеального газа.
- •18.Теплоемкость идеального газа.Расхождение теории теплоемкостей.
- •19.Внутренняя энергия тел.Теплоемкость изотропных и однородных тел.Количество теплоты.
- •21.Работа.Первое начало термодинамики.Равновесные и неравновесные процессы.
- •23. Скорость звука в газах. Уравнение Бернулли.
- •24.Тепловая машина.Кпд цикла.Холодильная Машина.Цикл Карно.Кпд Карно.
- •25.Формулировка Клаузиуса и Томсона(Кельвина) второго начала темодинамики.Первая теорема Карно.Равенство Клаузиуса.
- •26.Энтропия,Энтропия идеального.Вторая теорема Карно.Неравенство Клаузиуса.Изменени энтропии при необратимых процессах.
- •27.Формулировка второго начала темодинамики с помощью энтропии.Роль энтропии в производстве.Статистический характер.
- •28.Термодтнамическое равновесие. Эмпирические шкалы температур Международная практическая шкала Термодинамическая шкала Отрицательные абсолютные температуры
- •29.Понятие о термодинамич потенциалах.Принцип Ле-Шателье-Брауна.
- •30.Силы межмолекулярного взаимодействия.Ионная связь.Ковалентная связь.Силы Ван-дер-Ваальса.Потенциал Ленарда-Джонса.
- •31.Ураынение Ван-дер-Вальса. Изотермы газа Ван-дер-Вальса. Правило Максвела. Метостобильное состояние
- •32. Приведенное уравнения Ван-дер-Вальса. Внутрения энергия газа ванн-дер-Вальса.
- •33. Эффект Джоуля-Томсана
- •34.Переход из газообразного в жидкое. Экспериментальные изотермы.
- •35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
- •36.Зависимость свойств реальных газов от идеальных..
- •37.Вириальное ур состояния.
- •38.Сжижение газов. Свойство веществ при температуре близктй к 0.
- •39.Свойства и структура жидкостей жидкие кристаллы. Теплоёмкость жидкостей.
- •40.Поверхностное натяжение. Условия равновесия на границе двух жидкостей и на границе жидкость – твердое тело.
- •41.Давление под искривленной поверхностью жидкости. Капиллярные явления.
- •43.Кипение. Перегретая жидкость. Пузырьковая камера. Переохлажденный пар. Камера Вильсона.
- •44.Жидкие растворы. Растворимость. Теплота растворения.
- •45.Идеальные растворы. Закон Рауля. Закон Генри. Зависимость растворимости от температуры.
- •46. Диаграмма состояния раствора. Кипение жидких растворов.
- •48. Фазовые переходы первого и второго рода. Кристаллизация и плавление. Сублимация. Фазовые диаграммы. Полиморфизм.
- •49.Симметрия твердых тел. Кристаллические решетки. Примитивная решетка. Элементы симметрии решетки. Обозначения атомных плоскостей и направлений.
- •50.Теплоёмкость твёрдых тел. Физические процессы в кристаллах при деформациях. Дислокации.
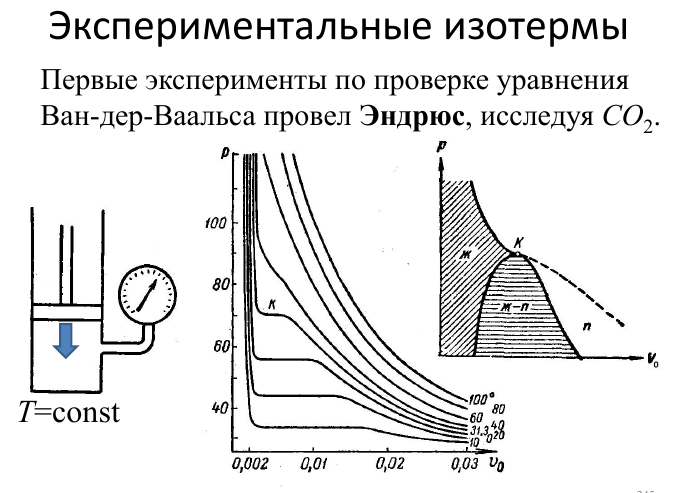
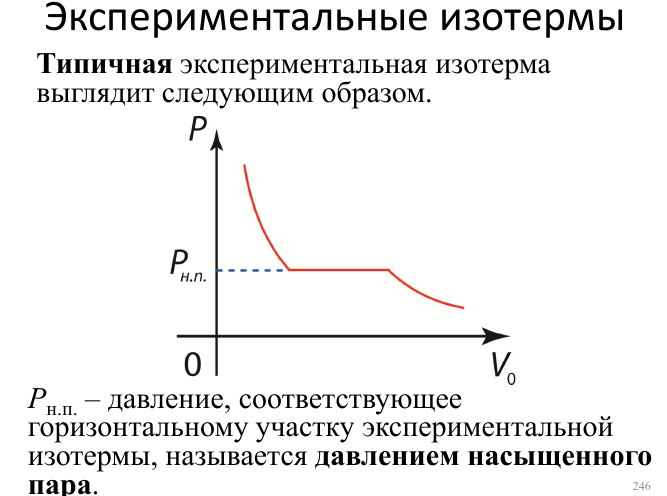
34.Переход из газообразного в жидкое. Экспериментальные изотермы.
Насыщенный пар
Если покинувшие жидкость молекулы удаляются из пространства вблизи поверхности жидкости, то в конце концов вся жидкость испарится. Если же молекулы, покинувшие жидкость, не удаляются, а удерживаются в замкнутом объеме около поверхности жидкости, то дальнейший процесс развивается по-другому. Покинувшие жидкость молекулы образуют пар. Молекулы пара, попавшие в область вблизи поверхности жидкости, силами притяжения втягиваются в жидкость. Таким образом, скорость испарения уменьшается. При дальнейшем увеличении плотности пара достигается такая ситуация, когда число молекул, покидающих жидкость за некоторое время, равно числу молекул, возвращающихся в жидкость за то же время. Наступает состояние динамического равновесия. Пар в состоянии динамического равновесия с жидкостью называется насыщенным. С увеличением плотности насыщенных паров поверхностное натяжение жидкости уменьшается, поскольку силы, направленные внутрь жидкости, уменьшаются ввиду роста противоположно направленных сил со стороны насыщенного пара. Отсюда же следует, что скрытая теплота парообразования с повышением температуры уменьшается. При критической температуре плотность насыщенных паров становится равной плотности жидкости и различие между ними исчезает. Это означает, что и поверхность исчезает, и, следовательно, поверхностное натяжение и скрытая теплота парообразования при критической температуре обращаются в нуль. При конденсации пара в жидкость его молекулы взаимно притягиваются, в результате чего их скорости, а следовательно, и их кинетическая энергия возрастают. Это ведет к нагреванию образующейся жидкости: теплота,
затраченная при испарении, отдается обратно при конденсации пара.
переход из газообразного в жидкое
Фазовый переход жидкость-пар является фазовым переходом первого рода. Характерной особенностью таких переходов является то, что они происходят при постоянной температуре, называемой температурой фазового перехода. Для поддержания температуры перехода постоянной в веществе выделяется или поглощается скрытая теплота фазового перехода (теплота парообразования, конденсации). Эта теплота затрачивается на изменение фазового состояния вещества.

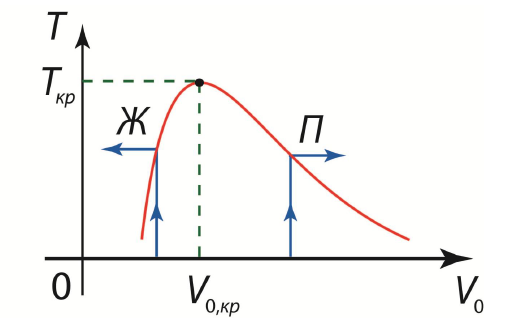
35. Поведение 2-х фазной сис-мы. Ур Клапейрона-Клаузиуса
Поведение двухфазной системы В двухфазной системе одновременно присутствуют две фазы. Если при заданном объеме мы будем повышать температуру, то в зависимости от начального соотношения жидкой и газообразной фаз весь сосуд постепенно заполнится либо жидкостью, либо паром.
Уравнение Клапейрона-Клаузиуса Рассматривая малый обратимый цикл Карно в системе, находящейся в двухфазном состоянии, можно получить уравнение Клапейрона-Клаузиуса
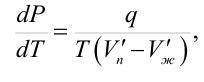
где q – удельная (на единицу массы) скрытая теплота фазового перехода; V’п и V’ж – удельные объемы газообразной и жидкой фаз. Уравнение Клапейрона-Клаузиуса связывает давление, при котором находится в равновесии двухфазная система, с температурой.
Если известны удельная скрытая теплота перехода и
объемы жидкой и газообразной фаз, то решение уравнения позволяет найти давление как функцию температуры.
