
- •Вступ Що вивчає фізика
- •Фізичні величини. Вимір фізичних величин
- •Спостереження і досліди - джерела фізичних знань.
- •Будова речовини
- •Розділ 1 механіка Механічний рух. Простір і час
- •Положення тіла або точки можна задати тільки відносно іншого тіла, яке називається тілом відліку.
- •Елементи кінематики
- •§1. Система відліку. Траєкторія, шлях, переміщення
- •Кінематикою називають розділ механіки, в якому рух тіл розглядається без з'ясування причин цього руху.
- •§2. Швидкість і прискорення руху
- •Прискорення
- •Приклад розв’язку задачі.
- •Рух тіл з прискоренням вільного падіння
- •§ 3. Рух по колу
- •Приклад розв’язку задачі.
- •Динаміка поступального руху
- •§4. Перший закон Ньютона. Маса. Сила
- •Динаміка - це розділ механіки, в якому вивчаються закони руху тіл і причини, які викликають, або змінюють ці рухи.
- •Взаємодія тіл. Сила.
- •Інерція. Маса тіла
- •Густина речовини
- •Перший закон Ньютона ( закон інерції)
- •§ 5. Другий закон Ньютона
- •§ 6. Третій закон Ньютона
- •§7. Сили в механіці. Закон всесвітнього тяжіння
- •Сила тяжіння.
- •Вага тіла Силу, з якою тіло внаслідок тяжіння до Землі діє на опору або підвіс, називають вагою тіла.
- •Невагомість
- •Сила тертя
- •Доцентрова сила
- •Відцентрова сила
- •Сила пружності. Закон Гука
- •§ 8. Закон збереження імпульсу
- •Тема 3 Робота і енергія
- •§ 9. Робота, енергія, потужність
- •Потужність. Одиниці потужності
- •Енергія. Закон збереження енергії.
- •Потенціальна енергія
- •Робота сили тяжіння дорівнює зміні потенціальної енергії тіла, узятій з протилежним знаком.
- •Робота сили пружності дорівнює зміні потенціальної енергії пружно деформованого тіла.
- •Закон збереження механічної енергії
- •Сума потенціальної і кінетичної енергії тіла або декількох тіл називається повною механічною енергією.
- •§ 10. Перетворення енергії і використання машин і механізмів. Коефіцієнт корисної дії
- •Розв’язок:
- •Тема 4 Динаміка обертального руху
- •§11. Рівновага тіл, які мають закріплену вісь обертання.
- •§12. Момент сили і момент інерції тіла відносно осі обертання.
- •Кінетична енергія обертального руху. Момент інерції.
- •Моменти інерції деяких тіл.
- •Теорема Штейнера.
- •§13. Основне рівняння динаміки обертального руху
- •§14. Момент імпульсу. Закон збереження моменту імпульсу
- •Розділ 2 основи молекулярної фізики і термодинаміки
- •Тема 5
- •Основні положення молекулярно-кінетичної теорії
- •§15. Дослідне підтвердження основних положень мкт Існування проміжків між частками
- •Малість розмірів часток речовини
- •Рух часток речовини
- •Дифузія
- •Взаємне притягання і відштовхування молекул
- •Швидкість руху часток і температура
- •Чим більша швидкість руху молекул тіла, тим вища його температура.
- •§16. Три стани речовини
- •§ 17. Кристалічні і аморфні тіла
- •Кристалізація аморфних тіл.
- •§ 18. Будова рідин
- •§ 19. Газоподібні тіла
- •Тема 6 Основні положення молекулярно-кінетичної теорії ідеального газу § 20. Ідеальний газ і його параметри
- •§ 21. Рівняння стану ідеального газу
- •§ 22. Газові процеси
- •§ 23. Основне рівняння мкт газів
- •§24. Температура
- •§25. Розподіл молекул за швидкостями
- •§ 26. Барометрична формула.
- •§ 27. Короткі відомості про атмосферу.
- •§ 28. Розподіл Больцмана
- •§ 29. Явища переносу
- •Середня довжина вільного пробігу і число зіткнень за секунду молекул газу.
- •Дифузія.
- •Теплопровідність
- •Внутрішнє тертя (в'язкість)
- •Тема 7 Перший закон термодинаміки
- •§ 30. Внутрішня енергія
- •§ 31. Перший закон термодинаміки Способи зміни внутрішньої енергії
- •§ 32. Теплоємність
- •§ 33. Перший закон термодинаміки для різних термодинамічних процесів
- •§ 34. Адіабатичний процес
- •Тема 8 Другий закон термодинаміки
- •§ 35. Теплові двигуни. Термодинамічні цикли. Цикл Карно
- •Двигун внутрішнього згорання
- •§ 36. Незворотність теплових процесів. Другий закон термодинаміки
- •§ 37. Статистичний зміст ентропії
- •Питання і задачі :
- •Розділ 3 електромагнетизм
- •Тема 8 Електростатика
- •§ 38. Електричний заряд. Закон Кулона
- •§ 39. Електричне поле
- •Принцип суперпозиції електричного поля.
- •§ 40. Потік вектора напруженості електричного поля. Теорема Гауса для електричного поля у вакуумі
- •Лінії напруженості електричного поля
- •§41. Робота електричного поля по переміщенню заряду. Потенціал
- •§ 42. Діелектрики і провідники в електричному полі. Поляризація діелектриків. Електроємність. Конденсатори
- •Електрична ємність
- •З'єднання конденсаторів
- •При послідовному з'єднанні конденсаторів складаються зворотні величини ємностей.
- •§43. Енергія електричного поля
- •Енергія зарядженого конденсатора дорівнює роботі зовнішніх сил, яку необхідно витратити, щоб зарядити конденсатор.
- •Тема 9 Електричний струм
- •§ 44. Сторонні сили. Електрорушійна сила. Напруга
- •§ 45. Закон Ома
- •§ 46. Послідовне і паралельне з'єднання провідників. Правила Кірхгофа
- •При послідовному з'єднанні повний опір кола дорівнює сумі опорів окремих провідників.
- •Правила Кірхгофа для розгалужених кіл
- •§ 47. Робота і потужність струму. Закону Джоуля-Ленца
- •Робота dA електричного струму I, що протікає по нерухомому провідникові з опором r, перетвориться в теплоту dQ, що виділяється в провіднику.
- •§ 48. Класична теорія електропровідності металів
- •Закон Ома
- •Закон Джоуля-Ленца.
- •Нині ведуться інтенсивні роботи по пошуку нових речовин з ще вищими значеннями Tкр.
- •Тема 10 Магнітне поле і його характеристики.
- •§49. Закон Ампера. Взаємодія паралельних струмів
- •§ 50. Закон Біо - Савара - Лапласа
- •§ 51. Теорема про циркуляцію вектора індукції магнітного поля
- •§ 52. Сила Лоренца
- •Тема 11
- •§ 53. Магнітне поле в речовині
- •Тема 12 Електромагнітна індукція
- •§ 54. Явище електромагнітної індукції. Правило Ленца
- •§ 55. Самоіндукція. Енергія магнітного поля
- •Енергія магнітного поля
- •Література
- •Тема 1
- •Національна металургійна академія України
- •49600, Г. Дніпропетровськ 5, пр. Гагаріна, 4
- •Редакційно-видавничий відділ нМетАу
§ 19. Газоподібні тіла
У природі існує величезна кількість газів: водень, кисень, вуглекислий газ, водяна пара, пари ртуті, азот, озон, хлор і так далі. Усі вони дуже різні. Водень легкий, а вуглекислий газ - важкий; азот не пахне, а озон - "щипає" ніс; водяні пари нешкідливі, а пари ртуті - отруйні; повітря безбарвне, а хлор має жовто-зелений колір. Проте усі без виключення гази мають одну загальну властивість: вони легко стискуються.


Рисунок 2.20а. Рисунок 2.20б.
На відміну від рідин і твердих тіл, гази можна стискувати дуже сильно: в 100 і більше разів. Чому ж це можливо?
Будова газоподібних тіл. В молекулярно-кінетичній теорії встановлено, що при тисках газу, близьких до атмосферного, відстані між молекулами газу у багато разів більші розмірів самих часток. Це схематично показано на рисунку 2.20а. Але якщо газ стискувати, тобто збільшити його тиск, то міжмолекулярні проміжки зменшуються. Це показано на рисунку 2.20б.
Згадаємо, що в газах дифузія протікає набагато швидше, ніж в рідких і твердих тілах. Значить, молекули газів вільно переміщаються в просторі. Це може бути лише у тому випадку, якщо кінетична енергія руху часток газу значно більша потенціальної енергії їх притягання одна до одної. Перевага кінетичної енергії молекул газу над їх потенціальною енергією якраз і означає, що молекули газу практично вільно літають на всіх напрямках. Тому, наприклад, неможливо заповнити газом половину посудини: літаючи у всіляких напрямах, молекули незабаром рівномірно розподіляться по усьому об’єму посудини.
![]() Тиск
газу. На
рисунку 2.21 зображено дві посудини: ліва
- з рідиною, а права - з газом. Кожна
посудина забезпечена трьома манометрами:
поблизу дна, в середній частині посудини
і поблизу горловини. Усі манометри
посудини з газом показують однакові
тиски, а манометри посудини з рідиною
- зростаючі значення у міру просування
від горловини до дна. Чому?
Тиск
газу. На
рисунку 2.21 зображено дві посудини: ліва
- з рідиною, а права - з газом. Кожна
посудина забезпечена трьома манометрами:
поблизу дна, в середній частині посудини
і поблизу горловини. Усі манометри
посудини з газом показують однакові
тиски, а манометри посудини з рідиною
- зростаючі значення у міру просування
від горловини до дна. Чому?
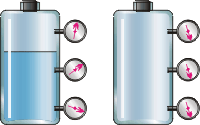

Рисунок 2.21. Рисунок 2.22.
Рідина давить на дно і стінки посудини тому, що на неї діє сила тяжіння. Частки рідини, притягуючись до Землі, придавлюють одна одну. Здійснюючи коливання, частки "бомбардують" дно і стінки посудини. Образно виражаючись, таке "підневільне бомбардування" і є тиск рідини. Саме тому тиск рідини зростає у міру опускання до дна посудини.
Тиск, що створюється газом, має принципово інше походження. На молекули газу теж діє сила тяжіння, проте вони не придавлюють одна одну, оскільки вільно літають у всіх напрямках усередині посудини. Частки постійно ударяються одна з одною і із стінками посудини. Образно кажучи, тиск газу - це вже "волелюбне бомбардування" (рис 2.22).
Встановлено, що при збільшенні температури тиск газу зростає. Молекулярно-кінетична теорія пояснює цей факт так. Підвищення температури призводить до збільшення швидкості руху часток газу. Тому "бомбардування" частками стінок посудини посилюється, що і означає зростання тиску газу. Подібно до рідин, гази теж передають на всі боки чинений на них тиск (закон Паскаля).
Рисунок 2.23 ілюструє відмінність газоподібної речовини від рідини на прикладі води. Молекула води H2O складається з одного атома кисню і двох атомів водню, розташованих під кутом 104°. Середня відстань між молекулами пари в десятки разів перевищує середню відстань між молекулами води.

Рисунок 2. 23.
Водяна пара (1) і вода (2). Молекули води збільшені приблизно в 5·107 разів.
У газах відстані між молекулами значно більша їх розмірів. Сили взаємодії між молекулами на таких великих відстанях малі, і кожна молекула рухається уздовж прямої лінії до чергового зіткнення з іншою молекулою або із стінкою посудини (рис 2.22) Середня відстань між молекулами повітря за нормальних умов порядку 10-8м, тобто в десятки разів перевищує розмір молекул. Слабку взаємодію між молекулами пояснює здатність газів розширюватися і заповнювати увесь об'єм посудини. У межі, коли взаємодія прагне до нуля, ми приходимо до уявлення про ідеальний газ.
Питання:
Як МКТ пояснює хорошу стисливість газів?
Охарактеризуй мікроскопічну будову газів.
У чому відмінність тисків, що створюються рідиною і газом?
Як МКТ пояснює збільшення тиску газу при підвищенні його температури?
