- •Інструментальні методи аналізу Особливості фізико-хімічних методів аналізу
- •2. Спектральні (оптичні) методи аналізу
- •Оптичні методи аналізу
- •2.1. Загальні принципи оптичної спектроскопії
- •2.2. Класифікація спектрів
- •2.3. Емісійний спектральний аналіз
- •2.4. Структура і характеристика елементів спектральних приладів
- •2.5. Якісний емісійний спектральний аналіз
- •2.5.1. Способи визначення довжин хвиль
- •2.6. Кількісний аналіз
- •2.7. Полум’яно-фотометричний аналіз
- •2.8. Молекулярно-абсорбційні методи аналізу
- •2.8.1. Якісний аналіз
- •2.8.1.1. Закон Бугера-Ламберта-Бера
- •2.8.1.2. Відхилення від закон Бугера-Ламберта-Бера
- •2.8.3. Схема приладів для вимірювання спектра поглинання
- •2.8.4. Кількісний фотоколориметричний аналіз
- •2.8.5. Турбідиметрія, нефелометрія
- •3. Хроматографічні методи аналізу
- •3.1. Загальна характеристика та класифікація хроматографічних методів аналізу
- •3.2. Принципова схема газового хроматографа
- •3.3. Хроматограма та її характеристики
- •3.4. Теоретичні основи хроматографічного розділення
- •3.4.1. Теорія рівноважної газової хроматографії
- •3.4.2. Теорія нерівноважної хроматографії
- •3.4.3. Теорія тарілок
- •3.5. Розділювальна здатність хроматографічної колонки
- •3.5.1. Основні фактори, що впливають на розділювальну здатність колонок
- •3.6. Якісний хроматографічний аналіз
- •3.7. Кількісний хроматографічний аналіз
- •4. Електрохімічні методи аналізу
- •4.1. Потенціометричні методи аналізу
- •4.1.1. Класифікація електродів. Аналітичний сигнал
- •Порівняльна характеристика електродів
- •Характеристики основних електродів порівняння
- •4.1.2. Способи проведення аналізу в потенціометрії
- •4.2. Кондуктометричні методи аналізу
- •4.2.1. Види електричної провідності
- •4.2.2 Пряма кондуктометрія
- •4.2.3. Кондуктометричне титрування
- •4.3. Кулонометричні методи аналізу
- •4.3.1. Пряма кулонометрія
- •4.3.2. Кулонометричне титрування
- •5. Полярографічні методи аналізу
- •5.1. Види поляризації
- •5.2. Принципова схема полярографічної установки
- •5.3. Полярографічна хвиля
- •5.4. Якісний полярографічний аналіз
- •5.5. Кількісний полярографічний аналіз
- •5.6. Причини спотворення форми полярограм
- •5.7. Амперометричне титрування
- •5.8. Інверсійна вольтамперометрія
- •5.8.1. Анодна інверсійна вольтамперометрія
- •Опис приладу для інверсійної вольтамперометрії марки акв-07мк
5.8. Інверсійна вольтамперометрія
У методі вольтамперометрії (як і полярографії) вимірюється величина електричного струму, що протікає між електродами в електролітичній комірці і залежить від напруги, яка прикладена до робочого електроду.
Залежність величини електричного струму від прикладеної напруги називається полярографічною чи вольтамперометричною кривою (полярограма чи вольтамперограма).
Полярографія - робочим електродом є рідка ртуть або інший рідкий провідник і поверхня цього електроду обновлюється утворенням нової краплі ртуті неперервно або періодично і розчин не перемішується.
Вольтамперометрія - робочим електродом є стаціонарний електрод, наприклад твердий електрод або стаціонарний ртутний електрод.
У полярографії та вольтамперометрії аналітичний сигнал (полярограму чи вольтамперограму, відповідно) отримують під час нагромадження речовини на поверхні робочого електрода.
Інверсійна (обернена) вольтамперометрія - аналітичний сигнал (вольтамперограму) отримують під час процесу розчинення речовини з поверхні робочого електрода, тобто процесу оберненого (інверсійного) до процесу нагромадження.
Суть методу інверсійної вольтамперометрії полягає у попередньому накопиченні аналізованої речовини електролізом з дуже розведеного розчину на електроді при постійному значенні потенціалу і наступним електрохімічним його розчиненням при потенціалі, який лінійно знижується. Розчин під час електролізу перемішується.
Після закінчення певного часу перемішування припиняється і розчин заспокоюється. За цей період потік речовини до електрода зменшується, а тому величина електричного струму швидко падає до величини стаціонарного дифузійного струму.
Після стадії заспокоєння проводиться розчинення виділеної речовини і запис аналітичного сигналу - вольтамперометричної кривої.
Процес розчинення речовини з робочого електрода в інверсійній вольтамперометрії відбувається внаслідок зміни потенціалу робочого електрода (розгортки потенціалу в часі з постійною швидкістю).
Залежно від природи процесів нагромадження та розчинення метод інверсійної вольтамперометрії поділяється на чотири групи: анодна ІВ; катодна ІВ; адсорбційна ІВ; ІВ з використанням модифікованих електродів.
Інверсійна вольтамперометрія називається анодною, якщо визначувана речовина, яка нагромаджена електролітично на стаціонарному робочому електроді (катоді «-»), в результаті зміни потенціалу у бік позитивних значень (рух потенціалу в анодну ділянку) переходить в розчин (розчиняється) з робочого електрода внаслідок процесу окиснення. Такий вид інверсійної вольтамперометрії використовують для визначення катіонів.
Для катодної інверсійної вольтамперометрії розгортка потенціалу відбувається до більш негативних потенціалів (рух потенціалу в катодну ділянку) і визначувана речовина, яка нагромаджена електролітично на робочому електроді, найчастіше як на аноді (діапазон від -200 мВ до +400 мВ), переходить у розчин з робочого електрода внаслідок процесу відновлення.
Інверсійна вольтамперометрія називається адсорбційною, якщо визначувана речовина в певній формі (сполуці) адсорбується на робочому електроді при концентруванні (нагромадженні), а розгортка потенціалу при розчиненні визначуваної речовини може здійснюватися як катодно, так і анодно в залежності від природи адсорбованої речовини.
Оскільки визначувана речовина переходить при електролізі з великого об'єму розчину в досить маленький об'єм плівки ртуті, концентрація її на поверхні електрода на кілька порядків вища, ніж у розчині.
Тобто, відбувається концентрування, що призводить до підвищення анодного струму окиснення порівняно зі струмом електролізу.
Чутливість методу інверсійної вольтамперометрії на 2 - 3 порядки вища, ніж полярографії. Цим методом можна визначати концентрації речовин в діапазоні 10-8... 10-6 М, а в деяких випадках - до 10-10 ... 10-9 М.
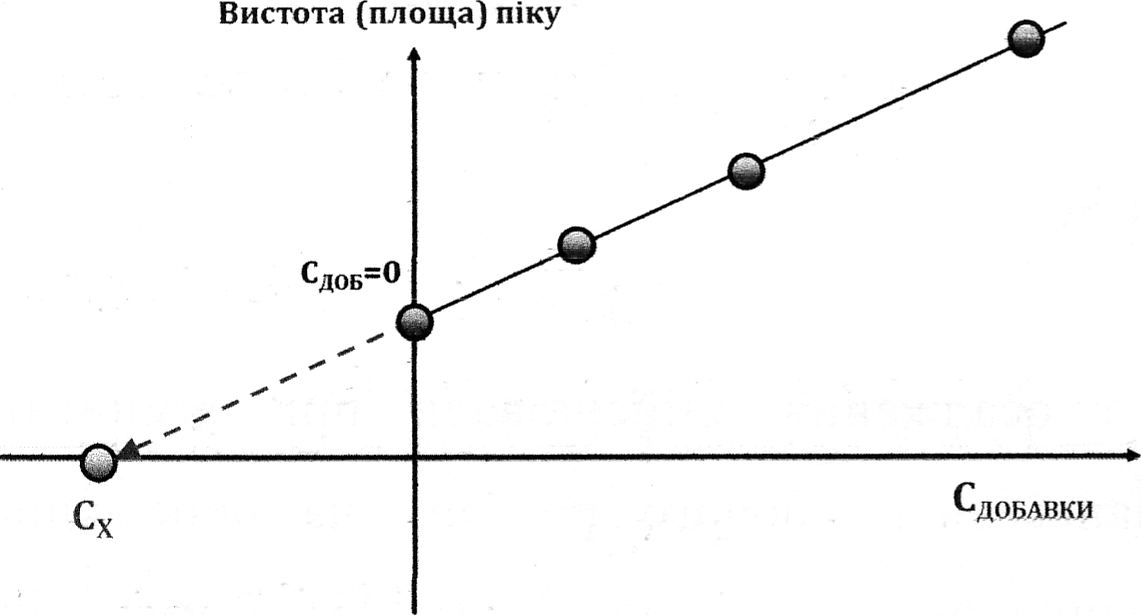
Висота (площа) піка розчинення речовини залежить від таких факторів:
а) кількості речовини, осадженої на електроді, яка є функцією її концентрації в розчині;
б) потенціалу накопичення і тривалості накопичення;
в) швидкості потоку речовини з об’єму розчину до електрода (швидкості обертання електрода);
г) складу розчину, температури та електрохімічних властивостей системи;
д) площі активної поверхні електрода;
е) швидкості розгортай потенціалу.
Розрахунки
приросту концентрації визначуваного
елемента можна проводити за спрощеною
формулою, яка не враховує збільшення
об’єму розчину в електролізері, оскільки
об’єм добавки є значно меншим, ніж об’єм
проби Vx=20-25
см3
>>>
Vдоб
= 0,1 -0,2 см3:
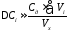 .
.
За отриманими даними будують калібрувальний графік за методом добавок для визначуваної речовини, використовуючи величини для приросту концентрації та відповідні значення кількісного параметру піка Р (h - висота, S- площа). Приріст концентрації для досліджуваного розчину без добавок Сдоб=0 мг/дм3.