
- •Інструментальні методи аналізу Особливості фізико-хімічних методів аналізу
- •2. Спектральні (оптичні) методи аналізу
- •Оптичні методи аналізу
- •2.1. Загальні принципи оптичної спектроскопії
- •2.2. Класифікація спектрів
- •2.3. Емісійний спектральний аналіз
- •2.4. Структура і характеристика елементів спектральних приладів
- •2.5. Якісний емісійний спектральний аналіз
- •2.5.1. Способи визначення довжин хвиль
- •2.6. Кількісний аналіз
- •2.7. Полум’яно-фотометричний аналіз
- •2.8. Молекулярно-абсорбційні методи аналізу
- •2.8.1. Якісний аналіз
- •2.8.1.1. Закон Бугера-Ламберта-Бера
- •2.8.1.2. Відхилення від закон Бугера-Ламберта-Бера
- •2.8.3. Схема приладів для вимірювання спектра поглинання
- •2.8.4. Кількісний фотоколориметричний аналіз
- •2.8.5. Турбідиметрія, нефелометрія
- •3. Хроматографічні методи аналізу
- •3.1. Загальна характеристика та класифікація хроматографічних методів аналізу
- •3.2. Принципова схема газового хроматографа
- •3.3. Хроматограма та її характеристики
- •3.4. Теоретичні основи хроматографічного розділення
- •3.4.1. Теорія рівноважної газової хроматографії
- •3.4.2. Теорія нерівноважної хроматографії
- •3.4.3. Теорія тарілок
- •3.5. Розділювальна здатність хроматографічної колонки
- •3.5.1. Основні фактори, що впливають на розділювальну здатність колонок
- •3.6. Якісний хроматографічний аналіз
- •3.7. Кількісний хроматографічний аналіз
- •4. Електрохімічні методи аналізу
- •4.1. Потенціометричні методи аналізу
- •4.1.1. Класифікація електродів. Аналітичний сигнал
- •Порівняльна характеристика електродів
- •Характеристики основних електродів порівняння
- •4.1.2. Способи проведення аналізу в потенціометрії
- •4.2. Кондуктометричні методи аналізу
- •4.2.1. Види електричної провідності
- •4.2.2 Пряма кондуктометрія
- •4.2.3. Кондуктометричне титрування
- •4.3. Кулонометричні методи аналізу
- •4.3.1. Пряма кулонометрія
- •4.3.2. Кулонометричне титрування
- •5. Полярографічні методи аналізу
- •5.1. Види поляризації
- •5.2. Принципова схема полярографічної установки
- •5.3. Полярографічна хвиля
- •5.4. Якісний полярографічний аналіз
- •5.5. Кількісний полярографічний аналіз
- •5.6. Причини спотворення форми полярограм
- •5.7. Амперометричне титрування
- •5.8. Інверсійна вольтамперометрія
- •5.8.1. Анодна інверсійна вольтамперометрія
- •Опис приладу для інверсійної вольтамперометрії марки акв-07мк
4.1. Потенціометричні методи аналізу
Потенціометричні методи аналізу ґрунтуються на залежності потенціалу електрода від складу розчину, в який він занурений.
Потенціал електрода для системи Ок + n ē Відн визначається за формулою Нернста:
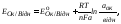 (4.1)
(4.1)
де
 – потенціал, що визначається природою
окисно-відновної пари,В;
R
– універсальна газова постійна (R=8,314
Дж/(мольК));
T
- абсолютна температура, К;
F
– число Фарадея (F=96485
Кл/моль);
aок
, aвідн
– активності окисненої та відновленої
форм речовини.
– потенціал, що визначається природою
окисно-відновної пари,В;
R
– універсальна газова постійна (R=8,314
Дж/(мольК));
T
- абсолютна температура, К;
F
– число Фарадея (F=96485
Кл/моль);
aок
, aвідн
– активності окисненої та відновленої
форм речовини.
Підставляючи в цю формулу значення констант за температури 298 К і переходячи до десяткових логарифмів, одержимо:
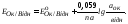 (4.2)
(4.2)
4.1.1. Класифікація електродів. Аналітичний сигнал
Електроди – це пристрої, за допомогою яких встановлюють процес переносу або розподілу зарядів, які виникають на поверхні розділу фаз. Виміряти абсолютне значення потенціалу електрода неможливо. Можна виміряти різницю потенціалів двох електродів, як електрорушійну силу гальванічного елемента, який вони складають. Тому, для проведення потенціометричного аналізу необхідно використовувати два електроди. Вони поділяються за призначенням і за принципом дії.
За призначенням електроди поділяються на індикаторні, потенціал яких залежить від складу досліджуваного розчину, і електроди порівняння (стандартні), потенціал яких відомий, постійний і не залежить від складу досліджуваного розчину.
До індикаторних електродів ставляться такі вимоги:
1) електрод повинен оборотно реагувати на зміну активності (концентрації) визначуваних іонів;
2) потенціал електрода повинен встановлюватися швидко;
3) електрод не повинен впливати на склад розчину (платиновий електрод може каталізувати перебіг деяких реакцій);
4) електрод має бути хімічно стійким відносно речовин, які присутні в розчині;
5) електрод не повинен поляризуватися, тобто його потенціал має бути незмінним;
6) електрод повинен мати просту конструкцію.
Електрод порівняння – це електрод, відносно якого вимірюють потенціал індикаторного електрода (він потрібен для вимірювання ЕРС гальванічного елементу).
Вимоги до електродів порівняння:
1) потенціал електрода повинен бути постійним і не залежати від складу аналізованого розчину;
2) електрод повинен мати малий опір.
Інші вимоги до електрода порівняння такі ж, як п. 3-6 вимог до індикаторного електрода.
За механізмом виникнення потенціалу на електродах, останні поділяються на електронообмінні (металеві) і мембранні (йоноселективні).
Порівняльна характеристика електродів обох типів приведена в табл 4.1.
Таблиця 4.1
Порівняльна характеристика електродів
|
Електронообмінні електроди (металеві) |
Йонообмінні електроди (мембранні) |
|
На міжфазній межі відбуваються реакції за участю електронів |
На міжфазній межі відбуваються реакції йонного обміну |
|
Мають електронну провідність |
Мають йонну провідність |
|
Залежність між рівноважним потенціалом і активністю йонів виражається рівнянням Нернста: | |
|
де n - число електронів, що беруть участь в півреакції; аок і авідн - активності окисненої і відновленої форм окисно-відновної пари |
де z - заряд йону з врахуванням знаку; а - активність йону в розчині |
В електронообмінних електродах потенціал виникає внаслідок обміну електронами між металом і розчином крізь поверхню розділу фаз. Вони діляться на кілька типів.
1. Активні електроди:
- електроди І роду – це метали (Pt, Ag, Cu, Cd, Au, Ir) у вигляді пластинки або дротинки, занурені у розчин добре розчинної солі цього металу. Вони використовуються як індикаторні електроди, є оборотними і дають відтворювані результати;
Потенціал електрода І роду залежить від активності іонів металу, з якого складається електрод, в розчині.
- електроди ІІ роду – це метали, занурені у насичений розчин малорозчинної солі цього металу в надлишку аніонів солі. Найчастіше використовують хлоридносрібний та каломелевий електроди (табл. 4.2). Вони служать електродами порівняння;
Потенціал електрода ІІ роду залежить від активності аніона малорозчинної солі металу в розчині.
- електроди ІІІ роду – це метали, занурені у розчин, насичений відносно двох малорозчинних солей зі спільним аніоном. Схема такого електрода: Ag, Ag2S, CdS│ Cd2+, NO3-.
Потенціал електрода IІІ роду залежить від активності катіона другої малорозчинної солі металу в розчині.
2. Інертні електроди виконують роль передавача електронів. Найчастіше це благородні метали (Au, Pt, Pd) або склоподібний вуглець.
Потенціал інертного електрода залежить від співвідношення активностей окисненої та відновленої форм.
Таблиця 4.2

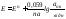 ,
,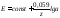 ,
,