
- •Інструментальні методи аналізу Особливості фізико-хімічних методів аналізу
- •2. Спектральні (оптичні) методи аналізу
- •Оптичні методи аналізу
- •2.1. Загальні принципи оптичної спектроскопії
- •2.2. Класифікація спектрів
- •2.3. Емісійний спектральний аналіз
- •2.4. Структура і характеристика елементів спектральних приладів
- •2.5. Якісний емісійний спектральний аналіз
- •2.5.1. Способи визначення довжин хвиль
- •2.6. Кількісний аналіз
- •2.7. Полум’яно-фотометричний аналіз
- •2.8. Молекулярно-абсорбційні методи аналізу
- •2.8.1. Якісний аналіз
- •2.8.1.1. Закон Бугера-Ламберта-Бера
- •2.8.1.2. Відхилення від закон Бугера-Ламберта-Бера
- •2.8.3. Схема приладів для вимірювання спектра поглинання
- •2.8.4. Кількісний фотоколориметричний аналіз
- •2.8.5. Турбідиметрія, нефелометрія
- •3. Хроматографічні методи аналізу
- •3.1. Загальна характеристика та класифікація хроматографічних методів аналізу
- •3.2. Принципова схема газового хроматографа
- •3.3. Хроматограма та її характеристики
- •3.4. Теоретичні основи хроматографічного розділення
- •3.4.1. Теорія рівноважної газової хроматографії
- •3.4.2. Теорія нерівноважної хроматографії
- •3.4.3. Теорія тарілок
- •3.5. Розділювальна здатність хроматографічної колонки
- •3.5.1. Основні фактори, що впливають на розділювальну здатність колонок
- •3.6. Якісний хроматографічний аналіз
- •3.7. Кількісний хроматографічний аналіз
- •4. Електрохімічні методи аналізу
- •4.1. Потенціометричні методи аналізу
- •4.1.1. Класифікація електродів. Аналітичний сигнал
- •Порівняльна характеристика електродів
- •Характеристики основних електродів порівняння
- •4.1.2. Способи проведення аналізу в потенціометрії
- •4.2. Кондуктометричні методи аналізу
- •4.2.1. Види електричної провідності
- •4.2.2 Пряма кондуктометрія
- •4.2.3. Кондуктометричне титрування
- •4.3. Кулонометричні методи аналізу
- •4.3.1. Пряма кулонометрія
- •4.3.2. Кулонометричне титрування
- •5. Полярографічні методи аналізу
- •5.1. Види поляризації
- •5.2. Принципова схема полярографічної установки
- •5.3. Полярографічна хвиля
- •5.4. Якісний полярографічний аналіз
- •5.5. Кількісний полярографічний аналіз
- •5.6. Причини спотворення форми полярограм
- •5.7. Амперометричне титрування
- •5.8. Інверсійна вольтамперометрія
- •5.8.1. Анодна інверсійна вольтамперометрія
- •Опис приладу для інверсійної вольтамперометрії марки акв-07мк
4.3. Кулонометричні методи аналізу
Кулонометричні методи аналізу ґрунтуються на вимірюванні кількості електрики, яка витрачається на електрохімічну реакцію. В електрохімічній реакції бере участь або визначувана речовина (пряма кулонометрія), або утворюється речовина, яка кількісно реагує з визначуваною речовиною (кулонометричне титрування).
Основою кулонометрії є закони Фарадея. Згідно І-го закону Фарадея, маса речовини, що виділяється на електроді, прямо пропорційна кількості електрики, яка витратилась на електроліз:
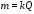 (4.11)
(4.11)
де m - маса речовини, г; Q - кількість електрики, Кл, k - коефіцієнт, електрохімічний еквівалент речовини, г/Кл.
Оскільки Q=I∙t, де I – сила струму, А; t – час електролізу, с, то І-й закон Фарадея можна записати також у вигляді:
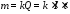 . (4.12)
. (4.12)
За ІІ-м законом Фарадея електрохімічний еквівалент речовини пропорційний її хімічному еквіваленту:
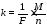 (4.13)
(4.13)
де M - молярна маса речовини, г/моль; n - кількість електронів, які беруть участь в реакції; F - число Фарадея (F = 96500 Кл/моль).
Об’єднана формула законів Фарадея:
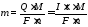 (4.14)
(4.14)
Необхідні умови використання електрохімічної реакції в кулонометриному аналізі:
1) електрохімічне перетворення речовини повинно перебігати із 100% виходом за струмом, тобто повинні бути відсутні побічні електродні реакції. При наявності побічних реакцій маса речовини, яка дійсно прореагувала на електроді, буде менша за масу речовини, розрахованої за формулою 4.14. Відношення цих мас називається виходом за струмом (η):
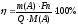 (4.15)
(4.15)
2) момент закінчення електрохімічної реакції необхідно достатньо точно встановити.
3) повинен існувати спосіб точного вимірювання кількості електрики, яка витрачається на електрохімічну реакцію.
Кулонометричний аналіз проводиться на кулонометричній установці (рис. 4.3), яка складається з джерела постійного електричного струму, електролізера, приладу для вимірювання кількості електрики.
|
|
1 – джерело постійного електричного струму; 2 - вимірюючий пристрій; 3 - ємність для електролізу: 4 - допоміжна камера; 5 - катод (Pt); 6 - анод у вигляді сітки (Pt); 7 - скляна перегородка; 8 - магнітний перемішувач |
|
Рис.4.3. Схема кулонометричної комірки |
Джерелом електричного струму є або батареєю акумуляторів чи гальванічних елементів, або випрямляч змінного струму з регульованою вихідною напругою чи струмом.
4.3.1. Пряма кулонометрія
Пряма потенціостатична кулонометрія проводиться при постійному потенціалі робочого електрода. Склад електроліту робочої камери і потенціал робочого електроду вибирають такими, щоб забезпечити 100 % вихід за струмом. В процесі електролізу кількість носіїв заряду зменшується, тобто, зменшується електрична провідність розчину, що при постійному потенціалі призводить до зменшення сили струму.
Пряма амперостатична кулонометрія не використовується, якщо визначуваний іон знаходиться в розчині. У цьому випадку в процесі електролізу концентрація носіїв заряду зменшується, що призводить до зменшення електричної провідності і, при забезпеченні постійності сили струму, до збільшення потенціалу електрода.
Вона проводиться, коли джерело постійного струму забезпечує регульовану, постійну в часі силу струму незалежно від характеристики електролітичної комірки (I=сonst). Якщо визначувана речовина знаходиться на електроді у твердому вигляді (наприклад, метал, оксиди металів), потенціал електроду практично не змінюється. Після повного розчинення твердої речовини, яка вкриває електрод, потенціал електрода різко збільшується. Цей стрибок потенціалу дозволяє зафіксувати час розчинення визначуваної речовини і розрахувати кількість електрики. Амперостатична кулонометрія застосовується для визначення товщини металевих покрить або оксидних плівок на різних поверхнях.

