
- •Інструментальні методи аналізу Особливості фізико-хімічних методів аналізу
- •2. Спектральні (оптичні) методи аналізу
- •Оптичні методи аналізу
- •2.1. Загальні принципи оптичної спектроскопії
- •2.2. Класифікація спектрів
- •2.3. Емісійний спектральний аналіз
- •2.4. Структура і характеристика елементів спектральних приладів
- •2.5. Якісний емісійний спектральний аналіз
- •2.5.1. Способи визначення довжин хвиль
- •2.6. Кількісний аналіз
- •2.7. Полум’яно-фотометричний аналіз
- •2.8. Молекулярно-абсорбційні методи аналізу
- •2.8.1. Якісний аналіз
- •2.8.1.1. Закон Бугера-Ламберта-Бера
- •2.8.1.2. Відхилення від закон Бугера-Ламберта-Бера
- •2.8.3. Схема приладів для вимірювання спектра поглинання
- •2.8.4. Кількісний фотоколориметричний аналіз
- •2.8.5. Турбідиметрія, нефелометрія
- •3. Хроматографічні методи аналізу
- •3.1. Загальна характеристика та класифікація хроматографічних методів аналізу
- •3.2. Принципова схема газового хроматографа
- •3.3. Хроматограма та її характеристики
- •3.4. Теоретичні основи хроматографічного розділення
- •3.4.1. Теорія рівноважної газової хроматографії
- •3.4.2. Теорія нерівноважної хроматографії
- •3.4.3. Теорія тарілок
- •3.5. Розділювальна здатність хроматографічної колонки
- •3.5.1. Основні фактори, що впливають на розділювальну здатність колонок
- •3.6. Якісний хроматографічний аналіз
- •3.7. Кількісний хроматографічний аналіз
- •4. Електрохімічні методи аналізу
- •4.1. Потенціометричні методи аналізу
- •4.1.1. Класифікація електродів. Аналітичний сигнал
- •Порівняльна характеристика електродів
- •Характеристики основних електродів порівняння
- •4.1.2. Способи проведення аналізу в потенціометрії
- •4.2. Кондуктометричні методи аналізу
- •4.2.1. Види електричної провідності
- •4.2.2 Пряма кондуктометрія
- •4.2.3. Кондуктометричне титрування
- •4.3. Кулонометричні методи аналізу
- •4.3.1. Пряма кулонометрія
- •4.3.2. Кулонометричне титрування
- •5. Полярографічні методи аналізу
- •5.1. Види поляризації
- •5.2. Принципова схема полярографічної установки
- •5.3. Полярографічна хвиля
- •5.4. Якісний полярографічний аналіз
- •5.5. Кількісний полярографічний аналіз
- •5.6. Причини спотворення форми полярограм
- •5.7. Амперометричне титрування
- •5.8. Інверсійна вольтамперометрія
- •5.8.1. Анодна інверсійна вольтамперометрія
- •Опис приладу для інверсійної вольтамперометрії марки акв-07мк
4.3.2. Кулонометричне титрування
Кулонометричне титрування полягає в тому, що в розчин з речовиною, яку аналізують (A), додають допоміжний електроліт (Z), який при певних умовах піддається електролізу з утворенням проміжного реагента (T), який реагує з досліджуваною речовиною.
Z + e = T на електроді
A + T = B в розчині
Коли вся досліджувана речовина прореагує (точка еквівалентності), електроліз припиняють і визначають кількість електрики, яка пішла на електроліз за цей період. Особливістю кулонометричного титрування є відсутність розчину титранта. Речовина, яка вступає в реакцію титрування з визначуваною речовиною утворюється (генерується) в розчині на робочому електроді.
Точка еквівалентності в кулонометричному титруванні може бути визначена або хімічним методом (за допомогою хімічних індикаторів), або фізико-хімічними методами (електрохімічними або фотометричними).
Визначувані речовини можуть бути як неелектроактивними, так і електроактивними.
У випадку електроактивних визначуваних речовин можливий наступний перебіг реакцій:
Z + e = T на електроді
A + e = B на електроді
A + T = B + Z в розчині
У цьому випадку кількість електрики, яка проходить через електрод, витрачається на реакцію з визначуваною речовиною і допоміжним електролітом, але, внаслідок швидкого і повного проходження реакції в розчині (реакція титрування), сумарна кількість визначуваної речовини, що прореагувала, точно відповідає кількості електрики, яка проходить через електрод. Реакція в розчині призводить до регенерації допоміжного реактива (Z), концентрація якого до точки еквівалентності не змінюється і можна не давати його великого надлишку.
Переваги кулометричноо титування:
1. немає необхідностіь приготування і стандартизації розчину титранту.
2. можна використовувати для титрування речовини, стандартні розчини яких нестабільні.
3. розчин під час титрування не розбавляється.
4. в одному і тому ж розчині допоміжного електроліту можливе проведення титрування декількох зразків.
5. титрування може бути повністю автоматизоване.
6. в одному розчині можна визначати кілька речовин.
5. Полярографічні методи аналізу
5.1. Види поляризації
Полярографічні методи аналізу ґрунтуються на явищах поляризації на електроді з малою поверхнею, які виникають при проходженні електричного струму через розчин електроліту. Цей метод запропонований чеським вченим Я. Гейровським у 1922 році.
Поляризацією називається явище, зумовлене проходженням електричного струму через розчин електроліту, яке викликає відхилення потенціалу електрода від рівноважного значення, розрахованого за рівнянням Нернста. Поляризація буває хімічна, електрохімічна і концентраційна.
Якщо
в розчин електроліту занурити 2
індиферентних електрода (наприклад,
платинові) і сполучити їх з зовнішнім
джерелом постійного електричного
струму, то на одному з електродів (катоді)
починається процес відновлення катіонів,
на іншому (аноді) - окиснення аніонів.
Через розчин буде проходити електричний
струм, а на електродах будуть відкладатися
продукти електродних реакцій. Наприклад,
якщо у воді розчинена сіль CdCl2,
катод вкриється металічним Cd, а анод -
абсорбованим Cl2.
Через деякий час індиферентні електроди
перетворюються в електроди І роду:
Cd│Cd2+
i Cl2│2Cl–,
які складають гальванічний елемент з
ЕРС =
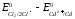 .
Якщо напруга зовнішнього джерела струму
менша ЕРС утвореного гальванічного
елемента, через деякий час струм
припиняється.
.
Якщо напруга зовнішнього джерела струму
менша ЕРС утвореного гальванічного
елемента, через деякий час струм
припиняється.
Процес виникнення різниці потенціалів між зануреними в розчин індиферентними електродами під впливом електролізу називається хімічною поляризацією. ЕРС, яка при цьому виникає, називають ЕРС хімічної поляризації (Ехп). Ехп залежить від катіонного і аніонного складу електроліту і його концентрації.
Очевидно, що для забезпечення перебігу електролізу, до електродів необхідно прикласти напругу більшу ніж Ехп. Додаткова різниця потенціалів, необхідна для забезпечення перебігу електролізу з певною швидкістю називається електрохімічною поляризацією або перенапругою. Перенапруга (η) залежить від властивості іона і матеріалу електрода та характеру його поверхні.
В результаті електролізу простір навколо електрода збіднюється відповідними іонами. Виникає різниця концентрацій іонів в основній масі розчину (Со) і в приелектродному шарі (Сs). Цей градієнт концентрацій викликає додаткову різницю потенціалів.
Додаткова
різниця потенціалів, яка виникає
внаслідок збіднення приелектродного
шару іонами, називається концентраційною
поляризацією. Її можна обчислити за
рівнянням:
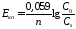 .
.
