
- •Лекція № 1 Коротка історія, предмет і завдання аналітичної хімії
- •Хімiчний склад. Види аналізу
- •Класифікація методів аналізу
- •Аналiтичний сигнал
- •Якісний хімічний аналіз Класифікація якісних аналітичних реакцій
- •Класифікація методів якісного аналізу катіонів
- •Аналітична класифікація катіонів за сірководневим методом аналізу
- •Аналітична класифікація аніонів
- •Аналіз речовин невідомого складу
- •Основні закономірності протікання хімічних реакцій
- •Швидкість хімічних реакцій. Закон діючих мас. Константа рівноваги
- •Дисоціація електролітів
- •Йонізація води. Водневий та гідроксильний показники
- •Розрахунок рН розчинів сильних кислот та основ
- •Константа електролітичної дисоціації слабкого електроліту
- •Вплив однойменних іонів на ступінь дисоціації слабкого електроліту
- •Розрахунок рН розчинів слабких кислот та основ
- •Буферні розчини
- •Гідроліз солей
- •Лекція № 2 Титриметричні методи аналізу Загальна характеристика титриметричного аналізу
- •Стандартизація розчинів титрантів
- •Основні способи титрування
- •Метрологічні характеристики результатів аналізу
- •Принцип еквівалентності в титриметричному аналiзi
- •Кислотно-основне титрування
- •Кислотно-основні індикатори
- •Методи вибору індикаторів
- •0,1 М розчину hCl 0,1 m розчином NaOh
- •0,1 М розчину сн3соон 0,1 m розчином NaOh
- •Лекція №3 Окисно-відновне титрування Загальна характеристика окисно-відновних реакцій
- •Окисно-відновні потенціали
- •Рівняння Нернста
- •Константи рівноваги окисно-відновних реакцій
- •Вплив різних чинників на швидкість окисно-відновних реакцій
- •Редокс-індикатори та вибір індикаторів для окисно-відновного титрування
- •Криві окисно-відновного титрування
- •Методи окисно-вiдновного титрування Перманганатометрія
- •Йодометрiя
- •Хроматометрія
- •Лекція №4 Комплексонометричний аналiз Загальна характеристика методу
- •Способи комплексонометричного титрування
- •Способи фiксування точки еквiвалентностi
- •Осадження та розчинення малорозчинних сполук Добуток розчинності та розчинність малорозчинних сполук
- •Умови утворення осадів
- •Гравiметричний аналiз
- •Умови утворення осадів
- •Співосадження
- •Розрахунки в гравiметричному аналiзi
Дисоціація електролітів
Розпад молекул електролітів на йони під дією розчинника називається електролітичною дисоціацією або йонізацією.
Кількісною характеристикою здатності електролітів розпадатися на йони є ступінь електролітичної дисоціації (йонізації) α, який показує, яка частина молекул розчиненої речовини розпалася на йони:
 . (3.2)
. (3.2)
Величину α виражають в частках (вiд 0 до 1) або у % (вiд 0 до 100%).
За здатністю речовин до дисоцiацiї всі електролiти поділяються на три групи:
1) сильні (α > 30 %): HCl, HBr, HNO3, H2SO4, NaOH, KOH, Ba(OH)2, майже всi розчиннi у водi солi;
2) середньої сили (α = 5–30 %): H3AsO4, H3PO4, H2SO3, H2C2O4 та iншi;
3) слабкі (α < 5 %): H2CO3, HBO2, HCN, H2S, NH4OH, HgCl2, CdCl2 та iншi.
Закон дії мас застосовують до реакцій дисоціації слабких електролітів, реакцій утворення осадів та комплексних сполук, до процесів гідролізу солей. Для сильних електролітів закон дії мас виконується точно, якщо замість концентрації реагентів використовувати активність (а) - ефективну, уявну концентрацію речовини, відповідно до якої вона діє у реакції:
a = γ∙C, (3.3)
де С - концентрація речовини моль/дм3; γ - коефіцієнт активності, безрозмірна величина, що є мірою впливу різних чинників на концентрацію.
Значення коефіцієнту активності залежить не тільки від концентрації електроліту в розчині, але і від присутності в ньому інших електролітів. Вплив всіх йонів, присутніх у розчині, враховує йонна сила розчину μ:
 , (3.4)
, (3.4)
де сi - концентрація кожного йону в розчині; zi - заряд даного йону.
Коефіцієнт активності пов’язаний з йонною силою розчину співвідношенням
-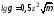 . (3.5)
. (3.5)
Значення коефіцієнта активності знижується із зростанням йонної сили розчину, тобто залежить від присутності в розчині сторонніх електролітів.
Йонізація води. Водневий та гідроксильний показники
Більшість аналітичних реакцій відбуваються у водних розчинах. Вода є слабким електролітом і незначно йонізується:
H2O↔H+ + OH-.
За 25 °С в 1 дм3 води розпадаються на йони лише 10–7 моль.
Під час йонізації з кожної молекули утворюється по одному йону H+ i OH–, тобто [H+]=[OH–]=10-7 моль/дм3.
Константу рiвноваги для цiєї дисоцiацiї можна записати як:
 або
або
 .
.
Оскільки вода, в основному, знаходиться у вигляді нейонізованих молекул, то значення [Н2О] можна вважати постійним. Тому ліва частина цього рівняння, а, відповідно, і добуток [H+][ОН-] є величиною постійною. Її називають йонним добутком води і позначають КW:
 . (3.6)
. (3.6)
Оскільки за 25 °С у чистій воді [H+]=[OH–]=10-7 моль/дм3, то КW=10-7∙10-7=10-14. Підвищення температури приводить до збільшення значення КW.
Суть цього рівняння: як би не змінювалася концентрація водневих чи гідроксильних йонів, їх добуток у водному розчині є величиною постійною і за 25 °С має значення 10-14. Додавання до чистої води кислоти приведе до збільшення концентрації водневих йонів і вона буде більшою, ніж 10-7, але одночасно зменшиться концентрація гідроксильних йонів у стільки ж разів і буде меншою, ніж 10-7. Тобто в розчині кислоти [H+] > 10-7.
Під час додавання основи спостерігатиметься зворотний процес - збільшується концентрація гідроксильних йонів та зменшується водневих: [OH–] > 10-7.
У нейтральних розчинах [H+]=[OH–]=10-7. У практиці замість значень концентрацій зручніше користуватись від’ємним логарифмом цих величин.
Кислотність розчинів характеризує водневий показник або рН:
 . (3.7)
. (3.7)
Основність розчинів характеризує гідроксильний показник або рОН:
 . (3.8)
. (3.8)
 . (3.9)
. (3.9)
Знаючи концентрацію гідроксильних йонів, рН або рОН, можна розрахувати вміст водневих йонів в розчині:
 .
.
