
- •Лекція № 1 Коротка історія, предмет і завдання аналітичної хімії
- •Хімiчний склад. Види аналізу
- •Класифікація методів аналізу
- •Аналiтичний сигнал
- •Якісний хімічний аналіз Класифікація якісних аналітичних реакцій
- •Класифікація методів якісного аналізу катіонів
- •Аналітична класифікація катіонів за сірководневим методом аналізу
- •Аналітична класифікація аніонів
- •Аналіз речовин невідомого складу
- •Основні закономірності протікання хімічних реакцій
- •Швидкість хімічних реакцій. Закон діючих мас. Константа рівноваги
- •Дисоціація електролітів
- •Йонізація води. Водневий та гідроксильний показники
- •Розрахунок рН розчинів сильних кислот та основ
- •Константа електролітичної дисоціації слабкого електроліту
- •Вплив однойменних іонів на ступінь дисоціації слабкого електроліту
- •Розрахунок рН розчинів слабких кислот та основ
- •Буферні розчини
- •Гідроліз солей
- •Лекція № 2 Титриметричні методи аналізу Загальна характеристика титриметричного аналізу
- •Стандартизація розчинів титрантів
- •Основні способи титрування
- •Метрологічні характеристики результатів аналізу
- •Принцип еквівалентності в титриметричному аналiзi
- •Кислотно-основне титрування
- •Кислотно-основні індикатори
- •Методи вибору індикаторів
- •0,1 М розчину hCl 0,1 m розчином NaOh
- •0,1 М розчину сн3соон 0,1 m розчином NaOh
- •Лекція №3 Окисно-відновне титрування Загальна характеристика окисно-відновних реакцій
- •Окисно-відновні потенціали
- •Рівняння Нернста
- •Константи рівноваги окисно-відновних реакцій
- •Вплив різних чинників на швидкість окисно-відновних реакцій
- •Редокс-індикатори та вибір індикаторів для окисно-відновного титрування
- •Криві окисно-відновного титрування
- •Методи окисно-вiдновного титрування Перманганатометрія
- •Йодометрiя
- •Хроматометрія
- •Лекція №4 Комплексонометричний аналiз Загальна характеристика методу
- •Способи комплексонометричного титрування
- •Способи фiксування точки еквiвалентностi
- •Осадження та розчинення малорозчинних сполук Добуток розчинності та розчинність малорозчинних сполук
- •Умови утворення осадів
- •Гравiметричний аналiз
- •Умови утворення осадів
- •Співосадження
- •Розрахунки в гравiметричному аналiзi
Рівняння Нернста
Якщо компоненти окисно-вiдновної пари не перебувають в стандартному станi, то змiна вiльної енергiї i величина окисно-вiдновного потенцiалу системи будуть залежати вiд активностi даної пари. Так, для реакцiї
Ок. + ne– Вiдн. (VII)
змiна вiльної енергiї системи описується рiвнянням
 , (6.5)
, (6.5)
де R=8.31441 Дж/(мольК) – унiверсальна газова постiйна; Т – абсолютна температура, К; аок, авідн– активностi окисненої та вiдновленої форм речовини. Або
 . (6.6)
. (6.6)
Цей вираз носить назву рівняння Нернста.
Переходячи вiд активностей до рiвноважних концентрацiй частинок в розчинi одержимо:
 . (6.7)
. (6.7)
Потенцiал окисно-вiдновної пари, обчислений за рiвнянням Нернста для будь-яких концентрацiй, називають рівноважним потенціалом.
Величина окисно-вiдновного потенцiалу залежить вiд природи речовини (oок/відн), йонної сили розчину, концентрацiї окисненої [Ок] та вiдновленої [Вiдн] форм речовини, рН середовища та температури.
Константи рівноваги окисно-відновних реакцій
Напрям протiкання окисно-вiдновних реакцiй можна встановити за величинами стандартних окисно-вiдновних потенцiалів пар. Однак, для розрахунку повноти протiкання реакцiї потрiбно користуватися значеннями констант рiвноваги. Для будь-якої окисно-вiдновної реакцiї
aОк1 + bВiдн2 aВiдн1 + bОк2 (X)
стан рiвноваги описується виразом
 , (6.8)
, (6.8)
де KC – концентраційна константа рівноваги.
Якщо представити цю реакцiю у виглядi двох пiвреакцiй та визначити їх потенцiали
a Ок1 + be– Вiдн1 1 = o1 + (0.059/b)lg[Ок1]/[Відн1] (6.9)
–b Ок2 + ae– Вiдн2 2 = o2 + (0.059/a)lg[Ок2]/[Відн2] (6.10)
___________________________
aОк1 + bВiдн2 aВiдн1 + bОк2,
то в стані рiвноваги, 1 = 2. Звiдcи
 . (6.11)
. (6.11)
Вираз пiд логарифмом є константою рiвноваги
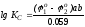 , (6.12)
, (6.12)
де ab=n – спiльне число електронiв, що передаються при протіканні окисно-відновної реакцiї.
Якщо КС > 1103, то реакцiя протiкає майже до кiнця злiва направо (практично незворотня), однак, якщо КС < 1103, то реакцiя злiва направо практично не протiкає. При промiжних значеннях KС реакцiя до кiнця не протiкає, тобто при рiвновазi в розчинi присутнi в помiтнiй кiлькостi як вихiднi речовини, так i продукти реакцiї.
Вплив різних чинників на швидкість окисно-відновних реакцій
Швидкість окисно-вiдновних реакцiй в значнiй мiрi залежить вiд природи реагуючих речовин, концентрації, температури, присутності каталізаторів або інгібіторів, протікання індукованих або супряжених реакцій.
Збiльшення концентрації вихiдних речовин у розчинi прискорює реакцiю в цiлому пропорцiйно константi швидкостi та концентрацiям у вiдповiдних ступенях.
Пiдвищення температури на 10 оC прискорює реакцiю в 2-4 рази, що часто використовують в аналiзі.
Значний вплив на швидкiсть окисно-вiдновних реакцiй мають каталізатори, пiд дiєю яких швидкiсть може зростати в десятки й сотнi разiв.
Суттєве ускладнення при аналiзi може викликати утворення в процесі реакцiї промiжних сполук, що мають пiдвищену хiмiчну активнiсть. Вони переважно вступають в побiчнi реакцiї, що приводить до завищених результатiв аналізів. Реакцiї такого типу Н.А.Шилов назвав супряженими або індукованими.
Індукованими реакціями називають дві реакції, які протікають в гомогенному середовищі, з яких перша протікає самочинно (первинна реакція), а друга протікає тільки в присутності першої (вторинна, індукована реакція).
