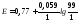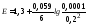- •Лекція № 1 Коротка історія, предмет і завдання аналітичної хімії
- •Хімiчний склад. Види аналізу
- •Класифікація методів аналізу
- •Аналiтичний сигнал
- •Якісний хімічний аналіз Класифікація якісних аналітичних реакцій
- •Класифікація методів якісного аналізу катіонів
- •Аналітична класифікація катіонів за сірководневим методом аналізу
- •Аналітична класифікація аніонів
- •Аналіз речовин невідомого складу
- •Основні закономірності протікання хімічних реакцій
- •Швидкість хімічних реакцій. Закон діючих мас. Константа рівноваги
- •Дисоціація електролітів
- •Йонізація води. Водневий та гідроксильний показники
- •Розрахунок рН розчинів сильних кислот та основ
- •Константа електролітичної дисоціації слабкого електроліту
- •Вплив однойменних іонів на ступінь дисоціації слабкого електроліту
- •Розрахунок рН розчинів слабких кислот та основ
- •Буферні розчини
- •Гідроліз солей
- •Лекція № 2 Титриметричні методи аналізу Загальна характеристика титриметричного аналізу
- •Стандартизація розчинів титрантів
- •Основні способи титрування
- •Метрологічні характеристики результатів аналізу
- •Принцип еквівалентності в титриметричному аналiзi
- •Кислотно-основне титрування
- •Кислотно-основні індикатори
- •Методи вибору індикаторів
- •0,1 М розчину hCl 0,1 m розчином NaOh
- •0,1 М розчину сн3соон 0,1 m розчином NaOh
- •Лекція №3 Окисно-відновне титрування Загальна характеристика окисно-відновних реакцій
- •Окисно-відновні потенціали
- •Рівняння Нернста
- •Константи рівноваги окисно-відновних реакцій
- •Вплив різних чинників на швидкість окисно-відновних реакцій
- •Редокс-індикатори та вибір індикаторів для окисно-відновного титрування
- •Криві окисно-відновного титрування
- •Методи окисно-вiдновного титрування Перманганатометрія
- •Йодометрiя
- •Хроматометрія
- •Лекція №4 Комплексонометричний аналiз Загальна характеристика методу
- •Способи комплексонометричного титрування
- •Способи фiксування точки еквiвалентностi
- •Осадження та розчинення малорозчинних сполук Добуток розчинності та розчинність малорозчинних сполук
- •Умови утворення осадів
- •Гравiметричний аналiз
- •Умови утворення осадів
- •Співосадження
- •Розрахунки в гравiметричному аналiзi
Редокс-індикатори та вибір індикаторів для окисно-відновного титрування
Окисно-відновними, або редокс-індикаторами, називаються речовини, якi змінюють свій колір в залежності від окисно-відновного потенціалу системи.
У розчинi редокс-iндикатор може iснувати в окисненiй та вiдновленiй формi, мiж якими встановлюється рiвновага:
Indок + ne– Indвідн (XI)
де Indок, Indвідн – окиснена та вiдновлена форми iндикатора; n – число електронiв, що приймають участь в окисно-вiдновному процесi.
Потенцiал iндикаторної системи може бути визначений з рiвняння Нернста:
 . (6.13)
. (6.13)
Приймаючи до уваги те, що змiну кольору око сприймає, коли концентрацiя однiєї з забарвлених форм у 10 разiв перевищує концентрацiю iншої форми, визначимо iнтервал переходу забарвлення:
 або
або

Пiдставляючи значення останнього виразу в рiвняння Нернста, знайдемо iнтервал зміни забарвлення iндикатора:
 . (6.14)
. (6.14)
Для встановлення кiнцевої точки в методах окисно вiдновного титрування застосовують рiзнi методи, найпростiшим з яких є спосiб розрахунку потенцiалу системи в точцi еквiвалентностi та пiдбiр такого iндикатора, щоб
т.е. o(Indок/Indвідн). (6.15)
Бiльш надiйно iндикатор може бути вибраний шляхом розрахунку та побудови кривих окисно-вiдновного титрування, визначення стрибка титрування та розміщення в його межах iнтервалу переходу iндикатора.
Криві окисно-відновного титрування
В кожен момент титрування пiсля доливання деякої порцiї титранту швидко встановлюється рiвновага i концентрацiї вихiдних речовин та продуктiв реакцiї стають рiвноважними. Їх можна обчислити, виходячи з початкових концентрацiй вихiдних реагентiв та константи рiвноваги.
Кривi титрування для окисно-вiдновних реакцiй можуть бути побудованi в координатах потенцiал – об'єм титранта. Потенціал системи можна обчислювати за величиною окисно-вiдновного потенцiалу будь-якої редокс-пари (визначуваної речовини або титранта). Але до точки еквiвалентностi розрахунок величини потенцiалу зручнiше вести за напiвреакцiєю з участю визначуваної речовини, а пiсля точки еквiвалентностi – за напiвреакцiєю з участю титранту.
Розглянемо побудову кривої титрування на прикладi визначення Fe2+ в кислому середовищi бiхроматометричним методом. Нехай маємо 100 мл 0,1 М розчину FeSO4, який будемо титрувати розчином бiхромату калiю з концентрацiєю C(1/6K2Cr2O7) = 0,1 М. З вiдповiдних пiвреакцiй
Fe2+ – e– Fe3+ 6
Cr2O72– + 14H+ + 6e– 2Cr3+ + 7H2O 1
________________________________________
6Fe2+ + Cr2O72– + 14H+ 6Fe3+ + 2Cr3+ + 7H2O. (XIV)
та стандартних потенцiалів редокс-пар
o(Cr2O72–/2Cr3+) = 1.33 > 0.77 = o(Fe3+/Fe2+)
можна стверджувати, що пара Cr2O72–/2Cr3+ є окисником по вiдношенню до пари Fe3+/Fe2+.
Обчислимо константу рiвноваги для цiєї реакцiї:
 ,
,
KC = 1056.95 = 8.8951056.
Так як KC = 8.8951056 103, то рiвновага реакцiї зсунута вправо. Це означає, що кiлькiсть моль-еквівалентів утвореного Fe3+ на дiлянцi до точки еквiвалентностi буде практично рiвна кiлькостi моль-еквiвалентiв доданого K2Cr2O7.
На дiлянцi до точки еквiвалентностi величину потенцiалу можна обчислити за рiвнянням Нернста для редокс-пари Fe3+/Fe2+:
 . (6.16)
. (6.16)
При доливаннi 50 мл розчину K2Cr2O7 розчин Fe2+ буде вiдтитрований на 50 %, тобто концентрацiя Fe3+ стане пропорцiйною об'єму долитого титранту, а концентрацiя Fe2+ пропорцiйною об'єму невiдтитрованого розчину двохвалентного феруму:
(Fe3+/Fe2+) = 0.77 + 0.059lg(50/50) = 0.77 B.
Аналогiчно обчислюємо потенцiал системи для iнших об'ємiв долитого титранту:
90 мл титранту: (Fe3+/Fe2+) = 0.77 + 0.059lg (90/10) = 0.821 B;
99 мл титранту: (Fe3+/Fe2+) = 0.77 + 0.059lg (99/1) = 0.888 B;
99.9 мл титранту: (Fe3+/Fe2+) = 0.77 + 0.059lg (99.9/0.1)= 0.947 B.
В точцi еквiвалентностi концентрацiї Fe2+, як i Cr2O72–, будуть дуже малими i їх можна розрахувати користуючись константою рiвноваги:
 . (6.17)
. (6.17)
Позначимо рiвноважну концентрацiю Cr2O72– в точцi еквiвалентностi [Cr2O72–]=x, тодi [Fe2+]=6x i концентрацiї iнших учасникiв реакцiї складуть: [Fe3+]=0.1–6x; [Cr3+]=0.2–2x; [H+]=1 моль/л Пiдставляючи наведенi величини концентрацiй в рiвняння (6.17), одержимо:
 , (6.18)
, (6.18)
Звідки можна обчислити x. Знайдемо спочатку наближене значення x за умови, що [Fe3+]0.1 та [Cr3+]0.2 моль/л: x = 1.38210–10.
У точцi еквiвалентностi:
 (6.19)
(6.19)
т.е. = (0.77 + 61.33 – 0.022)/7 = 1.247 В, (6.20)
Пiсля точки еквiвалентностi в розчинi зростає надлишок K2Cr2O7 при практично незмiннiй концентрацiї Cr3+, тому величину потенцiалу системи зручно обчислювати за формулою:
(Cr2O72–/2Cr3+) = o (Cr2O72–/2Cr3+) + (0.059/6)lg([Cr2O72–]/[Cr3+]2). (6.21)
Для надлишку титранта в 0.1 мл концентрацiя Cr2O72– буде складати
[Cr2O72–] = (0.10.1)/100 = 0.0001 M; [Cr3+] = 0.2 M.
Вiдповiдно, для 100.1 мл титранту
(Cr2O72–/2Cr3+)=1.33 +(0.059/6)lg(0.0001/0.22) = 1.304 B
Аналогiчно для всiх iнших надлишкiв титранта:
101 мл титранту [Cr2O72–] = 0.11/100 = 0.001 M; (Cr2O72–/2Cr3+) = 1.314 B;
110 мл титранту [Cr2O72–] = 0.110/100 = 0.01 M; (Cr2O72–/2Cr3+) = 1.324 B;
150 мл титранту [Cr2O72–] = 0.150/100 = 0.05 M; (Cr2O72–/2Cr3+) = 1.331 B.
Таблиця 6.1
Розрахунок потенціалів при титрування розчину феруму концентрацією С(FeSO4) =0,1 М розчином титранту концентрацією С(1/6 K2Cr2O7)=0,1 М
|
V(K2Cr2O7), см3 |
Надлишок, см3 |
Обчислення |
Е, В | |||
|
FeSO4 |
K2Cr2O7 | |||||
|
50 |
50 |
- |
|
0,77 | ||
|
90 |
90 |
- |
|
0,821 | ||
|
99 |
99 |
- |
|
0,888 | ||
|
99,9 |
99,9 |
- |
|
0,947 | ||
|
100 (т.е.) |
- |
- |
|
1,247 | ||
|
100,1 |
- |
0,1 |
|
1,304 | ||
|
101 |
- |
1 |
|
1,314 | ||
|
110 |
- |
10 |
|
1,324 | ||
|
150 |
- |
50 |
|
1,331 | ||
За розрахованими даними будуємо криву титрування (рис. 6.3) в координатах вiд V титранту, яка за формою нагадує криву титрування кислоти основою.

Рис. 6.3. Крива титрування розчину FeSO4 розчином K2Cr2O7.
На графiку можна зобразити лiнiю еквiвалентностi та видiлити рiзке зростання потенцiалу біля точки еквiвалентностi вiд 99.9 до 100.1 мл титранту (стрибок потенціалу):
Δ = 1.304 – 0.947 = 0.357 B.
Величина стрибка залежить вiд природи реагуючих речовин. На величину стрибка титрування можуть впливати кислотність розчину, протікання побічних реакцiй комплексоутворення, осадження, гідролiзу. Знаючи межi стрибка титрування, можна вибрати вiдповiдний iндикатор, iнтервал переходу якого повинен лежати в межах стрибка титрування.