
- •1 Електричне поле
- •1.1 Короткі відомості про будову|споруду| матерії
- •Елементарні частинки|частки| і їх електромагнітне поле – особливий вид матерії
- •Хімічні зв'язки в молекулах і кристалах
- •Зонна діаграма твердого тіла
- •1.2 Закон кулона. Напруженість електричного поля
- •1.3 Робота при переміщенні заряджених частинок в електричному полі
- •1.4 Провідники в електричному полі
- •1.5 Електричний струм|тік| в провідниках
- •1.6 Розрахунок електричних ланцюгів|цепів| постійного струму|току| Схеми эаміщення електричних ланцюгів
- •1.7 Закони кірхгофа
- •Перший закон Кірхгофа
- •Другий закон Кірхгофа
- •1.8 Метод контурних струмів |токів|
- •2 Магнітне поле та магнітні ланцюги|цепи|
- •2.1 Робота при переміщенні проводу із|із| струмом|током| у|проводу| магнітному полі. Магнітний потік і потокозчеплення
- •2.2 Індуктивність і взаїмоіндуктивність
- •2.3 Обчислення індуктивності
- •Індуктивність котушки|катушки|
- •2.4 Магнітні властивості речовини. Закон повного|цілковитого| струму|току|
- •3 Електричні ланцюги постійного току
- •3.1 Структура електричних ланцюгів
- •3.2 Одноконтурні лінійні електричні ланцюги
- •3.3 Багатоконтурні лінійні електричні ланцюги
- •Контрольні запитання
- •4 Електричні ланцюги змінного струму
- •4.1 Генерування синусоїдальних електричних величин
- •4.2 Прості лінійні електричні ланцюги синусоїдального струму
- •Контрольні запитання
- •5 Асинхронні машини
- •5.1 Призначення і будова асинхронних машин
- •5.2 Робота трифазної асинхронної машини у режимі двигуна
- •5.3 Асинхронні виконавчі двигуни і тахогенератори
- •6 Синхронні машини
- •6.1 Призначення і будова синхронних машин
- •6.2 Робота трифазної синхронної машини у режимі генератора
- •6.3 Призначення і будова машин постійного струму
- •Контрольні запитання
- •7 Основи електроніки
- •7.1 Електричний струм у напівпровідниках.
- •7.1.1 Класифікація речовин за провідністю
- •Отже, швидкість рекомбінацій
- •7.1.2 Струми власних напівпровідників
- •Густина повного струму дрейфу у власному напівпровідникові
- •7.2 Домішкові напівпровідники
- •7.3 Дифузія носивїв заряду у напівпровідниках
- •7.4 Визначення та класифікація електричних переходів
- •7.4.1 Електронно-дірковий перехід без зовнішнього електричного поля
- •7.4.2 Електронно-дірковий перехід із зовнішнім джерелом напруги
- •7.5 Вольт-амперна характеристика ідеалізованого р-п-переходу
- •7.6 Ємнісні властивості p-n-переходу
- •7.7 Пробій р-п-переходу
- •7.8 Перехід метал – напівпровідник
- •8 Генератори синусоїдальних коливань
- •8.1. Підсилювачі безперервних сигналів
- •8.1.1 Принцип роботи підсилювача безперервних сигналів на лампі
- •8.2 Типова принципова схема підсилювача безперервних сигналів на тріоді
- •8.3 Вибір робочої точки і способи створення напруги автоматичного зсуву
- •8.4 Фізичні процеси в підсилювачі при підсиленні імпульсних сигналів
- •8.5 Типова схема підсилювача імпульсних сигналів на пентоді
- •8.6 Підсилювачі зі зворотним зв'язком
- •8.6.2 Вплив зворотного зв'язку на характеристики підсилювача
- •9 Транзистори
- •9.1 Визначення транзистора
- •9.2 Напівпровідникові підсилювачі
- •10 Cпрямляючі пристрої
- •11 Мікроелектроніка та цифрова техніка
- •11.1 Основні терміни і визначення в мікроелектроніці
- •11.2. Особливості інтегральних схем як нового типу напівпровідникових приладів
- •11.3 Класифікація інтегральних мікросхем
- •11.4 Система умовних позначень інтегральних мікросхем
- •11.5 Загальна характеристика цифрових інтегральних мікросхем
- •11.5.1 Елементарні логічні операції
- •11.5.2 Характеристики і параметри цифрових інтегральних схем
- •11.5.3 Класифікація цифрових інтегральних схем
- •11.6 Тригери
- •Основи електроніки, автоматики та
- •Основи електроніки, автоматики та цифрової техніки
- •65016, Одеса, вул.Львівська, 15
Хімічні зв'язки в молекулах і кристалах
Зовнішні електрони |строю| беруть участь в утворенні хімічних зв'язків тобто атом може віддати електрони із|із| свого зовнішнього шару, стаючи позитивним іоном, або навпаки, приєднати електрони до зовнішнього шару, стаючи негативним|заперечним| іоном. Такі електрони називаються валентними.
Встановлено|установлений|, якщо в зовнішньому шарі атома менше чотирьох електронів, він легко віддає свої електрони. Таку властивість мають, наприклад, атоми металів, і серед них виділяються лужні метали, що мають по одному електрону в зовнішній оболонці. Якщо в зовнішньому шарі атома більше чотирьох електронів, то такі атоми можуть приєднувати до себе електрони, доповнюючи цей шар до восьми електронів|. Ця властивість особливо сильно виражена|виказувати| у|біля| елементів, атоми яких мають |із| сім електронів на зовнішньому шарі (галоїди|).
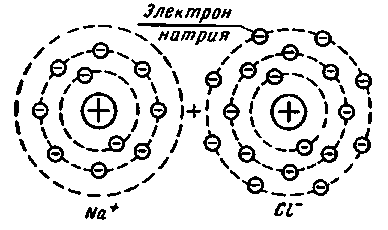
Рис.1.2 - Схема іонного зв'язку атомів в молекулі хлористого натрію|соль|
Атоми які мають вісім електронів на зовнішньому шарі, є|з'являються| хімічно стійкими, тобто не віддають і не приєднують електронів. Така будова|споруда| атомів характерна|вдача| для інертних газів.
На рис 1.2 наведена схема утворення молекули хлористого натрію. Атом натрію, що має всього 11 електронів, а в зовнішньому шарі - один електрон (натрій – одновалентний), віддає його з|із| третього шару, стаючи позитивним іоном з|із| числом електронів в зовнішньому шарі рівним восьми.
Атом хлора має всього 17 електронів, зокрема сім в зовнішньому шарі, приймає один електрон, стаючи негативним|заперечним| іоном з|із| числом електронів| в зовнішньому шарі рівним восьми. Два іони Na+ і Cl - зв'язано в нейтральну молекулу силами електростатичного тяжіння. Проте|однак| обидва іони мають відособлені електронні оболонки. Такий зв'язок атомів в молекулі називається іонним.
У молекулах і кристалах, що складаються з однакових або близьких по хімічних властивостях атомів, кожен валентний електрон взаємодіє з|із| двома сусідніми атомами. Інакше кажучи, два сусідні атоми мають пару електронів (поодинці від кожного атома), які відносяться до обох атомів.
Розглянемо|розглядуватимемо| для прикладу|зразка| элемент ІV групи періодичної системи Д.І.Менделєєва - германій. Цей хімічний елемент чотиривалентний, оскільки|тому що| має чотири електрони на зовнішній оболонці атома. У кристалі кожен атом через свої валентні електрони пов'язаний з чотирма сусідніми атомами.
Парноелектронні зв'язки атомів в кристалі можна представити умовною схемою, зображеною на рис. 1.3, де кругами|колами| із знаком «мінус» позначені валентні електрони, і із знаком «плюс» - позитивні іони. Подвійні лінії указують зв'язки електронів з іонами. Пари електронів, через які зв'язані атоми, в рівній мірі відносяться до обох атомів. Такий зв'язок атомів в молекулі і кристалі називається ковалентним.

Хімічний зв'язок атомів може бути проміжним між іонною і ковалентним : пара електронів виявляється зміщеною ближче до одного атома, а саме до атома того елементу, у которго прагнення приєднувати електрони виражене сильніше. У таких випадках хімічний зв'язок називається полярним.
Електронна теорія будови|споруди| металів
Уявлення про електронну структуру атомів послужило підставою|основою| для класичної теорії будови|споруди| металів. У цій теорії враховується, що валентні електрони зовнішнього шару відокремленого атома слабо пов'язані з ядром. При утворенні кристалів на електрони кожного атома діють ядра інших атомів. У цих умовах деякі валентні електрони втрачають постійний зв'язок з|із| одним ядром і переходять від одного атома до іншого. Такі електрони називають звідними|зведеними|. Атоми, що втратили|згубили| електрони з|із| валентного шару, стають позитивними іонами. Вони розташовуються у вузлах кристалічної решітки і здійснюють|скоюють| теплові коливання біля положення|становища| рівноваги. Загальний|спільний| заряд вільних електронів в кристалі дорівнює позитивному заряду іонів, тому кристал залишається електрично нейтральним.
Вільні електрони теж|також| беруть участь в хаотичному тепловому русі, але|та| переміщаються по всьому кристалу, утворюючи своєрідний електронний газ. Передбачається|припускається|, що вільні електрони володіють властивостями молекул ідеального газу; вони не взаємодіють на відстані між собою і з|із| іншими частинками|частками| металу, але|та| при своєму русі можуть стикатися з|із| іонами кристалічної решітки. Електронна теорія будови|споруди| металів була розроблена у зв'язку із загальною|спільною| проблемою електропровідності речовин. Висока електропровідність і деякі і інші властивості металів отримали|одержували| добре|добре| пояснення при введенні|вступі| поняття про вільні електрони . Електронна теорія пояснює|тлумачить| погану електропровідність у|біля| ряду|лави| речовин відсутністю вільних електронів. Такі речовини отримали|одержували| назву діелектриків.
Проте|однак| далеко не всі електричні властивості твердих тіл, у тому числі і металів, можна пояснити|тлумачити| за допомогою електронної теорії. Застосування|вживання| її у ряді випадків привело до суперечностей|протиріч| з|із| досвідченими|дослідними| даними.
