
- •Министерство здравохранения рф
- •Лекция 1: пропедевтика гинекологических заболеваний
- •Тесты функциональной диагностики при овуляторном цикле
- •Лекция 2: проблемы контрацепции
- •За последние годы рынок кок пополнился комбинированными монофазными инъекционнымипрепаратами (Mesigyna), однако, длительный опыт их применения отсутствует.
- •Гормональные препараты, используемые в гинекологической практике
- •Внутриматочная контрацепция
- •Посткоитальная контрацепция
- •Лекция 3: бесплодный брак.
- •Лекция 4: эндоскопическая хирургия в гинекологии история использования эндоскопических методов в гинекологии
- •Общие принципы оперативной лапароскопии
- •Операции умеренной степени сложности
- •Операции высокой степени сложности
- •Операции высочайшей степени сложности
- •Лекция 5: опухоли яичников
- •Патогенез
- •Клиника
- •Перекрут ножки опухоли яичника
- •Диагностика
- •Классификация, характеристика оя
- •Лекция 6: предрак и рак шейки матки
- •Лекция 7: предрак и рак эндометрия
- •Лекция 8: доброкачественные заболевания молочных желез
- •Лекция 9: климактерический синдром и заместительная гормональная терапия
- •Препараты для заместительной гормонотерапии в перименопаузе
- •Лекция 10: современные аспекты патогенеза и лечения генитального эндометриоза
Лекция 6: предрак и рак шейки матки
Традиционно рак шейки матки (РШМ) рассматривается как одна из самых частых и фатальных локализаций злокачественных поражений женского репродуктивного тракта. Однако если читатель обратится к учебникам и монографиям начала века, то под термином рак матки, как правило, описывается РШМ, тогда как в настоящее время – рак эндометрия (РЭ). Чем же обусловлено подобное изменение стилистики? Следует обратиться к показателям заболеваемости в течение нескольких десятилетий. В начале текущего столетия, соотношение заболеваемости РШМ/РЭ приблизительно равнялось 5-6:1, в 70-е годы – 3:1, в настоящее время 1,5-2:1. Таким образом, создается впечатление, что общая заболеваемость уменьшилась. Следует ли в связи с этим уделять меньше внимания РШМ? Другими словами, что кроется за этими цифрами и как их правильно интерпретировать? Во-первых, за последние десятилетия резко возросла заболеваемость РЭ, во-вторых, заболеваемость РШМ снизилась только в репродуктивном возрасте, в постменопаузе снижение значительно меньше, в-третьих, именно у молодых выросли показатели выявляемости РШМ в стадиях 0-1а, что диктует необходимость жестко детерминированной правильной тактики, знакомой каждому врачу.
Этиология.Этиологическими факторами возникновения и развития эпителиальных дисплазий являются раннее начало половой жизни, наличие большого числа половых партнеров, роды в очень молодом возрасте.
За последние 20-30 лет в литературе сложилась концепция о роли вирусов в этиологии РШМ. В классической работе Fraumeni(1969) сообщается об отсутствии РШМ у католических монахинь, однако, отмечена высокая частота РМЖ, РЭ и РЯ.
Sebastianetal. (1978) обследовали 750 проституток и лишь у 0,93% смогли выявить дисплазию, тогда как частота инфекций, передаваемых половым путем (STD) была высокая.
В дальнейшем, примитивная точка зрения о преобладании РШМ в немусульманских странах, где отсутствует обряд циркумцизии была сильно поколеблена.
В качестве инфекционных агентов, связанных с РШМ, в последнее время все больше указывают на вирус папилломы человека (HPV). Так, по данным разных авторов, его можно обнаружить у 50-70% больных (Bjersing et. al.,1991;Kinoshitaetal.1990;Vousdenetal.,1990). Полагают, что у здоровых, HPV можно обнаружить в 6% наблюдений, при дисплазии – у 18%,а при малигнизации – у 37% и более (Donnanet.al.).Stoleret.al. указывали, что выявляемость составляет 47-99% при патологии шейки матки. Большое число наблюдений, высокая частота сочетания HPV и РШМ довольно убедительны. ДНК HPV выявляется практически у всех больных с предраком и раком шейки матки, в связи с чем Международное агентство по исследованию рака (МОИР) официально объявило вирус папилломы человека 16 и 18 типов канцерогенными факторами, а типы 31,33 и 35 – возможными канцерогенами.
Значительную роль в процессе канцерогенеза шейки матки играет курение табака. По данным разных авторов, канцерогенные ингридиенты табака обнаруживаются в повышенных концентрациях в содержимом влагалища, под действием этих веществ уменьшается число клеток Лангерганса, являющихся неотъемлемой частью Т-лимфоцитарного клеточно-опосредованного иммунитета.
Особая роль среди кофакторов цервикального канцерогенеза отводится нарушениям в иммунной системе. Это подтверждается высокой частотой ПВИ у больных с иммунодефицитом, а также фактом выраженной инфильтрации лимфоцитами и макрофагами папиллом в случае их спонтанной регрессии. Транзиторная иммуносупрессия, сопровождающая беременность. Обусловливает возрастание частоты генитальных кондилом. Степень распространения ВПЧ выше среди ВИЧ-инфицированных больных, причем течение папилломатоза у них более тяжелое, а риск РШМ выше.
Однако, достаточно большой разброс показателей, отсутствие корреляции со стадией заболевания, позволяют предполагать скорее мультифакториальную природу РШМ, чем инфекционную.
Таким образом, наиболее ранняя концепция этиопатогенеза РШМ как инфекционного заболевания выходит на первое место. И хотя ушли в прошлое трихомонады, гонококки, вирус герпеса, как возможные инициирующие агенты, высокая частота при РШМ является научно обоснованной и статистически достоверной. Инициация вирусом процесса онкогенеза в настоящее время объясняется модифицированной и усовершенствованной вирусогенетической теорией, основоположником которой является В.П. Зильбер. Если в силу тех или иных причин вирусу удалось инфицировать клетку и встроить свою нуклеотидную наследственность в генетический аппарат клетки, то при определенных условиях экспрессия этого участка может привести к инициации процесса озлокачествления (Сейц И.Ф., Князев П.Г.,1986).
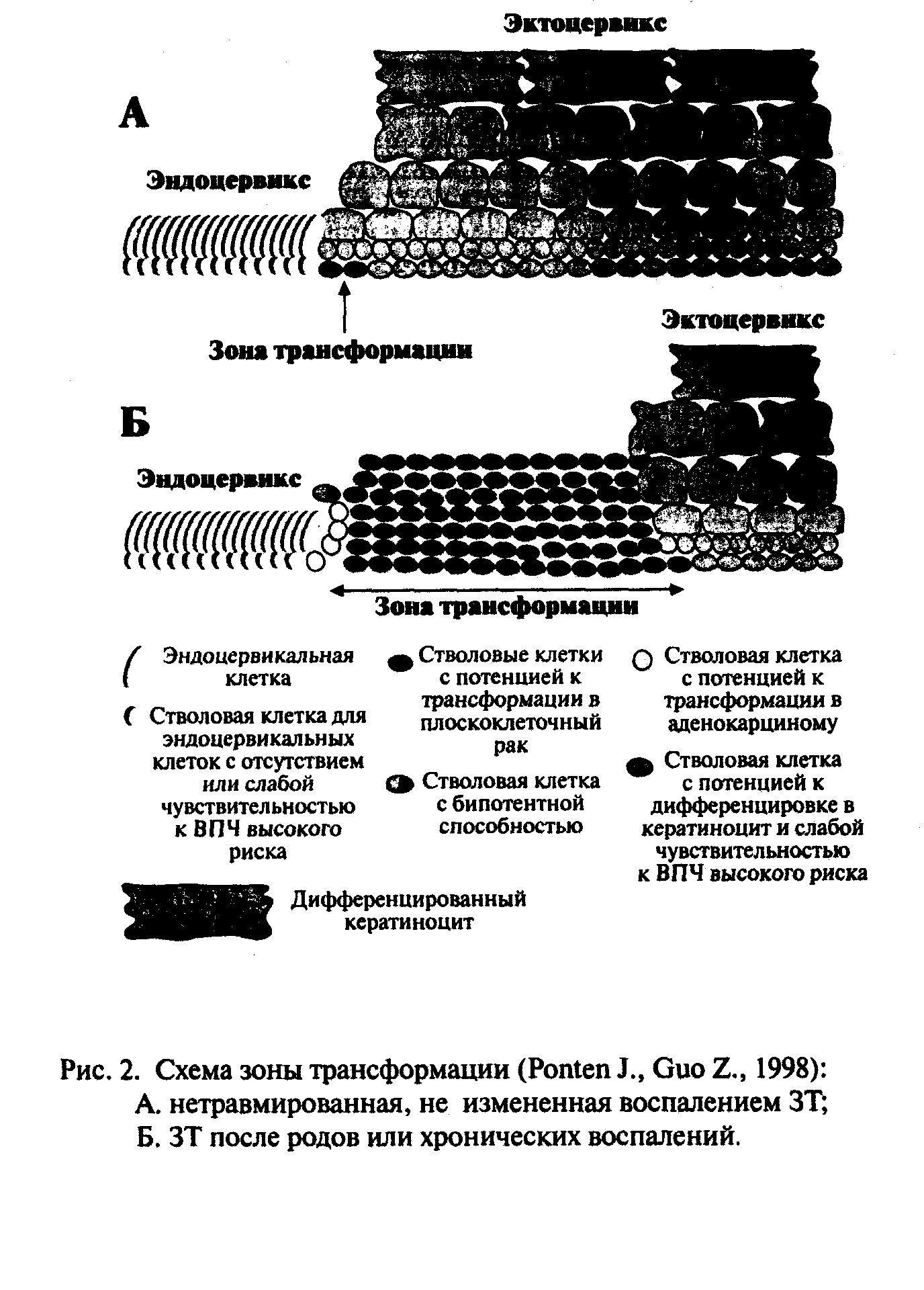
Патоморфология РШМ. Коротко напомним, что основным участком шейки, где чаще всего обнаруживается зона перехода многослойного плоского эпителия в цилиндрический (т.е. зона трансформации, «зона бурь»). Важно помнить также, что в цилиндрическом эпителии имеются клетки, называемые резервными, которые обладают биопотентными свойствами, т.е. могут дифференцироваться как в плоский, так и в цилиндрический. Нарушение процесса метаплазии является важным этапом развития патологии шейки. Вторым важным моментом является динамическое изменение локализации границы зоны трансформации в зависимости от возраста: чем старше женщина, тем выше эта граница смещена в цервикальный канал. Следовательно, у пациенток в периоде постменопаузы РШМ будет чаще локализоваться в цервикальном канале, что требует определенной тактики обследования, отличной от пациенток репродуктивного возраста. У молодых женщин, особенно до 20-23 лет, смещение цилиндрического эпителия кнаружи является возрастной нормой, не требует специального лечения при отсутствии активной метаплазии. Изменение гормонального фона (взросление, монофазная контрацепция) способствует смещению переходной зоны в цервикальный канал.
Многослойный плоский эпителий 150-200 мкм и делится на три зоны: 1) базальный слой, ответственный за воспроизводство эпителия; 2) промежуточный слой, содержащий парабазальные клетки, которые могут проявлять митотическую активность, особенно при высоком уровне эстрогенов в крови; 3) поверхностный слой, содержащий наиболее зрелую клеточную популяцию.

Факторы риска. Перед рассмотрением основных клинических разделов и диагностического алгоритма следует на основании изложенного систематизировать факторы риска РШМ. По-видимому, традиционно следует учитывать фактор наследственности. Кофакторами, важными для развития заболевания, могут быть нарушения в клеточно-опосредованном и гуморальном иммунитете, трансмиссивные заболевания, социально-экономический статус, репродуктивный и контрацептивный анамнез, характеристики партнеров, курение и др.. Риск ВПЧ инфекции значительно связан с испанской этнической принадлежностью и черной расой, что обусловлено генетической предрасположенностью этих женщин к восприимчивости и персистенции ПВИ, возможно зависящей от различий в человеческом лейкоцитарном антигене (HLA) классовIиII, связанных с иммунореактивностью.
S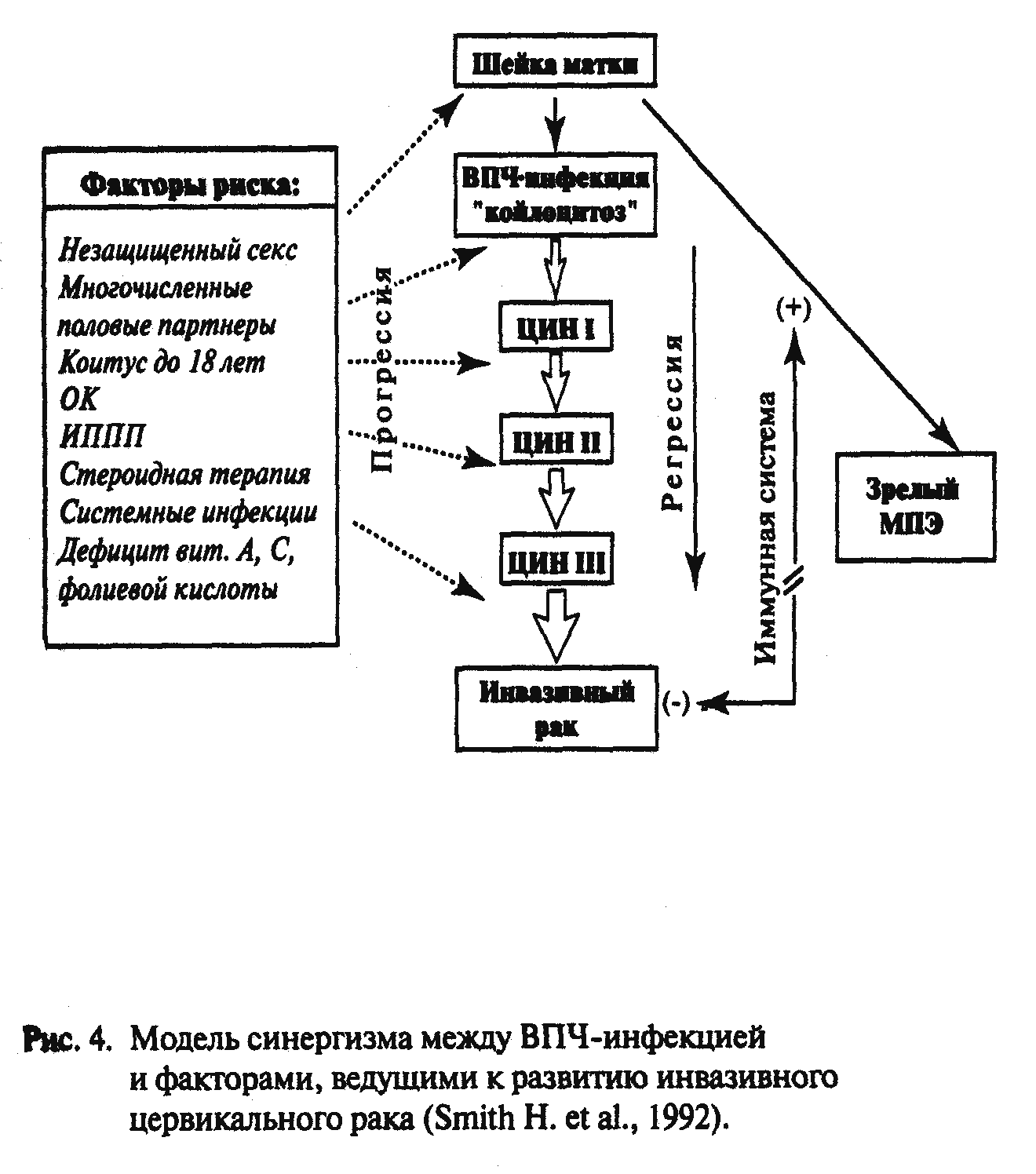 tunimirovic
et al.,(1990), Barten et al. (1990) подчеркивают,
что раннее начало половой жизни в 3 раза
повышают риск РШМ, смена партнеров в 6
раз, промискуитет партнера также
оценивается как важный фактор. По мнениюJonsonet.al.(1990), риск возрастает
при наличии более 5 партнеров. Все авторы
особое внимание уделяют половой гигиене.
Например,Velascoet.al., (1990) показали. Что среди
больных РШМ высокий социально-экономический
уровень имеют 5%, низкий - 71,79%. По даннымGreengerget.al.(1989), за период 1975-1986 гг.
заболеваемость РШМ снизилась с 51,4 до
25,6 на 100 000, в популяции афроамериканцев
изменений заболеваемости нет.
tunimirovic
et al.,(1990), Barten et al. (1990) подчеркивают,
что раннее начало половой жизни в 3 раза
повышают риск РШМ, смена партнеров в 6
раз, промискуитет партнера также
оценивается как важный фактор. По мнениюJonsonet.al.(1990), риск возрастает
при наличии более 5 партнеров. Все авторы
особое внимание уделяют половой гигиене.
Например,Velascoet.al., (1990) показали. Что среди
больных РШМ высокий социально-экономический
уровень имеют 5%, низкий - 71,79%. По даннымGreengerget.al.(1989), за период 1975-1986 гг.
заболеваемость РШМ снизилась с 51,4 до
25,6 на 100 000, в популяции афроамериканцев
изменений заболеваемости нет.
Диагностика. РШМ является одним из немногих злокачественных заболеваний, для которых, несмотря на спорные аспекты патогенеза, можно выработать четкую схему выявления предраковых состояний и начальных форм рака. Первым краеугольным камнем этого постулата является необходимость обязательного осмотра шейки матки с помощью зеркал до двуручного исследования (И.Ф. Жордания,1995). Этот простой метод позволяет, однако, диагностировать только довольно грубую патологию. Нельзя также переоценивать данные ректовагинального исследования для оценки состояния параметриев.
В конце 30-х - начале 40-х Papanicolauизучил клеточный состав плоского эпителия шейки в норме и патологии. Разработанные им концепции легли в основу концепции цитологических признаков патологии шейки матки. В течение последних десятилетий, особенно в методической литературе, постулируется необходимость ежегодного цитологического скрининга всех женщин старше 20 лет. Однако в научной литературе мнения не так однозначны. Одни авторы (Diedold et. al.,1990; Polli et. al.,1990; Василевская Л.Н.,1987) безоговорочно поддерживают необходимость цитологического скрининга. Подчеркивается, правда, довольно низкая (60-70%) чувствительность метода. В итоге назрела необходимость пересмотра самого принципа цитологического скрининга РШМ. В 1988 г. в Бетезде (США) была принята новая, правда, крайне усложненная цитологическая система скринига РШМ (Koss,1990). Основными ее критериями являются консультативный характер работы цитолога и ответственность гинеколога за качество материала. То есть, заказывая консультацию цитолога, гинеколог несет ответственность за чувствительность, но не за специфичность метода.
Кольпоскопия является одним из важных методов обследования больных с патологией шейки матки. Цель кольпоскопического исследования заключается в оценке состояния слизистой оболочки влагалища с выявлением очагов поражения и осуществлении прицельной биопсии, что существенно повышает информативность исследования.
Кольпоскопия, выполненная одномоментно с цитологией, позволяет почти полностью исключить ложно-отрицательные цитологические результаты. Кольпоскопия полезна как в скрининге предраковых заболеваний шейки матки, так и для выявления цитологически ложно-отрицательных результатов. Кольпоскопия в настоящее время в руках грамотного врача является не диагностическим методом, а исследованием, позволяющим оценить распространенность поражений, выявить их локализацию, прицельно взять материал для цитологического или гистологического исследования.
Кольпоскопическими критериями атипического эпителия являются беловатые участки слизистой, выявляемые после аппликации уксусной кислотой, лейкоплакия и йод-негативные участки, не реагирующие на тест с уксусной кислотой, поскольку их эпителий не содержит гликогена.
Исследованиями, проведенными на нашей кафедре, обнаружена четкая зависимость между степенью выраженности кольпоскопических признаков атипии и тяжестью морфологических изменений в эпителии шейки матки. Чем более высокоатипичным визуализируется эпителий, тем чаще он связан с зоной превращений.
Неопытный наблюдатель может спутать незрелую сквамозную метаплазию и цервикальную интраэпителиальную неоплазию. В отличие от неопластического эпителия в метаплазированном плоском клеточная организация и связи сохраняются, ядерная атипия отсутствует, и обычно один ряд эндоцервикальных клеток покрывает плоские клетки.
Согласно многоступенчатой клональной теории рака, необходимо, чтобы одна целевая клетка (обычно стволовая клетка) перенесла множество мутаций, после которых она же трансформируется, возможно, через промежуточные предраковые стадии, чтобы начать клональную экспрессию как злокачественная неоплазия.
Таблица 1.
МЕЖДУНАРОДНАЯ КОЛЬПОСКОПИЧЕСКАЯ ТЕРМИНОЛОГИЯ (1991)
I.Нормальные кольпоскопические признаки
А. Оригинальный сквамозный эпителий
Б. Цилиндрический эпителий
В. Нормальная зона трансформации.
II.Аномальные кольпоскопические признаки
А. В пределах зоны трансформации
Уксусно-белый эпителий*
а.плоский
б.микропапиллярный или микроизвилистый
Пунктация (пятнистость)*
Мозаика*
Лейкоплакия*
Атипичные сосуды
Б. Вне зоны трасформации (эктоцервикс, влагалище)
Уксусно-белый эпителий
а плоский
б микропапиллярный или микроизвилистый
Пунктация (пятнистость)*
Мозаика*
Лекоплакия*
Йод-негативный эпителий
Атипичные сосуды
III.Подозрение на инвазивный рак при кольпоскопии
IV.Неудовлетворительная кольпоскопия
А.Стык эпителиев не визуализируется
Б. Выраженное воспаление или атрофия
В. Шейки матки не визуализируется
V.Смешанные признаки
А. Небелая микропапиллярная поверхность
Б. Экзофитная кондилома
В. Воспаление
Г. Атрофия
Д. Язва
Е. Другие
*Признаки с большими и малыми изменениями
Малые изменения:Большие изменения:
Беловатый эпителий Плотный белый эпителий
Нежная пунктация Грубая пунктация
Нежная мозаика Грубая мозаика
Тонкая лейкоплакия Толстая лейкоплакия
Предложено неподдающееся учету количество усовершенствований кольпоскопий. Jonsonet.al.(1990) предложили использовать ламицель для улучшения осмотра цервикального канала. Бурно развивается микрокольпогистероскопия. Однако, по нашему мнению, студенту и молодому врачу следует ограничиться хорошо изученными простыми методиками и твердо их усвоить, а тонкие методы диагностики оставить специалистам.
Цервикоскопия – осмотр цервикального канала, производимый либо во время гистероскопии, либо самостоятельно. Особенно важна у пациенток в постменопаузе, т.к. зона перехода смещена в цервикальный канал. По данным Е.Г.Новиковой и С.Е.Сорокиной (1991), цервикоскопия – единственный метод выявления рака цервикального канала у 24,2% пациенток.
У больных с твердоустановленным диагнозом РШМ широко применяются такие методы исследования как ядерно-магнитный резонанс (ЯМР), компьютерная томография (КТ), лимфография и пр. Их подробное описание можно найти в специальных руководствах.
Морфологические методы исследования. Внимательное изучение раздела, посвященного кольпоскопии, должно навести читателя на мысль о крайне узком спектре показаний к собственно ножевой биопсии. В 50-60-е годы этап множественных биопсий, как и любых прочих других, был пройден. Из описания кольпоскопических картин ясно, что если врач делает биопсию, то либо он не умеет “читать” кольпоскопию, либо он вообще не владеет методом, а ответственность за диагноз старается переложить на плечи гистологов. Чем же опасна биопсия?Barciet.al.(1990),Reyneset.al.(1990) и многие другие авторы отмечают резкое прогрессирование РШМ после биопсии. Напомним, что большинство раков в стадии 0 компенсированы или субкомпенсированы, поэтому любое разрушение подлежащих структур ведет к прогрессированию рака, т.к. нарушается целостность базальной мембраны и лимфогистиоцитарного барьера. Коротко коснемся морфологии стадий РШМ.
Предрак-дисплазия - усиленная пролиферация базального, парабазального и промежуточных слоев с явлениями клеток, нарушением слоистости, но без вовлечения поверхностного слоя эпителия ( Василевская Л.Н., 1987; Бохман Я.В.,1989).
Рак 0 (Cis,cancerinsitu) – все выше перечисленное и поражение поверхностного слоя, но без инфильтрации базальной мембраны. Понятно, что патоморфологический диагноз в этих случаях достаточно тонок, но также и понятно, что полное удаление очага приведет к полному излечению. Следует, видимо, согласиться с одним из российских онкологов: “лучше маленькая, но конизация, чем большая, но биопсия”. Учитывая общность патоморфологии и лечения больных с дисплазией и раком 0,Richart(1968) предложил объединить эти заболевания термином “цервикальная интраэпителиальная неоплазия”(ЦИН). При этом ЦИН1 – слабая дисплазия, ЦИН2 – умеренная дисплазия, ЦИН3 – тяжелая дисплазия и преинвазивный рак.
Рак шейк матки 1а - инвазия до 3 мм в диаметре, опухоль не превышает 1,0 см., отсутствуют мультицентрические очаги роста и раковые эмболы в кровеносных и лимфатических сосудах.. Причем в настоящее время, с целью более точного планирования лечения, эту стадию подразделяют на 1а1 инвазия до 1 мм (Т1аN0M0) и 1а2 – инвазия 1-3 мм (Т1а2M0N0). Биологической платформой этой стадии является теория критического размера опухоли, согласно которой метастазирование начинается только после достижения ею определенного размера, в данной ситуации – 1,0 см.
Рак шейки матки 1б – инвазивный рак шейки матки.
Рак шейки матки 2а – рак инфильтрирует верхнюю треть вагины или тело матки (маточный вариант из классификации исключен) – Т2а.
Рак шейки матки 2В – инфильтрация параметриев, но не до стенок таза (определяется при ректальном исследовании).
Стадии 3А-В запомнить просто: А – нижняя треть вагины; В – параметрии до стенок таза. Доказано, что процесс инфильтрации параметриев связан с раковым поражением цепочки мелких параметральных лимфоузлов.
4 стадия – определяется поражение смежных органов или в отечественной классификации (М3,1985) отдаленными метастазами. В классификации TNMдля отдаленных метастазов есть специальная рубрика “M”.
Патогистологически РШМ может быть плоскоклеточным, железистым (аденокарцинома) и низкодифференцированным раком. Хотя дискуссии о прогностическом значении различных патогистологических вариантов продолжаются, большинство клиницистов считают, что наиболее агрессивны аденокарциномы ШМ и низкодифференцированные раки. Полагают также, что при прочих равных условиях прогностически менее благопрятны эндофитные опухоли, превышающие 1 см в диаметре. Эндофитные опухоли больших размеров деформируют шейку и у таких больных, шейка приобретает форму “свиного рыльца ”. При экзофитных – шейка образно называется – в виде “цветной капусты”.
Классификация. В настоящее время к собственно предраковым заболеваниям шейки матки относят по разным классификациям неинвазивные цервикальные атипические изменения эпителия: дисплазия иcarcinomainsitu(эти определения широко применяются в отечественной лечебной классификации). Цервикальная интраэпителиальная неоплазия (ЦИН) –cervicalintraepithelialneoplasia(CIN) – название принято на II Международном конгрессе по патологии шейки матки и кольпоскопии в 1975 году. Выделяют III степени тяжести ЦИН-I и II – легкая и умеренная дисплазия , III степень включает тяжелую дисплазию и преинвазивную карциному. ТерминCINшироко использовался в зарубежной терминологии. В 1988 году принята новая классификацияTheBethestdasystem(TBS) – где предраковые заболевания шейки матки именуются плоскоклеточными интраэпителиальными поражениями (ПИП-squamousintraepitheliallesions–SIL) – и обьединяющей ЦИНI, кондилому и койлоцитоз многослойного плоского эпителия в плоскоклеточные поражения низкой степени (Н-ПИП), а ЦИНII, ЦИНIII- поражения высокой степени (В-ПИП).
В качестве наглядной иллюстрации приводим таблицу (Минкина Г.Н. и соавт., 2001), сопоставляющую вышеприведенную терминологию.
|
Плоскоклеточные интраэпителиальные поражения (ПИП) | ||||
|
Низкая степень Н-ПИП |
Высокая степень В-ПИП | |||
|
Кондилома |
Цервикальная интраэпителиальная неоплазия (ЦИН) | |||
|
|
Iстепень |
II степень |
III степень | |
|
Очень слабая дисплазия |
Слабая дисплазия |
Умеренная дисплазия |
Выраженная дисплазия | |
Современные классификации диктуют необходимость рассматривать термин «дисплазия» как морфологическую характеристику происходящих патологических изменений в эпителии различного генеза и биологической потенции, микроскопически определяется интенсивная пролиферация клеток, появление в них атипии ядер, без вовлечения в процесс поверхностного слоя эпителия, в котором сохраняются зрелые ороговевающие клетки. В зависимости от интенсивности пролиферации и выраженности структурной и клеточной атипии ядер в эпителиальном пласте, а именно в нижней трети или в более поверхностных отделах различают легкую, умеренную и тяжелую дисплазии (Краснопольский В.И..,1997).
В последние годы признание центральной роли ВПЧ в патогенезе цервикального рака привело к мысли, что спектр ЦИН – это не единое заболевание, а существует две различные биологические сущности: одна - продуктивная ПВИ, а другая – предшественник рака. Эти заключения основывались на молекулярно-биологических исследованиях, которые совершенствовали понимание ПВИ, и на большом количестве клинических наблюдений за женщинами с предвестниками цервикального рака. Внедрились такие термины, как плоская кондилома, кондиломатозная атипия, койлоцитозная атипия – для обозначения плоских поражений шейки, которые гистологически похожи на типичную кондилому. Однако, дополнительные исследования показали, что распространение типов ВПЧ одинаково для плоской кондиломы и ЦИН I, и было сделано заключение о единой сущности Н-ПИП. Гистологические и цитологические признаки включают увеличенное гиперхромное ядро, многоядерность и цитоплазматическую кавитацию, которая дает клетке эффект пустоты. Характерный признак продуктивной вирусной инфекции привел к внедрению термина койлоцитозная атипия (koilos– греч..«пустота»). Единая классификация позволяет сравнивать результаты исследований во всем мире и «говорить на одном языке».
Инвазивный рак.При описании тактики ведения больных с инвазивным раком шейки матки мы постараемся подчеркнуть принципиальные установки, т.к. тонкости лечения требуют громадного клинического опыта и еще большего объема знаний.
Стадия 1б. Уже в стадии 1б у больных с экзофитными и эндофитными опухолями лечение предпочтительно начинать с сочетанной лучевой терапии (Remoteafterloading). В дальнейшем в стадиях 1б и 2а (Т1в и Т2а) проводится операция Вертгейма. Послеоперационное облучение показано при наличии глубокой инвазии опухоли и при гистологически подтвержденных метастазах в лимфатические узлы таза. В настоящее время убедительно показано, что первым этапом метастазирования для РШМ являются наружные и внутренние подвздошные, запирательные узлы. Лучевая терапия также возможна при поражении общих подвздошных лимфоузлов. При поражении парааортальных - дискутабельна, если не перспективна.
В стадиях Т2 и Т3 лечение только лучевое, иногда дополняемое только экстраперитонеальной лимфаденэктомией. Однако, существенные изменения в план лечения вносят индивидуальные характеристики заболевания у различных больных. Так, например, если общая 5-летняя выживаемость в 1-ой стадии 78-85%, то при сочетании РШМ с беременностью – 25-30%. В 3-ей стадии, вследствие инфильтрации параметриев часто возникает гидронефроз, также требующий коррекции лечения. Опасным и угрожающим осложнением является кровотечение из пораженной раком шейки матки. У таких больных при неэффективности консервативных методов (тампонада, гемостатические средства) приходится выполнять перевязку внутренней подвздошной артерий.
Следует также отметить, что, несмотря на хорошие результаты лечения РШМ, выжившие больные могут длительно страдать от осложнений хирургического (в основном урологические) и лучевого (проктосигмоидиты, стриктуры кишечника, фиброз мочевого пузыря, свищи пузыря и мочеточников, стеноз вагины) лечения.
Дискутабельным остается лечение поздних рецидивов и метастазов. В нашей стране предпочитают лучевое лечение. За рубежом имеются сторонники операции Бруншвига – тазовой экзентерации, заключающейся в операции Вертгейма ( если еще присутствует матка), экстирпации пузыря и прямой кишки с пересадкой мочеточников в тощую кишку (чаще) или выведением их на кожу (реже).
К сожалению, в этой краткой лекции нам не удалось подробно остановиться на многих важных проблемах. Операция Вертгейма дала импульс к развитию оперативной гинекологии вообще. Было бы интересно проследить баланс между операцией Вертгейма и Шауты-Амрейха (влагалищная радикальная гистерэктомия), между ними и лучевой терапией. Не удалось отразить дискуссию ценности лазерного, криохирургического и прочих видов лечения. Не нашлось места проблеме химиотерапии и применения интерферонов в лечении РШМ. Однако, мы полагаем, что, показав непроходящую важность проблемы, мы смогли убедить читателя в перспективности ее изучения, что позволит интересующемуся и думающему студенту и молодому врачу обратиться к специальной литературе.
Литература:
Василевская Л.Н. Кольпоскопия. М., Медицина, 1987.
Патология влагалища и шейки матки. Под ред. В.И.Краснопольского.1997
Г.Н.Минкина, И.Б.Манухин, Г.А.Франк. Предрак шейки матки. М., 2001.
Бохман Я.В. Руководство по онкогинекологии. Л., 1989.
Заболеваниия шейки матки, влагалища и вульвы. Под ред. В.Н.Прилепской.М.,2000.
