
Лекции / organic_2011_6
.pdf
МОДУЛЬ 4 |
Карбоновые кислоты |
1 |
|
||
|
|
|
Методы получения |
|
|
Окисление углеводородов |
|
|
[O]
CH3(CH2)nCH3 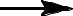 RiCO2H + RjCO2H
RiCO2H + RjCO2H
Но: O2
|
|
|
|
CoAc2/180o/50 атм. |
|
X2 |
ArCX3 |
H3O+ |
|
||
ν |
t |
|
|||
|
h |
|
|
||
ArCH |
KMnO4 |
|
|
ArCO2H |
R |
|
|
|
|||
3 |
HO-, t |
|
|
|
|
|
|
|
|
|
|
X2 = Cl2, Br2
неселективный разрыв углеводородной цепи
CH3CO2H 50%
KMnO4, H+
R
RCO2H
1.O3 
2.H2O
R |
|
|
|
R' |
|
[O] |
RCO H + R'CO H [O] = KMnO4/H+/t, Cr6+/H+/t |
||
|
|
|
|
||||||
|
|
|
|
||||||
|
|
|
|
|
|
|
|
2 |
2 |
Окисление спиртов |
|
|
|||||||
|
|
|
|
|
|
[O] |
RCO2H [O] = Cr6+/H+, t; Mn7+/H+, t; X2/HO- |
||
|
|
R |
|
OH |
|
|
|||
|
|||||||||

Из алкилгалогенидов |
2 |
|
|
|
|
|
|
|
1. CO2 |
RMgX |
Mg |
RX |
|
CN- |
|
|
RCN |
|
H3O+ |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
RCO2H |
|
|
|
|
|
|
|
|
|
|
Li |
SN2 |
|
|
|
RCO2H |
||||||||
|
|
2. H O+ |
RLi |
|
|
|
||||||||||||||||||
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Окисление альдегидов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
[O] |
|
RCO H |
[O] = Cr6+/H+, t; Mn7+/H+, t; X /HO-, O |
|
|
|||||||||||||||||||
RCHO |
|
|
|
|
(воздух); |
|||||||||||||||||||
|
||||||||||||||||||||||||
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
2 |
2 |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Ag+ (реактив Толленса, реакция "серебряного |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
зеркала"); R'CO3H (реакция Байера-Виллигера) |
|||||||||||
Реакции диспропорционирования альдегидов |
|
|
|
|
|
|||||||||||||||||||
реакция Канницаро (R - не содержит протонов у α-углеродного атома |
||||||||||||||||||||||||
|
|
|
|
1. HO- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
RCHO |
|
|
|
|
RCH OH + RCO H |
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
2. H+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
реакция Тищенко |
|
O |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
Al(OR')3 |
|
|
|
H O+ |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
RCHO |
|
|
|
|
|
|
3 |
|
|
|
RCH2OH + RCO2H |
|||||||||||||
|
|
|
|
|
|
R |
|
|
O |
R |
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
3
Из кетонов
Окисление происходит с разрушением скелета
O
|
|
|
MnO -, H+ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
4 |
|
|
R CH CO H |
R CO H |
+ R |
CH CO H + R CO H |
||||||
R1H2C |
|
|
CH2R2 |
|
t |
||||||||||||
|
|
|
1 |
2 |
2 |
+ |
1 |
2 |
2 |
2 2 |
2 2 |
||||||
R'CO3H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
O |
|
H3O |
+ |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
CH2R2 |
|
R CH CO H |
+ R |
CH OH |
|
|
||||||||
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
R1H2C |
|
|
O |
|
|
|
|
1 |
2 |
2 |
|
2 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
RCOCH3 |
X2 |
RCO2- |
+ |
CX3H галоформный распад |
|||
|
HO- |
|||||||
|
|
X = Cl, Br |
|
|
|
|
||
|
|
|
|
|
|
|
||
Перегруппировка Фаворского |
|
|
|
|
|
|||
|
O |
Br2 |
|
O |
R HO |
- |
|
O |
R |
R |
R |
|
R |
R |
|||
H+ |
|
|
||||||
|
|
-H2O |
|
-Br- |
||||
|
|
|
|
|
Br |
|
|
Br |
|
O |
|
HO |
O- |
|
4 |
|
HO |
- |
CO H |
CO2- |
||
|
|
|
|
2 |
R |
|
|
|
|
|
|
R |
|
R |
R |
|
R |
R |
R |
R |
Реакция Вильгеродта
Ar |
S |
|
N |
H3O |
+ |
OH |
|
|
Ar |
||||||
O |
|
|
|
Ar |
|
||
|
NH |
S |
|
|
|
O |
|
|
|
|
|
|
|
||
Гидролиз производных карбоновых кислот |
|
|
|
|
|||
RCN |
H O+ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
RCO2Et |
3 |
RCO2H |
|
|
|
|
|
|
|
|
|
|
|
||
RCONH2 |
|
|
|
|
|
|
|
Синтез Реппе R |
|
CO/Ni(CO)4 |
|
|
|
|
|
|
R |
CO2H |
|
|
|
|
|
|
|
CO/Ni(CO)4 |
|
CH OH |
|
CO |
CH3CO2H |
|
|
|
|
|
|||
R |
|
R |
CO2H |
3 |
[Rh3+], 180o, 30 атм. |
99% |
|
|
|
||||||
|
|
OH2 |
|
CO+ |
5 |
||
|
|
|
CO H |
||||
|
|
|
|
|
|
|
2 |
HCO2H |
|
|
CO |
H2O |
|
||
OHH2SO4 |
|
|
- H2O |
- H+ |
|
||
|
|
|
|
|
|
||
HCO2H |
H+ |
O |
|
- H2O |
CO |
|
|
|
H |
|
- H+ |
|
|
||
|
|
OH2 |
|
|
|
||
|
|
|
|
|
|
||
|
|
+ |
|
OH |
HCO2H |
|
|
|
|
|
H2SO4 |
|
|
||
|
|
|
|
|
CO2H |
|
|
|
|
|
|
|
|
|
|
|
|
H |
+ |
- H O |
|
|
|
|
|
|
2 |
1. CO |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2. H2O |
|
|
|
|
- (CH3)CH |
|
|
|
|
|
Синтез муравьиной кислоты (в промышленности)
NaOH |
CO |
HCO2Na |
H3O+ |
HCO H |
|
p, t |
|||||
|
|||||
|
|
|
2 |

Удлинение цепи. Метод Арнта-Айстерта |
6 |
|
SOCl2 |
O |
|
RCO2H |
H2C N N |
||
R |
|||
|
|
Cl |
|
|
O |
O |
|
|
N |
N |
|
R |
N |
N |
|
|
R |
||
|
|
α-диазокетон |
Перегруппировка Вольфа
O |
|
|
N |
Ag2O |
C O |
N |
ТГФ/H2O |
|
R |
R |
|
|
|
кетен |
O-
R
 Cl
Cl
O
R
H2O
R
N - H+
 N
N
N
N 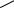
CO2H

Свойства карбоновых кислот |
7 |
||
|
|
||
|
|
|
|
|
Тривиальные названиянекоторых кислот RCO2H: |
|
|
|
R = Н (муравьиная), CH3 (уксусная), C2H5 (пропионовая), C3H7 |
(масляная), |
|
|
C4H9 (валериановая), C5H11 (капроновая), C15H31 (пальмитиновая), |
|
|
|
C16H33 (маргариновая), C17H35 (стеариновая) |
|
|
Номенклатурное название кислот – «алкановая» (метановая, этановая, пропановая)
Высокая растворимость в воде, высокая температура кипения
R
Кислотность
O |
± H+ |
OH |
|
O

 H
H O
O
R

 R
R
O H
H

 O
O
O O
R

 R
R
O |
O делокализация заряда |
Акцепторные заместители R повышают устойчивость аниона (и кислотность соответствующей кислоты), доноры - снижают
RCO2H
R H CH3 C6H5 CF3
рК 3.75 4.75 4.2 0.2
Сила кислоты Х-C6H2CO2H |
|
|
|
|
|
|
|
8 |
|||||||||
|
X |
|
2-CO2H |
|
2-OH |
|
4-NO2 |
|
4-CO2H |
|
|
|
|
|
|
|
|
|
|
|
|
|
3-CO H |
2-CH |
H |
3 (4)-CH |
4-OCH |
4-NH |
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
2 |
3 |
|
3 |
3 |
|
|
|
pK |
|
2.95 |
|
2.98 |
|
3.4 |
|
3.54 |
3.62 |
3.9 |
4.2 |
4.3 |
4.49 |
4.92 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Отсутствие прямого сопряжения заряженных атомов кислорода с заместителем в ароматическом кольце
R |
R |
O |
O- |
O- |
O |
"Косвенное" влияние мезомерных заместителей
|
CO - |
CO2- |
CO2- |
CO - |
|
2 |
|
|
2 |
X |
X |
O2N |
|
O |
|
N |
|||
|
донор |
|
акцептор |
O |
9
|
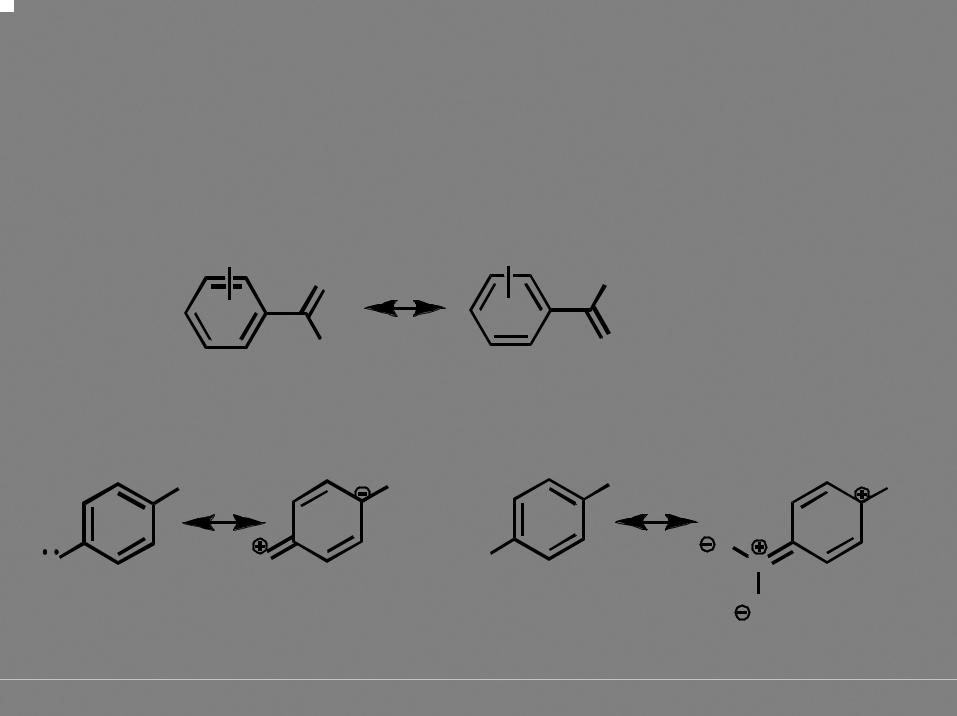
Влияние орто-заместителя |
|
|
O |
O |
O |
O- |
|
|
||
|
-H+ |
|
CH3 |
O H |
O |
|
|
|
|
||
O H |
O H |
|
|
|
более устойчивая |
нарушение планарности |
|
|
ВМВС |
|
(сопряжения) |
Производные карбоновых кислот 
Образование солей
|
PhOH |
NaOH |
|
PhONa |
||
|
|
|||||
|
|
O |
|
|||
R |
|
|
|
NaHCO3 |
RCO2Na |
|
|
|
|
|
|
||
|
OH |
|||||
|
|
|
||||
Образование сложных эфиров (реакция этерификации) |
10 |
|
RCO2H R'OH H+
Фишер
O |
H+ |
|
OH |
R |
|
R |
R |
OH |
|
|
OH |
RCO2R' + H2O
OH |
|
OH |
H |
± H+ |
|
R |
|
||
R'OH |
|
O |
|
|
|
|
R' |
|
|
OH |
|
OH |
|
|
|
|
|
|
OH |
±H+ |
R |
|
|
|
O |
OH R'
O
R'
R O
|
OH2 |
±H2O |
R |
O |
R |
O |
± H+ |
|
R |
O |
|||||||
|
R' |
|||||||
R' |
|
R' |
|
|
||||
|
OH |
|
OH |
|
OH |
|
||
|
|
|
|
|
Все стадии процесса обратимы. Положение равновесия определяется количеством воды - при проведении этерификации воду необходимо удалять. В избытке воды
в кислой среде происходит гидролиз эфира по той же самой схеме.
